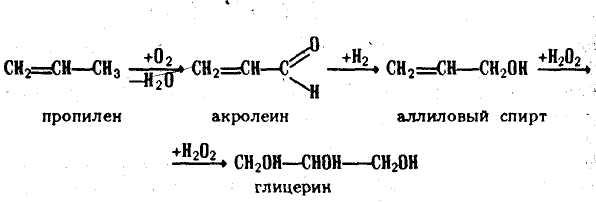Областное государственное бюджетное профессиональное образовательное учреждение
«Димитровградский техникум профессиональных технологий
имени Героя Советского Союза М.С. Чернова»
СБОРНИК МЕТОДИЧЕСКИХ УКАЗАНИЙ
ДЛЯ СТУДЕНТОВ ПО ВЫПОЛНЕНИЮ
ЛАБОРАТОРНО - ПРАКТИЧЕСКИХ РАБОТ
по учебной дисциплине
ХИМИЯ
ДЛЯ СТУДЕНТОВ ОЧНОЙ ФОРМЫ ОБУЧЕНИЯ
35.01.11 Мастер по техническому обслуживанию машинно-тракторного парка
15.01.05 Сварщик,
г. Димитровград
2016 г.
| РАССМОТРЕНА на заседании ПЦК Протокол заседания ПЦК №___ от «___» ___________2016г. ____________
| УТВЕРЖДАЮ Зам. директора по УР ______________ Н.И. Дьяконова «___» _______________ 2016г. |
Автор: Попкова Оксана Александровна, преподаватель
Методические указания для выполнения практических занятий по учебной дисциплине Химия разработаны в соответствии с требованиями ФГОС СОО.
Методические указания по выполнению практических занятий адресованы студентам очной формы обучения.
Методические указания включают в себя учебную цель, перечень образовательных результатов, заявленных в ФГОС СОО, задачи, обеспеченность занятия, краткие теоретические и учебно-методические материалы по теме, вопросы для закрепления теоретического материала, задания для практической работы студентов и инструкцию по ее выполнению, методику анализа полученных результатов, порядок и образец отчета о проделанной работе.
Методические указания предназначены для преподавателей, студентов профессиональных образовательных учреждений.
Введение
В данных методических указаниях описаны методики выполнения лабораторных работ и практических заданий по общей и органической химии, дано краткое теоретическое введение к каждой теме, которое при самостоятельной подготовке поможет студентам выполнить эти работы. В приложении к указаниям приведены справочные таблицы, правила техники безопасности и мероприятия по оказанию первой помощи. Методические указания выполнены в соответствии с рабочей программой составленной на основе государственного образовательного стандарта среднего (полного) общего образования по химии (базовый уровень). В ней предусмотрено 16 на проведение практических и лабораторных занятий.
Пособие поможет студентам совершенствовать практические умения и закрепить теоретические знания по дисциплине «Химия».
Описаны методики выполнения лабораторных работ и практических заданий, приведены контрольные вопросы, фиксирующие внимание студентов на наиболее важные этапы изучаемого материала. Контрольные вопросы составлены на основе личностно-ориентированного подхода в обучении.
В процессе выполнения лабораторных работ и практических заданий студенты должны наблюдать за ходом эксперимента, отмечать все его особенности (изменение цвета, тепловые эффекты, выпадение осадка, образование газообразных веществ). Результаты наблюдений записывают в тетради для лабораторных работ, поддерживаясь определенной последовательности:
- дата выполнения, название лабораторной работы;
- цель работы;
- краткие теоретические сведения, касающиеся данной работы;
- зарисовка схемы установки (выполняется карандашом);
- результаты опытов должны быть внесены в таблицу;
- выводы.
В приложении к пособию приведены справочные таблицы, правила техники безопасности и мероприятия по оказанию первой помощи.
Рекомендации по составлению письменного отчета о выполненной практической работе.
Для оформления отчета о работе удобно использовать табличную форму:
| Ход опыта | Наблюдение | Уравнение реакции | Вывод |
|
|
|
|
|
«Ход опыта» записывается кратко, вместо словесного описания последовательности действий используется рисунок. Обязательно указываются условия осуществления химических реакций.
В графе «Наблюдения» рисунок или схема поясняются следующими обозначениями:
-образование осадка: (указывается цвет осадка и его характер (мучнистый, творожистый, студенистый);
-выделение газообразного вещества: (указывается цвет газа, запах, плотность).
В графе «Уравнения реакций» учащиеся могут выражать только сущность реакций ионного обмена, т.е. записывать только сокращенные ионные уравнения реакций. Для окислительно-восстановительных реакций записываются молекулярное уравнение реакции, выражается ее сущность методом электронного баланса или электронно-ионным методом. Указываются названия процессов и функции веществ.
Особого внимания требует заполнение графы «Вывод». Вывод должен соответствовать условию задачи, быть полным и обоснованным.
Оценка выполнения практических (лабораторных) работ, опытов
Оценка "5" ставится, если студент:
1) правильно определил цель опыта;
2) выполнил работу в полном объеме с соблюдением необходимой последовательности проведения опытов и измерений;
3) самостоятельно и рационально выбрал и подготовил для опыта необходимое оборудование, все опыты провел в условиях и режимах, обеспечивающих получение результатов и выводов с наибольшей точностью;
4) научно грамотно, логично описал наблюдения и сформулировал выводы из опыта. В представленном отчете правильно и аккуратно выполнил все записи, таблицы, рисунки, чертежи, графики, вычисления и сделал выводы;
5) правильно выполнил анализ погрешностей (9-11 классы).
6) проявляет организационно-трудовые умения (поддерживает чистоту рабочего места и порядок на столе, экономно использует расходные материалы).
7) эксперимент осуществляет по плану с учетом техники безопасности и правил работы с материалами и оборудованием.
Оценка "4" ставится, если студент выполнил требования к оценке "5", но:
1. опыт проводил в условиях, не обеспечивающих достаточной точности измерений;
2. или было допущено два-три недочета;
3. или не более одной негрубой ошибки и одного недочета,
4. или эксперимент проведен не полностью;
5. или в описании наблюдений из опыта допустил неточности, выводы сделал неполные.
Оценка "3" ставится, если студент:
1. правильно определил цель опыта; работу выполняет правильно не менее чем наполовину, однако объём выполненной части таков, что позволяет получить правильные результаты и выводы по основным, принципиально важным задачам работы;
2. или подбор оборудования, объектов, материалов, а также работы по началу опыта провел с помощью учителя; или в ходе проведения опыта и измерений были допущены ошибки в описании наблюдений, формулировании выводов;
3. опыт проводился в нерациональных условиях, что привело к получению результатов с большей погрешностью; или в отчёте были допущены в общей сложности не более двух ошибок (в записях единиц, измерениях, в вычислениях, графиках, таблицах, схемах, анализе погрешностей и т.д.) не принципиального для данной работы характера, но повлиявших на результат выполнения; или не выполнен совсем или выполнен неверно анализ погрешностей (9-11 класс);
4. допускает грубую ошибку в ходе эксперимента (в объяснении, в оформлении работы, в соблюдении правил техники безопасности при работе с материалами и оборудованием), которая исправляется по требованию учителя.
Оценка "2" ставится, если студент:
1. не определил самостоятельно цель опыта; выполнил работу не полностью, не подготовил нужное оборудование и объем выполненной части работы не позволяет сделать правильных выводов;
2. или опыты, измерения, вычисления, наблюдения производились неправильно;
3. или в ходе работы и в отчете обнаружились в совокупности все недостатки, отмеченные в требованиях к оценке "3";
4. допускает две (и более) грубые ошибки в ходе эксперимента, в объяснении, в оформлении работы, в соблюдении правил техники безопасности при работе с веществами и оборудованием, которые не может исправить даже по требованию учителя.
Оценка тестовых работ
1.С помощью коэффициента усвоения (К)
К = А:Р, где
А – число правильных ответов в тесте; Р – общее число ответов
| Коэффициент К | Оценка |
| 0,9-1 | «5» |
| 0,8-0,89 | «4» |
| 0,7-0,79 | «3» |
| Меньше 0,7 | «2» |
2.Традиционная
80% -100% - оценка «5»
60 – 80 % - оценка «4»
40 – 60% - оценка «3»
0 – 40% - оценка «2»
Лабораторная работа № 1
Тема: «Получение эмульсии моторного масла»
Цель:Овладение умениями приготовления дисперсионных систем, навыками определения их свойств и работы с микроскопом.
Оборудование:Моторное масло, вода. Химические стаканы, стеклянные палочки, микроскопы.
Теоретические основы
Эмульсия относится к дисперсной системе ВЗВЕСИ. Эму́льсия (новолат. emulsio, от лат. emulgeo — дою, выдаиваю) — дисперсная система с жидкой дисперсионной средой и жидкой дисперсной фазой. Эмульсии состоят из несмешиваемых жидкостей. Например, молоко — одна из первых изученных эмульсий, в нём капельки жира распределены в водной среде. Они постепенно поднимаются на поверхность, поскольку их плотность меньше, чем плотность воды. В молоке за несколько часов образуется слой сливок. Молоко является не устойчивой эмульсией. Получение устойчивых концентрированных эмульсий возможно только в присутствии специальных эмульгаторов.
К эмульгаторам, способным образовывать прочные защитные пленки, относятся высокомолекулярные соединения, например, сапонин, белки (желатин, казеин), каучук, смолы, соли жирных кислот (мыла) и др. Наибольший интерес представляют собой желатированные или твердые эмульсии.Желатированные эмульсии характеризуются большой устойчивостью, прочностью и другими механическими свойствами. Примерами таких эмульсий являются консистентные смазки, маргарин, сливочное масло, густые кремы. Обычными эмульсиями являются жидкости, применяемые при обработке металлов.
Эмульсии играют большую роль при мыловарении, в технологии пищевых продуктов (сливочное масло, маргарин), при переработке натурального каучука, в живописи. В виде эмульсий получают смазочно-охлаждающие жидкости, битумные материалы, пропиточные композиции, пестицидные препараты, лекарственные и косметические средства.
Последовательность выполнения работы:
Приготовление эмульсии моторного масла
1.В химический стакан поместите небольшое количество моторного масла и прилейте 1-2 мл воды. Все тщательно перемешайте.
2. Поместите каплю, эмульсии на стеклянную пластину и рассмотрите под микроскопом.
3. Опишите наблюдаемое явление. Записи внесите в таблицу по форме:
| Название дисперсной системы | Дисперсионная среда | Дисперсная фаза | Обозначение агрегатного состояния | Примеры дисперсных систем |
Контрольные вопросы:
1. Укажите, что в полученной вами дисперсной системе «эмульсия» является дисперсионной средой, а что дисперсной фазой?
2. Разделяются ли со временем дисперсионная среда и дисперсная фаза в данной эмульсии?
3. Каково значение эмульсий в повседневной жизни?
Сформулируйте вывод по работе.
Лабораторная работа № 2
Тема: «Получение суспензии карбоната кальция в воде»
Цель: Овладение умениями приготовления дисперсионных систем, навыками определения их свойств и работы с микроскопом.
Оборудование:Карбонат кальция (мел) вода. Химические стаканы, стеклянные палочки, микроскопы.
Теоретические основы
Дисперсные (раздробленные) системы являются гетерогенными, в отличие от истинных растворов (гомогенных). Они состоят из сплошной непрерывной фазы – дисперсионной среды и находящихся в этой среде раздробленных частиц того или иного размера и формы – дисперсной фазы.
Обязательным условием существования дисперсных систем является взаимная нерастворимость диспергированного вещества и дисперсионной среды.
Дисперсные системы классифицируют:
1. по степени дисперсности;
2. по агрегатному состоянию дисперсной фазы и дисперсионной среды;
3. по интенсивности взаимодействия между ними;
4. по отсутствию или образованию структур в дисперсных системах.
В зависимости от размеров частиц дисперсной фазы дисперсные системы бывают в виде взвесей и коллоидов.
Взвеси (размер дисперсной фазы более 100нм) ─ эмульсии, суспензии, аэрозоли.
Коллоидные растворы (размер дисперсной фазы от 1 до 100нм) – гели, золи.
Агрегатное состояние дисперсных систем бывает разным и обозначается двумя буквами.
Например: аэрозоль обозначается Г-Ж.

Г – газообразная дисперсионная среда, Ж – жидкая дисперсная фаза.
Последовательность выполнения работы:
Приготовление суспензии мела.
1.В химический стакан поместите небольшое количество порошка мела и прилейте немного воды. Все тщательно перемешайте. Запишите наблюдения.
2. Поместите каплю, суспензии на стеклянную пластину и рассмотрите под микроскопом.
3. Опишите наблюдаемое явление. Записи внесите в таблицу по форме:
| Название дисперсной системы | Дисперсионная среда | Дисперсная фаза | Обозначение агрегатного состояния | Примеры дисперсных систем |
Контрольные вопросы:
1. Укажите, что в полученной вами дисперсной системе «суспензия» является дисперсионной средой, а что дисперсной фазой?
2. Разделяются ли со временем дисперсионная среда и дисперсная фаза в данной суспензии?
Сформулируйте вывод по работе.
Практическое занятие № 1
Тема: « Приготовление растворов различных видов концентрации»
Цель:Овладение навыками приготовления растворов определенной концентрации, с соблюдением правил техники безопасности.
Оборудование: Хлорид натрия (NaCl), 60% концентрированная серная кислота, дистиллированная вода, весы, бюксы, мерная колба (100мл).
Теоретические основы
Раствор – гомогенная система, состоящая из растворенного вещества и растворителя.
При решении задач пользуются формулами:
W Р.В. = m Р.В. / m Р-РА.
mР-Ра = m Р.В. + m Н2О
m Р-РА – масса раствора, г.
m Р.В. – масса растворенного вещества, г.
m Н2О – масса воды, г.
WР.В. - массовая доля растворенного вещества.
10% раствор вещества содержит 10г растворенного вещества и 90г воды в 100г раствора.
Например: Определите массовую долю растворенного вещества, если 10 г его содержится в 100 г раствора. Какая масса воды содержится в растворе.
Дано: mР.В. = 10 г; mР-Ра = 100 г
Найти: W Р.В.; m Н2О
Решение:
1. W Р.В. = ; W Р.В. = = 0,1
2. mн2о = mр-ра – mр.в.; mн2о = 100 – 10 = 90 г
Ответ: 0,1; 90 г
Порядок выполнения работы:
1.Приготовление 2% раствора соли.
Взвесьте в бюксе 2г хлорида натрия и пересыпьте через воронку в колбу на 100мл. Затем в колбу добавьте воды до метки. Полученный раствор имеет 2% концентрацию NaCl в 100г раствора или 0,02 массовую долю NaCl в 100г раствора.
2. Приготовление 100 мл 10% раствора серной кислоты.
Раствор готовят из 60% концентрированного раствора серной кислоты плотностью 1,5 г/мл. Для этого мензуркой отмеряют 11 мл 60% концетрированной серной кислоты и мерным цилиндром 100-11=99 мл воды. Воду выливают в колбу, а затем добавляют из мензурки кислоту. Полученный раствор содержит 0,1 массовую долю H2SO4.
Контрольные вопросы
1. Что такое растворы?
2.Из чего складывается масса раствора?
3. Как определяется массовая доля растворенного вещества в растворе?
4. Как приготовить10% раствор щелочи NaOH? Какая масса NaOH и воды содержится в таком растворе?
Сформулируйте вывод по работе.
Лабораторная работа № 3
Тема: «Испытание растворов кислот индикатором»
Цель: Овладение навыками проведения химических опытов, с соблюдением правил техники безопасности, подтверждающих свойства кислот.
Оборудование:штатив с пробирками, соляная и серная кислота, индикаторы фенолфталеин, красный лакмус, метиловый оранжевый.
Теоретические основы
Кислоты — химические соединения, способные отдавать катион водорода (кислоты Брёнстеда) либо соединения, способные принимать электронную пару с образованием ковалентной связи (кислоты Льюиса)
В быту и технике под кислотами обычно подразумеваются кислоты Брёнстеда, образующие в водных растворах избыток ионов гидроксония H3O+. Присутствие этих ионов обуславливает кислый вкус растворов кислот, способность менять окраску индикаторов и, в высоких концентрациях, раздражающее действие кислот. Подвижные атомы водорода кислот способны замещаться на атомы металлов с образованием солей, содержащих катионы металлов и анионы кислотного остатка. Одним из общих свойств кислот является их кислый вкус. Рассмотрим другие общие свойства кислот.
Известно, что при добавлении в крепкий чай лимона цвет чая становится светлее. Так воздействует на чай лимонная кислота. Кислоты способны изменять окраску некоторых красящих веществ. С помощью этого свойства можно отличить кислоты от других веществ.
Вещества, изменяющие свой цвет под действием других веществ, называют индикаторами. Химики для идентификации кислот обычно используют следующие индикаторы: лакмус (в нейтральной среде – фиолетовый), метилоранж (в нейтральной среде – оранжевый).
При добавлении к раствору соляной кислоты лакмус становится красным. Метилоранж в кислоте также краснеет.
Способность изменять окраску индикаторов является общим свойством кислот.
Последовательность выполнения работы:
Испытание раствора кислоты индикаторами
1. Нанесите стеклянной палочкой по одной капле растворов серной исоляной кислоты на полоски индикаторов— универсальный, синий лакмус, наблюдайте за окраской индикатора. 2. Приготовьте для опытов 4 пробирки.
3. В две пробирки налейте по 0,5 млразбавленной серной кислоты, а вдругие две— такое же количество соляной кислоты.
4 .В каждую из двух пробирок ссоляной исерной кислотами добавьте несколько капель раствора метилового оранжевого, наблюдайте за изменением окраски растворов.
5. В оставшиеся две пробирки ссоляной исерной кислотами добавьте несколько капель раствора фенолфталеина, также наблюдайте за изменением окраски растворов.
6. Результаты наблюдений запишите отчет в виде таблицы:
| № | Кислота | Окраска индикаторов |
| лакмус синий | метилоранж | универсальный | фенолфталеин |
| 1 | Серная |
|
|
|
|
| 2 | Соляная |
|
|
|
|
Контрольные вопросы:
1.Какие индикаторы изменяют цвет в растворах кислот?
2.Какой индикатор не изменил цвет в растворах кислот?
3.Какой стал цвет лакмуса в кислотах?
4.Какой стал цвет метилового оранжевого в кислотах? Почему кислоты разные, а изменение цвета индикаторов в растворах кислот одинаковое?
Сформулируйте вывод по работе.
Лабораторная работа № 4
Тема: «Испытание растворов щелочей индикатором»
Цель: Овладение навыками проведения химических опытов, с соблюдением правил техники безопасности, подтверждающих свойства оснований.
Оборудование:штатив с пробирками, горелка, держатель, растворы NaOH, CuSO4, FeCl3, индикаторы фенолфталеин, красный лакмус, метиловый оранжевый.
Теоретические основы
Основания – электролиты диссоциирующие в воде на ионы металлов и гидроксогрупп.
Ca (OH) 2 ↔ Ca2+ + 2OH-
Основания бывают растворимые в воде (щелочи) и нерастворимые в воде.
Ca (OH) 2 ↔ Ca2+ + 2OH-
Называются основания гидроксидами: Ca (OH) 2 – гидроксид кальция;
Fe (OH)2 – гидроксид железа (II); Fe (OH)3 – гидроксид железа (III)
Химические свойства оснований.
1. Щелочи взаимодействуют:
- с кислотными оксидами 2NaOH + CO2 = Na2CO3 + H2O
- с кислотами NaOH + HCl = NaCl + H2O
- с солями, если образуется нерастворимое основание
2NaOH + ZnCl2 = 2NaCl +Zn(OH)2↓
2. Основания разлагаются при нагревании:
Zn (OH) 2↓ → ZnO + H2O
Основания взаимодействуют с кислотами:
Zn (OH) 2↓ + 2HCl = ZnCl2 + 2H2O
Последовательность выполнения работы:
1.Испытание раствора щелочи индикаторами.
В три пробирки поместите 2мл раствора щелочи NaOH. В первую пробирку добавьте 1 каплю фенолфталеина, во вторую 1 каплю красного лакмуса, в третью 1 каплю метилового оранжевого. Запишите наблюдения.
Контрольные вопросы:
1.Какие соединения называются основаниями?
2. Какие основания относятся к растворимым основаниям?
3. Выберите, какие вещества относятся к основаниям: NaCl; Cu(OH)2; HNO3; NaOH; H2CO3.
Сформулируйте вывод по работе.
Лабораторная работа № 5
Тема: « Реакции, идущие с образованием осадка, газа и воды»
Цель:ознакомиться на практике с реакциями ионного обмена различных типов и условиями их протекания
Оборудование: Штатив с пробирками, держатель, растворы NaOH, H2SO4,CuSO4, Na2CO3, NH4Cl, Na2SO4, ZnSO4, BaCl2, Na и вода, Mg, Zn, Fe; растворы кислот 5% HCl,10% HCl, 20% HCl, H2SO4; оксид CuO (II). Штатив с пробирками, держатель, горелка, градусник.
Теоретические основы
Необратимые реакции протекают до конца, если выполняется три условия: выпадает осадок, образуется газообразное вещество и образуется малодиссоциирующее вещество (вода).
Образование осадка.
NaCl + AgNO3 = AgCl↓ + NaNO3 молекулярное уравнение
Na+ + Cl- + Ag+ + NO3- = AgCl↓ + Na+ + NO3— полное ионное уравнение
Ag+ + Cl- = AgCl↓ сокращенное ионное уравнение
Образование газообразного вещества.
(NH4)2S + 2HCl = 2NH4Cl + H2S↑
2NH4+ + S2- + 2H+ + 2Cl- = 2NH4+ + 2Cl- + H2S↑
2H+ + S2- = H2S↑
Образование воды.
H2SO4 + 2KOH = K2SO4 + 2H2O
2H+ + SO42- + 2K+ + 2OH- = 2K+ + SO42- + 2H2O
2H+ + 2OH- = 2H2O
Порядок выполнения работы:
1.В пробирку налейте 2 мл раствора хлорида бария и добавьте столько же раствора сульфата натрия. Что наблюдаете? Сделайте вывод и напишите уравнение химической реакции в молекулярном и сокращенном ионном виде.
2.В пробирку налейте 2 мл раствора сульфата меди и прилейте раствор гидроксида натрия. Что наблюдаете? Сделайте вывод и напишите уравнение химической реакции в молекулярном и сокращенном ионном виде.
3.Налейте в пробирку 2 мл раствора карбоната натрия, добавьте 1мл соляной кислоты. Что наблюдаете? Сделайте вывод и напишите уравнение химической реакции в молекулярном и сокращенном ионном виде.
4.Налейте в пробирку 2 мл гидроксида натрия, добавьте каплю фенолфталеина. Что наблюдаете? Затем добавьте по каплям соляную кислоту до полного обесцвечивания раствора. Сделайте вывод и напишите уравнение химической реакции в молекулярном и сокращенном ионном виде.
5.В пробирку налейте 2 мл раствора карбоната натрия и добавьте столько же раствора уксусной кислоты. Что наблюдаете? Сделайте вывод и напишите уравнение химической реакции в молекулярном и сокращенном ионном виде.
6.В пробирку налейте 2 мл раствора гидроксида меди (II) и добавьте столько же раствора уксусного альдегида, нагрейте пробирку с содержимым. Что наблюдаете? Сделайте вывод и напишите уравнение химической реакции в молекулярном
Образец выполнения работы
1. В пробирку с сульфатом натрия приливаем раствор хлорида бария. Выпадает осадок белого цвета
Na2SO4 + BaCl2 = 2NaCl + BaSO4↓
2Na+ + SO42- + Ba2+ + 2Cl- = 2Na+ + 2Cl- + BaSO4↓
Ba2+ + SO42- = BaSO4↓
Реакция ионного обмена протекает до конца, т.к. выпадает осадок.
Контрольные вопросы
При каких условиях возможны необратимые реакции?
Запишите необратимую реакцию, которая протекает с выделением осадка.
Запишитетипы химических реакций по имеющимся классификациям.
Сформулируйте вывод по работе.
Лабораторная работа № 6
Тема: «Реакция замещения меди железом в растворе медного купороса»
Цель: определение методом электронного баланса окислителя и восстановителя, проведение реакций ионного обмена, идущих до конца.
Оборудование:штатив, пробирки, спиртовка, держатель, спички, медная проволока, железный гвоздь,сульфат меди, хлорид железа, гидроксид натрия, карбонат натрия , серная кислота, соляная кислота, индикаторы: фенолфталеин, лакмус.
Теоретические основы
Алгоритм действий:
Сначала запишем формулы исходных и конечных веществ реакции с указанием степеней окисления элементов, которые её изменяют:
0 +2 +2 0
Сu + Нg(NO3)2 = Cu(NO3)2 + Нg
Медь отдаёт два электрона, её степень окисления повышается от 0 до +2. Медь – восстановитель.
Ртуть со степенью окисления +2 понижает её до 0. Нитрат ртути – окислитель. Эти изменения степеней окисления можно выразить электронными уравнениями:
0 +2
Cu – 2 е− = Сu 1
+2 0
Нg + 2 е− = Нg 1
из которых следует, что при восстановителе и окислителе коэффициенты равны 1.
Окончательное уравнение реакции:
Сu + Нg(NO3)2 = Cu(NO3)2 + Нg
Чтобы проверить правильность составленного уравнения, подсчитаем число атомов каждого элемента в правой и левой части уравнения. Например, кислорода в правой части 6 атомов, в левой также 6 атомов, ртути – 1 и 1, меди – тоже 1 и 1. Значит, уравнение составлено правильно.
Переписываем это уравнение в ионной форме:
Cu + Hg 2+ + 2NO3− = Cu2+ +2NO3− + Hg
И после сокращения одинаковых ионов получим
Cu0 + Hg2+ = Cu2+ + Hg0
Последовательность выполнения работы:
1. Определение окислителя и восстановителя
а) Опустить в пробирку металлический гвоздь и налить 1,5 мл раствора сульфата меди. Что наблюдаете? Составить уравнение реакции. Методом электронного баланса определить окислитель и восстановитель.
б) В пламени спиртовки поджечь медную проволоку. Что наблюдаете? Составить уравнение реакции. Методом электронного баланса определить окислитель и восстановитель.
2. Образование осадка
В пробирку налить 1 мл раствора хлорида железа и добавить 1 мл раствора гидроксида натрия. Что наблюдаете? Составить уравнения реакций в молекулярной и ионной формах.
Выделение газа
Налить в пробирку 1 мл карбоната натрия, добавить 2-3 капли лакмуса, затем прилить 1 мл серной кислоты. Что наблюдали? Составить уравнения реакций
в молекулярной и ионной формах.
Образование воды
Налить в пробирку 1 мл гидроксида натрия, добавить 2-3 капли фенолфталеина, затем прилить 1 мл соляной кислоты. Что наблюдали? Составить уравнения реакций в молекулярной и ионной формах.
Контрольные вопросы:
1. В каких случаях реакции ионного обмена идут до конца?
2. Дайте определения следующим понятиям: окисление, восстановление, окислительно – восстановительные реакции.
Сформулируйте вывод по работе.
Лабораторная работа № 7
Тема: «Распознавание руд железа»
Цель: Ознакомиться с представителями железных руд и их внешними признаками
Оборудование:Коллекция «Железные руды»
Теоретические основы
Важнейшими железными рудами являются:
Fe3O4 – магнетит (магнитный железняк) 72% Fe
Fe2O3 – гематит (красный железняк) 65% Fe
Fe2O3 х nH2O – лимонит (бурый железняк) 60% Fe
Fe2S – пирит (серный колчедан) 46,6% Fe
Fe2СO3 – сидерит (железный шпат) 35% Fe
В современной технике и в обыденной жизни применяются сплавы железа: чугун, сталь. Эти сплавы отличаются разным содержанием углерода. В чугуне углерода содержится от 1,7% до 5%, в стали – от 0,3% до 1.7%.
Последовательность выполнения работы:
1.Ознакомление с образцами природных соединений железа
1. Рассмотрите выданные образцы природных соединений железа.
2. Заполните таблицу:
| Название минерала
| Формула и название основной составной части
| Внешний вид
| Применение
|
| магнетит |
|
|
|
| гематит |
|
|
|
| лимонит |
|
|
|
| пирит |
|
|
|
| сидерит |
|
|
|
2. Распознавание железных руд
Возьмите образцы трех типов железных руд — гематита, лимонита и магнетита. Проведите ими по стенке фарфоровой ступки или обратной стороне белой кафельной плитки.
По цвету остающейся полосы можно идентифицировать руду. Гематит оставляет на фарфоре полосу бурого цвета, лимонит — желтого, магнетит — черного
Контрольные вопросы:
Назовите важнейшие железные руды.
Где применяются железные руды?
Сформулируйте вывод по работе.
Лабораторная работа № 8
Тема: «Ознакомление с коллекцией образцов нефти и продуктов ее переработки»
Цель:На основе коллекционного материала ознакомиться c образцами нефти, угля и продуктами их переработки
Оборудование:Коллекция «Нефть и продукты ее переработки», Учебное пособие Габриелян О.С. «Химия»
Теоретические основы
Нефть - “черное золото” – маслянистая жидкость от светло-бурого до черного цвета ,с характерным запахом, легче воды. Так как нефть – смесь различных углеводородов, то у нее нет определенной температуры кипения. Нефть растворима в органических растворителях, в воде при обычных условиях практически нерастворима, но может образовывать с ней стойкие эмульсии.
Ректификация (перегонка) – разделение жидких смесей на фракции или отдельные компоненты на основании различия в их температурах кипения.
Ректификацию осуществляют на специальных установках, называемых ректификационными колоннами.В процессе ректификации нефть разделяют на следующие фракции:
Ректификационные газы – смесь низкомолекулярных УВ, преимущественно пропана и бутана, с tкип до 40° С,
Газолиновую фракцию (бензин) – УВ состава С5Н12 до С11Н24 (tкип 40-200°С, при более тонком разделении этой фракции получают газойль (петролейный эфир, 40 - 70°С) и бензин (70 - 120°С),
Лигроиновую фракцию – УВ состава от С8Н18 до С14Н30( tкип 150 - 250°С),
Керосиновую фракцию – УВ состава от С12Н26 до С18Н38 (tкип 180 - 300°С),
Дизельное топливо – УВ состава от С13Н28 до С19Н36 (tкип 200 - 350°С)
Остаток переработки нефти – мазут – содержит УВ с числом атомов углерода от 18 до 50. Перегонкой при пониженном давлении из мазута получают соляровое масло (С18Н28 – С25Н52), смазочные масла (С28Н58 – С38Н78), вазелин и парафин – легкоплавкие смеси твердых УВ. Твердый остаток перегонки мазута – гудрон и продукты его переработки – битум и асфальт используют для изготовления дорожных покрытий.
Полученные в результате ректификации нефти продукты подвергают химической переработке. Один из них – крекинг – процесс переработки нефтепродуктов при повышенной температуре и давлении с целью получения УВ с меньшей молекулярной массой.
С16Н34 = С8Н18 + С8Н16
Термический крекинг – проводится при температуре 450-5500Си применяется для получения бензина, крекинг при температуре 750 0С – для получения алкенов.
Каталитический крекинг - расщепление молекул углеводородов и их изомеризация, протекает в присутствии катализаторов (алюмосиликатов) и при более низкой температуре (450-5000 С). Получают бензин более высокого качества.
Риформинг – переработка нефтепродуктов с целью получения ароматических углеводородов.
Последовательность выполнения работы:
Задание 1. Рассмотрите образцы коллекции.
Заполните таблицу:
| Название фракции
| Температура кипения
| Углеродный состав
| Физические свойства
| Область применения |
| Бензин |
|
|
|
|
| Лигроин |
|
|
|
|
| Керосин |
|
|
|
|
| Газойль /соляровое масло/ |
|
|
|
|
| Мазут |
|
|
|
|
| Гудрон |
|
|
|
|
Задание 2. Составить схему ректификационной колонны.
Задание 3. Пользуясь учебником дать следующие определения: нефть, ректификация (фракционная перегонка), крекинг, каталитический крекинг.
Контрольные вопросы:
1. Какие углеводороды входят в состав нефти?
2. Какие существуют методы переработки нефти?
3. Перечислите фракции перегонки нефти?
Сформулируйте вывод по работе.
Лабораторная работа № 9
Тема: «Качественная реакция на крахмал»
Цель:Овладение навыками проведения химических опытов, с соблюдением правил техники безопасности, подтверждающих Качественную реакцию на крахмал.
Оборудование:картофель, настойка йода.
Теоретические основы
Крахмал представляет собой природный полимер. Причем крахмал не индивидуальное вещество, а смесь двух полимеров состава (С6Н10О5)n –амилозы (10–20 %) и амилопектина (80–90 %), состоящих из остатков a-D-глюкозы.
В целом крахмал – это белое твердое вещество без запаха и вкуса, малорастворимое в холодной воде.
Являясь многоатомным спиртом, крахмал образует простые и сложные эфиры. Характерной качественной реакцией на крахмал является его реакция с йодом.
При взаимодействии йода с крахмалом образуется соединение включения (клатрат). Клатрат – это комплексное соединение, в котором частицы одного вещества («молекулы-гости») внедряются в кристаллическую структуру «молекул-хозяев». В роли «молекул-хозяев» выступают молекулы амилозы, а «гостями» являются молекулы йода. Попадая в спираль, молекулы йода испытывают сильное влияние со стороны своего окружения (ОН-групп), в результате чего увеличивается длина связи до 0,306 нм (в молекуле йода длина связи 0,267 нм). Данный процесс сопровождается изменением бурой окраски йода на сине-фиолетовую (lмакс 620–680 нм).
Амилопектин, в отличие от амилозы, дает с йодом красно-фиолетовое окрашивание (lмакс 520–555 нм). Хотя содержание амилопектина в зернах крахмала в несколько раз превышает количество амилозы, тем не менее синее окрашивание, возникающее при действии йода на амилозу, перекрывает красно-фиолетовую окраску амилопектина. Окраска исчезает при нагревании и восстанавливается при охлаждении крахмального клейстера.
Крахмал широко распространен в растениях и является для них резервным источником энергии. В основном он содержится в клубнях, семенах и корнях в виде зерен.
Крахмал используют как пищевой продукт, компонент лекарственных средств и для накрахмаливания белья. Его применяют для получения патоки, глюкозы и этилового спирта, а также в аналитической химии для обнаружения йода.
Одно из свойств крахмала – это способность давать синюю окраску при взаимодействии с йодом. Эту окраску легко наблюдать, если поместить каплю раствора йода на срез картофеля или ломтик белого хлеба. Крахмал в качестве резервного питания накапливается в клубнях, плодах, семенах растений. Так, в клубнях картофеля содержится до 24 % крахмала, в зёрнах пшеницы — до 64 %, риса — 75 %, кукурузы — 70 %.
Последовательность выполнения работы:
1.Провести качественную реакцию на крахмал
Нанесите несколько капель йода на срез клубня картофеля.Что наблюдаете?
Контрольные вопросы:
В каких сельскохозяйственных культурах находится наибольшее количество крахмала?
В каких частях растений накапливается крахмал?
Какие физические свойства крахмала?
Сформулируйте вывод по работе.
Лабораторная работа № 10
Тема: « Растворение глицерина в воде»
Цел:Овладение навыками проведения химических опытов, с соблюдением правил техники безопасности, подтверждающих свойства глицерина.
Оборудование: Глицерин, гидроксида натрия, сульфата меди (II), вода.
Теоретические основы
Глицерин- простейший представитель трехатомных предельных спиртов -глицеринов. Это бесцветная, вязкая, гигроскопичная жидкость, сладкая на вкус. Смешивается с водой в любых отношениях. Хорошо растворяет многие вещества.
По химическим свойствам глицерин (по заместительной номенклатуре пропантриол-1,2,3) очень близок к этиленгликолю. Так, с гидроксидом меди (II) глицерин образует ярко-синий глицерат меди:
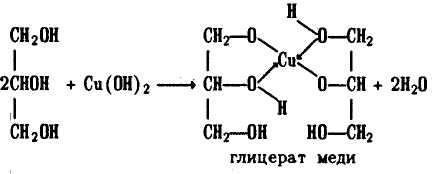
Это качественная реакция на многоатомные спирты- этиленгликоль, глицерин и их гомологи.
Большое значение имеет реакция взаимодействия глицерина с азотной кислотой с образованием нитроглицерина:

С карбоновыми кислотами глицерин образует сложные эфиры -жиры и масла.
Получают глицерин из жиров, а также синтетическим путем - из газов крекинга нефти (пропилена), т. е. из непищевого сырья. В последнем случае его промышленное производство можно представить схемой:
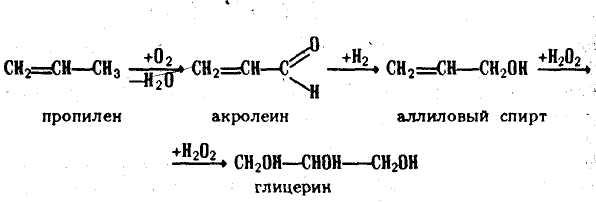
Последовательность выполнения работы:
1. Растворение глицерина в воде и взаимодействие с гидроксидом меди (II).
1.1. В пробирку прилейте 4мл воды и прилейте 2мл глицерина. Запишите наблюдения.
1.2. В пробирку прилейте 2мл раствора соли CuSO4 и 4мл раствора щелочи NaOH. К полученному осадку Cu(OH)2 прилейте раствор глицерина. Запишите наблюдения и химическую реакцию.
Контрольные вопросы:
Почему глицерин в отличие от одноатомных спиртов взаимодействует с основанием?
Как можно обнаружить в растворах глицерин?
Сформулируйте вывод по работе.
Лабораторная работа № 11
Тема: «Растворение белков в воде»
Цель: исследовать растворимость белка в воде
Оборудование: Яичный белок, дистиллированная вода, раствор хлористого калия, кератин (шерсти или волос).
Теоретические основы
Многие белки растворяются в воде, что обусловлено наличием на поверхности белковой молекулы свободных гидрофильных групп. Растворимость белка в воде зависит от структуры белка, реакции среды, присутствия электролитов. В кислой среде лучше растворяются белки, обладающие кислыми свойствами, а в щелочной - белки, обладающие основными свойствами.
Альбумины хорошо растворяются в дистиллированной воде, а глобулины растворимы в воде только в присутствии электролитов.
Не растворяются в воде белки опорных тканей (коллаген, кератин, эластин и др.)
Последовательность выполнения работы:
Растворение белков
К 2 каплям неразведенного яичного белка прибавляют 1 мл дистиллированной воды и перемешивают. При этом яичный альбумин растворяется, а яичный глобулин выпадает в виде небольшого осадка.
Проверить растворимость в воде и 5% растворе хлористого калия белка кератина, содержащегося в шерсти и волосах.
Результаты работы оформить в виде таблицы:
| Название белка | в Н2О | в 5% КСl |
| Шерсть |
|
|
| волосы |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Контрольные вопросы:
1. Какой состав имеет молекула белка?
2. Какова структура белковой молекулы?
3. Какие химические соединения в организме используются для синтеза белков?
Сформулируйте вывод по работе.
Лабораторная работа № 12
Тема: «Денатурация раствора белка куриного яйца при нагревании»
Цель: исследовать денатурацию раствора белка куриного яйца при нагревании
Оборудование: яичный белок; пробирки, держатель, спиртовка, дистиллированная вода.
Теоретические основы
Белки являются термолабильными соединениями и при нагревании свыше 50-60°С наступает денатурация. Сущность тепловой денатурации заключается в развертывании специфической структуры полипептидной цепи и разрушении гидратной оболочки белковых молекул, что проявляется заметным уменьшением их растворимости. Наиболее полное и быстрое осаждение происходит в изоэлектрической точке, т.е. при таком значении рН среды, когда суммарный заряд белковой молекулы равен нулю, поскольку при этом частицы белка наименее устойчивы. Белки, обладающие кислыми свойствами, осаждаются в слабокислой среде, а белки с основными свойствами – в слабощелочной. В сильнокислых или сильнощелочных растворах денатурированный при нагревании белок в осадок не выпадает, так как частицы его перезаряжаются и несут в первом случае положительный, а во втором отрицательный заряд, что повышает их устойчивость в растворе.
Последовательность выполнения работы:
1.Приготовить раствор белка
К 2 каплям неразведенного яичного белка прибавляют 1 мл дистиллированной воды и перемешивают. При этом яичный альбумин растворяется, а яичный глобулин выпадает в виде небольшого осадка.
2.Раствор белка нагреть на спиртовке. Что происходит?
Контрольные вопросы:
1. Какой состав имеет молекула белка?
2. Какова структура белковой молекулы?
3. Какие химические соединения в организме используются для синтеза белков?
Сформулируйте вывод по работе.
Правила техники безопасности
Запрещается пробовать на вкус химические вещества.
Щелочи, кислоты и другие ядовитые вещества необходимо набирать в пипетку только при помощи резиновой груши.
При взбалтывании растворов в колбах или пробирках необходимо закрывать их пробкой.
При нагревании жидкостей пробирку следует держать отверстием в сторону от себя и соседей по работе.
Во избежание ожогов от брызг и выбросов не наклоняться над сосудом, в котором кипит или налита какая-либо жидкость.
При переносе сосудов с горячими жидкостями держать их обеими руками: одной поддерживать дно, другой – верхнюю часть.
При работе с горячими и легковоспламеняющимися веществами (эфиры, спирты, бензин) нельзя нагревать их на открытом огне или сетке.
При определении запаха вещества не следует делать глубокого вздоха, а лишь движением руки направлять к себе воздух.
Концентрированную серную кислоту следует приливать в воду тонкой струей при непрерывном помешивании.
Химические стаканы, колбы из обычного стекла нельзя нагревать на голом огне без асбестовой сети. Категорически запрещается использовать посуду, имеющую трещины или отбитые края.
Использованную химическую посуду и приборы, содержащие кислоты, щелочи и другие едкие вещества, нужно освобождать от остатков и тщательно мыть. Прежде чем слить в раковину, их нужно нейтрализовать.
Нельзя оставлять без присмотра работающие установки, включенные электронагревательные приборы, спиртовки.
При обнаружении дефектов в приборах немедленно сообщите преподавателю, студентам запрещается устранять неисправности.
Если разбит ртутный термометр или электрод, содержащий ртуть (о случившемся сообщить преподавателю), рекомендуется капли ртути собрать амальгамированными пластинками из белой жести или меди. После удаления капель ртути необходимо залить место ее разлива 20%-ным раствором хлорида железа (III).
Во избежание отравлений категорически запрещается принимать пищу в химической лаборатории.
При мытье химической посуды запрещается работать с хромовой смесью без резиновых перчаток и защитных очков, а также прорезиненного фартука.
Оказание первой медицинской помощи
При термических ожогах осторожно обнажить обожженный участок и закрыть сухой асептической повязкой. Обожженный участок нельзя как-либо очищать и мочить водой, этиловым спиртом, перекисью или смазывать мазью.
При химических ожогах промыть обожженное место, не обращая внимания на боль, большим количеством проточной воды (10 – 15 мин), в случае кислых реагентов – раствором бикарбоната натрия (2%-ным), а в случае щелочных – разбавленным раствором борной или уксусной кислот.
При порезах стеклом:
а) промыть рану можно только в случае попадания в нее едких или ядовитых веществ, в остальных случаях, даже если в рану попал песок, ржавчина, промыть ее водой нельзя;
б) нельзя смазывать рану мазями; перед наложением повязки смазать настойкой йода участок вокруг раны;
в) удалять из раны мелкие осколки стекла может только врач.
При отравлении химическими веществами немедленно вызвать врача и одновременно приступить к оказанию первой помощи – если яд попал внутрь – вызвать рвоту, дать противоядие.
В лаборатории должен быть список веществ, вызывающие отравление и применяемые противоядия.
В лаборатории должна быть аптечка с набором медикаментов.
Список литературы
1. Ерохин Ю.М. Химия: учебник. - М., ОИЦ «Академия», 2009.
2. Габриелян О.С. Химия: учебное пособие для студентов профессиональных учебных заведений / О.С. Габриелян, И.Г. Остроумов. – М., ОИЦ «Академия»,2009
3. Габриелян О.С. Химия в тестах, задачах, упражнениях: учебное пособие для студентов средних профессиональных учебных заведений / О.С. Габриелян, Г.Г.Лысова – М., ОИЦ «Академия», 2009.
4. Габриелян О.С. Практикум по общей, неорганической и органической химии: учебное пособие для студентов средних профессиональных учебных заведений / О.С.Габриелян, И.Г.Остроумов. – М., ОИЦ «Академия», 2008.
5. Габриелян О.С., Остроумов И.Г. Химия: учебник. – М., ОИЦ «Академия», 2008.
32