КОМИТЕТ ОБРАЗОВАНИЯ И НАУКИ КУРСКОЙ ОБЛАСТИ
ОБЛАСТНОЕ БЮДЖЕТНОЕ Образовательное Учреждение
СРЕДНЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
«Рыльский аграрный техникум»
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО ВЫПОЛНЕНИЮ
ЛАБОРАТОРНЫХ РАБОТ И ПРАКТИЧЕСКИХ ЗАНЯТИЙ
ПО ДИСЦИПЛИНЕ «ЕСТЕСТВОЗНАНИЕ»
(общеобразовательная дисциплина)
г. Рыльск
2014г.
Одобрены
на заседании предметной (цикловой) комиссии естественно-научных и математических дисциплин
Составлены в соответствии с рабочей программой учебной дисциплины «Естествознание», утвержденной 15.06.2014 года
Для специальностей: «Операционная деятельность в логистике»
Об
Председатель:__________ И.В.Кузьменко
«____» ________ 2014 г.
Зам. директора по УР:
_Добрынина И.Н.___________
«____» ____________ 2014 г.
Преподаватель: ______И.В. Кузьменко
Содержание:
| Лабораторная работа №1 Исследование зависимости силы трения о веса тела |
|
| Лабораторная работа №2 Изучение зависимости периода колебаний нитяного маятника от длины нити |
|
| Лабораторная работа №3 Проверка закона Бойля-Мариотта |
|
| Лабораторная работа №4 Определение влажности воздуха Лабораторная работа № 5 Определение ЭДС и внутреннего сопротивления источника тока Лабораторная работа № 6 Изучение интерференции и дифракции света |
|
| Практическое занятие №7 Получение раствора заданной концентрации. |
| Практическое занятие №8 Очистка воды. Устранение жесткости. |
| Практическое занятие № 9 Получение газов ( О2; Н2; СО2). Практическая работа № 10 Химические свойства углеводов. Практическая работа № 11 Химические свойства белков. Практическая работа № 12 Определение витамина С и Д в продуктах. Практическая работа № 13 Рассматривание клеток в микроскоп Практическая работа №14 Антропогенное воздействие на окружающую среду. |
Пояснительная записка
Практические работы предусмотрены рабочей программой дисциплины «Естествознание» в количестве 28 часов.
Цель их проведения - закрепление и углубление теоретических знаний, полученных в результате обучения, приобретение необходимых навыков работы с литературой и иллюстрациями. В результате проведения практических работ студент должен знать/понимать:
смысл понятий:
- естественнонаучный метод познания;
- электромагнитное поле;
- электромагнитные волны;
- квант;
- эволюция Вселенной;
- Солнечная система и галактика;
- химическая связь;
- химическая реакция;
- биополимеры;
- клетка;
- дифференциация клеток;
- ДНК;
- биологическая эволюция;
- биоразнообразие,
- популяция, экосистема, биосфера.
уметь:
Приводить примеры экспериментов и (или) наблюдений, обосновывающих:
- атомно-молекулярное строение вещества;
- существование электромагнитного поля и взаимосвязь электрического и магнитного полей;
- волновые и корпускулярные свойства света;
- необратимость тепловых процессов;
- зависимость свойств вещества от структуры молекул;
- зависимость скорости химической реакции от температуры и катализаторов;
- клеточное строение живых организмов;
- роль ДНК как носителя наследственной информации;
- эволюцию живой природы;
- взаимосвязь компонентов экосистемы;
- влияние деятельности человека на экосистемы.
Практические занятия предполагают либо индивидуальную работу, либо подразделение на варианты.
Для того чтобы обеспечить высокий уровень интеллектуальной
деятельности, практические занятия носят репродуктивный и частично -поисковый характеры.
Перечень практических работ
| № п/п | Название практических работ | Кол-во часов |
| 1 | | Исследование зависимости силы трения о веса тела |
|
| 2 |
| 2 | Изучение зависимости периода колебаний нитяного маятника от длины нити | 2 |
| 3 | Проверка закона Бойля-Мариотта | 2 |
| 4 | Определение влажности воздуха | 2 |
| 5 | Определение ЭДС и внутреннего сопротивления источника тока | 2 |
| 6 | Изучение интерференции и дифракции света | 2 |
| 7 | Получение раствора заданной концентрации | 2 |
| 8 | Очистка воды. Устранение жёсткости. | 2 |
| 9 | Получение газов. ( О2; Н2; СО2) | 2 |
| 10 | Химические свойства углеводов. | 2 |
| 11 | Химические свойства белков. | 2 |
| 12 | Определение витамина С и Д в продуктах. | 2 |
| 13 | Рассматривание клеток в микроскоп. | 2 |
| 14 | Антропогенное воздействие на окружающую среду. | 2 |
Лабораторная работа №1
«Исследование зависимости силы трения от веса тела».
Цель работы: в ходе работы измерить коэффициент трения при движении деревянного бруска по деревянной поверхности.
Оборудование: динамометр лабораторный, трибометр, набор грузов.
Ход работы:
1. С помощью установки, при равномерном движении бруска измеряем силу трения
скольжения: |Fтрения|=|Fтяги|
2. Измеряем, вес бруска Р, равный силе реакции опоры N, нагружая брусок одним, двумя, тремя грузами, каждый раз измеряем силу трения и вес.
3. Результаты измерений занести в таблицу и
По данным таблицы строим график зависимости силы трения от силы давления. Определить коэффициент трения.
Вывод
Контрольные вопросы
Что такое сила трения? Перечислите виды сил трения.
Почему для того, чтобы скорее вылить жидкость из бутылки, надо придать ей быстрое вращательное движение?
Брусок массой 3кг равномерно тащат по горизонтальной площадке. Сила тяги 1,5Н. определите коэффициент трения.
Лабораторная работа № 2
Изучение зависимости периода колебаний нитяного маятника от длины нити
Цель работы: Исследование колебательного движения на примере математического маятника и определение ускорения свободного падения.
Оборудование: маятник, два шарика, линейка, транспортир, часы.
Ход работы
Отклонив шарик на какой-либо угол (е более 100), пустите его. Измерьте часами (в секундах) 100 простых колебаний и высчитайте период колебаний.
Отклонив на новый, меньший угол, сделайте новое определение периода. Сравните оба числа. Зависит ли период колебания от амплитуды?
Исследуйте, зависит ли период колебания от массы маятника. Для этого меняйте массу маятника (два шарика разной массы).
Определите длину маятника и период. Укоротите длину в 2 раза. Определите период.
По формуле определите ускорение силы тяжести. Результаты запишите в таблицу
| № п/п | π | L, м | Т,с | g,м/с2 | п | t, с |
| 1 |
|
|
|
|
|
|
| 2 |
|
|
|
|
|
|
| 3 |
|
|
|
|
|
|
l – длина нити
T – период маятника
g – ускорение свободного падения
n – число колебаний
t – время колебаний
Контрольные вопросы
Закон всемирного тяготения.
Сила тяготения тел к Земле и ускорение свободного падения.
Зависимость ускорения свободного падения от высоты над поверхностью Земли и широты местности.
Что называется математическим маятником?
Дифференциальное уравнение движения математического маятника и его решение.
Период и собственная частота колебаний математического маятника.
Что называется физическим маятником? Период, частота и приведенная длина физического маятника.
Как определить ускорение свободного падения с помощью математического маятника в данной работе?
ЛАБОРАТОРНАЯ РАБОТА №3
Проверка закона Бойля-Мариотта.
Цель работы: Экспериментальная проверка закона Бойля -Мариотта
Оборудование: стеклянный цилиндр высотой 50 см, стеклянная трубка длиной 50—60 см, закрытая с одного конца, стакан, пластилин, термометр, линейка, барометр-анероид (один на класс), штатив с лапкой, холодная и горячая вода.
Описание работы
В цилиндр с водой опускают открытым концом вниз трубку (см. рисунок). Если уровень воды в трубке находится ниже уровня воды в сосуде на h, то давление воздуха в трубке равно сумме атмосферного и гидростатического давления столба воды высотой h.
Для упрощения расчетов можно измерять давление в миллиметрах ртутного столба. Тогда, с учетом того, что плотность воды в 13,6 раз меньше плотности ртути, для воздуха в трубке можно записать  где Н — атмосферное давление в миллиметрах ртутного столба, h — разность уровней воды в цилиндре и трубке, измеренная в миллиметрах.
где Н — атмосферное давление в миллиметрах ртутного столба, h — разность уровней воды в цилиндре и трубке, измеренная в миллиметрах.
В трубке заключена постоянная масса воздуха, который можно считать находящимся при постоянной (комнатной) температуре. Объем и давление воздуха, заключенного в трубке, можно изменять, изменяя глубину погружения трубки. Объем воздуха в трубке V = l S , где l — длина столба воздуха; S — площадь сечения трубки. Поскольку площадь поперечного сечения трубки постоянна, длина столба воздуха в трубке пропорциональна объему воздуха. Поэтому для проверки закона Бойля — Мариотта достаточно проверить справедливость равенства: 
Ход работы
Соберите установку, изображенную на рисунке:

Измерьте барометром атмосферное давление в мм рт. ст.
Погружая в воду трубку открытым концом вниз, измерьте h и l (повторите опыт не менее трех раз).
Результаты измерений и вычислений занесите в таблицу.
| № опыта | H,
мм рт. ст. | h,
мм | l,
cм | 
|
| 1 | | | | |
| 2 | | | | |
Запишите вывод: что вы измеряли и какой получен результат..
Контрольные вопросы
Какие процессы называют изопроцессами? Назовите изопроцессы.
Дайте определение изотермического процесса.
В чем суть закона Бойля – Мариотта?
Лабораторная работа №5
«Измерение ЭДС и внутреннего сопротивления источника тока»
Цель работы: измерить сопротивление проводника с помощью амперметра и вольтметра.
Оборудование: источник тока, проволочный резистор, амперметр, вольтметр, реостат, ключ, соединительные провода.
Сопротивление проводника можно определить по закону Ома: I =U/R, R = U/I . Однако R — величина постоянная для данного проводника и не зависит ни от напряжения, ни от силы тока.
Ход работы

1. Соберите электрическую цепь по схеме (рис. 1).
2. Замкните цепь, измерьте силу тока в цепи и напряжение на исследуемом проводнике. Результаты измерений занесите в таблицу.
3. С помощью реостата измените сопротивление цепи и снова измерьте силу тока в цепи и напряжение на исследуемом проводнике. Результаты измерений и вычислений занесите в таблицу.
4. На основании полученных экспериментальных результатов сделайте вывод о зависимости (независимости) сопротивления проводника от силы тока в нем и напряжения на его концах.
5. Какое количество теплоты необходимо, чтобы расплавить ледяную глыбу массой 12,5т при температуре плавления? Удельная теплота плавления льда 332 кДж/кг.
Вывод.
ЛАБОРАТОРНАЯ РАБОТА №6
Наблюдение интерференции и дифракции света
Цель работы: ознакомиться с явлением интерференции в тонких плёнках.
Приборы и материалы: раствор мыльный, кольцо проволочное, лезвие бритвы, держатель, две стеклянные пластинки, спички, стеклянная трубка.
Порядок выполнения работы.
1.Закрепите лезвие бритвы в держателе, и медленно нагревайте его над пламенем спички. Наблюдайте за последовательностью возникновения цветных полос.
Напишите ответы на вопросы:
Какие цвета, и в каком порядке появлялись на поверхности лезвия бритвы при его нагревании?
Как можно объяснить наблюдаемое явление?
2.Получите на проволочном кольце мыльную плёнку, расположите её вертикально и рассмотрите в отражённом свете источника света (можно около окна).
Напишите ответы на вопросы:
Какого цвета полосы появляются на плёнке?
Где сначала появляются полосы – вверху или внизу? Почему?
Почему полосы располагаются горизонтально?
В каком порядке расположены цвета в полосах?
3.Выдувайте мыльный пузырь на поверхности мыльного раствора с помощью стеклянной трубки. Наблюдайте за радужной окраской, возникающей на стенках мыльного пузыря.
Запишите ответы на вопросы:
Почему на верхней части мыльного пузыря возникают цветные полосы?
Почему эти полосы имеют форму окружности?
Почему полосы не остаются на месте, а перемещаются вниз?
Полоса какого цвета идёт последней? Почему? Почему в конце пузырь бесцветен?
Решите задачи и ответьте на вопросы:
1.Почему не возникает интерференционной картины от двух фар удалённой автомашины?
2.Видимый свет с самой короткой длинной волны падает на две щели, расстояние между которыми 2,810 –2 мм. Щели и экран, отстоящий от них на расстояние 18 см, погружены в воду. Определить расстояние между интерференционными полосами на экране.
3.Одна из двух щелей, освещаемых светом с длинной волны 510нм, закрыта очень тонким листом пластика (n.=1,6). В центре экрана вместо максимума света – тёмная полоса. Чему равна минимальная толщина пластинки?
4.Каково отличие интерференционных полос в отражённом и проходящем свете?
5.Чем объясняется расцветка крыльев стрекоз, жуков и прочих насекомых?
6.Некоторые просветлённые линзы в отражённом свете отливают зелёным. Отражение каких длин волн должно полностью гаситься таким покрытием?
Практическое занятие № 7
Тема: Приготовление раствора заданной концентрации.
Цель: Научиться готовить раствор необходимой концентрации.
Время: 2 часа
Оборудование: Штатив с пробирками, весы, мерный цилиндр, колба, вода, соль- хлорид натрия.
Краткие теоретические сведения. Раствор – однородная система, состоящая из двух или более компонентов (растворителя, растворённых веществ и продуктов их взаимодействия), относительные количества которых могут изменяться в широких пределах. Растворы бывают концентрированными (с высоким содержанием растворённого вещества) и разбавленными (с низким с содержанием растворённого вещества)- это качественная оценка концентрации растворов. Но в расчётах применяют количественный способ выражения концентрации растворов, который выражают в массовых долях. Массовой долей растворённого вещества называют отношение массы растворённого вещества к общей массе раствора.
Инструктаж по технике безопасности.
Ход работы:
Опыт №1. Приготовления раствора, содержащего определённую массовую долю растворённой соли.
Получите от преподавателя задания с указанием массы и концентрации раствора, который необходимо приготовить.
Вычислите массу навески соли (г) и объём воды (мл.), необходимые для приготовления данного раствора.
Отвесьте на весах необходимую навеску соли и отмерьте мерным цилиндром необходимый объём воды.
Поместите навеску соли в колбу, прилейте отмеренный объём воды, содержимое колбы перемешайте до полного растворения соли.
Оформите отчёт о работе в произвольной форме.
Практическое занятие № 9
Тема: Получение и собирание газов: водорода, углекислого газа, кислорода.
Цель: Формирование навыка сравнительного анализа на примере получения, способов собирания, свойств и применения газов.
Оборудование: Для получения водорода вытеснением воздуха - автоматический прибор для получения газов, металлический штатив с лапкой, спиртовка, штатив с пробирками, 2-3 гранулы цинка, раствор соляной кислоты (1:3), оксид меди.
Для получения оксида углерода (IV) - прибор для получения газов, стакан объёмом 50 мл, спиртовка, лучинка, штатив с пробирками, кусочки мрамора, раствор соляной кислоты (1:1), известковая вода.
Для получения кислорода вытеснением воздуха - металлический штатив, спиртовка, штатив с пробирками, пробка с газоотводной трубкой, уголёк, лучинка, комок ваты, перманганат калия.
Краткие теоретические сведения. Водород в свободном состоянии существует в виде двухатомных молекул Н2. Молекулярный водород представляет собой газ без цвета и запаха. Он намного легче воздуха. Водород взаимодействует с простыми веществами – неметаллами, металлами. Является хорошим восстановителем многих оксидов и других соединений. Оксид углерода (IV) – бесцветный газ. В больших количествах углекислый газ вреден для человека и животных, может вызвать удушье. Этот газ не поддерживает горения: зажженная лучина гаснет. Это явление используют для обнаружения СО2. Кислород – самый распространенный элемент на Земле. Массовая доля кислорода в земной коре равна 47,2%, он входит в состав многих природных соединений – воды, оксидов, гидроксидов, солей. Одно из важнейших свойств кислорода это способность поддерживать горение веществ. Кислород поддерживает дыхание живых организмов.
Инструктаж по технике безопасности
Ход работы:
Опыт №1. Получение водорода. Зарядите прибор для получения газов цинком и раствором соляной кислоты в следующем порядке. Ослабьте путём небольшого вращения пробку воронки и осторожно приподнимите её, не вынимая из прибора (рис. 1). Опустите на пластмассовую решётку 2-3 гранулы цинка и плотно присоедините воронку к пробирке прибора. Вставьте прибор в штатив. Откройте зажим на газоотводной трубке и налейте в воронку столько раствора кислоты, чтобы он покрыл гранулы цинка. Для прекращения начавшейся реакции перекройте газоотводную трубку зажимом. При этом кислота вытиснится в воронку (рис. 2). Почему?
Теперь прибор готов для получения водорода. Что нужно сделать, чтобы прибор начал действовать? Накройте газоотводную трубку пробиркой (вверх дном) и выждите несколько секунд, пока из пробирки вытиснится воздух. Проверьте водород «на чистоту». Для этого плавно приподнимите пробирку с водородом и, держа её вверх дном, закройте пальцем. Пробирку поднесите в горизонтальном положении к пламени и откройте её. Сгорание чистого водорода сопровождается слабым хлопком. Только убедившись в чистоте водорода, можно его поджечь. Погасите пламя горящего водорода и проведите следующий опыт.Рис.2 Восстановление оксида меди (И) водородом.
Насыпьте стеклянной лопаточкой на дно сухой пробирки немного порошка оксида меди (II) (по объёму со спичечную головку) и укрепите её в лапке штатива, в горизонтальном положении. Газоотводную трубку погрузите в пробирку так, чтобы её конец находился над оксидом меди (II). Теперь нагревайте оксид меди (II). Что вы наблюдаете на стенках пробирки? Что происходит с чёрным порошком? Когда окраска оксида полностью изменится, прекратите нагревание, выньте трубку из пробирки, дайте пробирке остыть.
Вопросы:
Почему пробирку держат дном вверх при получении Н2?
От чего зависят разные способы получения газов?
Объясните, от чего зависят разные способы собирания газов.
Опыт №2. Получение углекислого газа. Зарядите прибор для получения газов кусочками мрамора и раствором соляной кислоты в следующем порядке. Ослабьте путём небольшого» вращения пробку воронки и осторожно приподнимите её, не вынимая из прибора (рис. 1). Опустите на пластмассовую решётку 2-3 кусочка мрамора и плотно присоедините воронку к пробирке прибора. Вставьте прибор в штатив. Откройте зажим на газоотводной трубке и налейте в воронку столько раствора кислоты, чтобы он покрыл кусочки мрамора.
Когда начнётся реакция, перекройте зажимом газоотводную трубку. Прибор готов к работе. Соберите оксид углерода (IV) и докажите его наличие в сосуде (рис. 1,2)
Пропустите оксид углерода (IV) в пробирку с 1-2мл известковой воды. Что наблюдаете? Теперь продолжайте пропускать газ в эту пробирку до образования прозрачного раствора. Как объяснить растворение осадка?
Вопросы:
Почему стакан для получения СО2 не переворачивают вверх дном?
Объясните, почему углекислый газ нельзя получать вытеснением воздуха?
Как различаются свойства газов?
Опыт №3. Получение кислорода. Выданный вам перманганат калия поместите в сухую пробирку. У её отверстия положите комок ваты, который будет задерживать пылевидные твёрдые вещества. Закройте пробирку пробкой с газоотводной трубкой и укрепите собранный прибор в лапке штатива, как показано на рисунке. Газоотводную трубку опустите в пробирку так, чтобы конец её доходил до дна пробирки.
Прогрейте сначала всю пробирку с перманганатом калия, а затем нагревайте только то место, где находится вещество. Через полминуты начинайте проверять тлеющей лучинкой заполнение пробирки-приёмника кислородом. Для этого лучинку поднесите к отверстию пробирки. Когда в ней соберётся кислород, опустите в пробирку раскалённый уголёк. Наблюдайте яркое свечение угля - горение без пламени. После извлечения несгоревшего угля из пробирки прилейте в неё при взбалтывании 5-6 капель известковой воды. Что наблюдаете? Почему кислород можно собрать вытеснением воздуха?
Вопросы:
Почему стакан для получения О2 не переворачивают вверх дном?
Отчего зависят разные способы получения газов?
Как образуется кислород в природе?
Результаты оформите в таблице.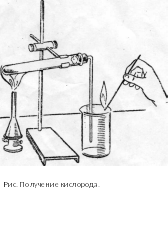
Результаты оформите в таблице
| № п/п | Название и описание опыта | Наблюдения | Уравнение реакций | Вывод |
|
|
|
|
|
|
Контрольные вопросы:
После проведения опытов и рассмотрения свойств газов ответьте на вопрос, – какой газ вы будете использовать при заполнении в огнетушителе, в воздушном шаре и для резки и сварке металлов.
Практическое занятие № 10
Тема: Изучение свойств углеводов. Цель: Закрепить знания о группе биологически важных веществ: глюкозе, крахмале. Наличие у этих веществ различных функциональных групп, изученных ранее. Продолжить формирование практических умений и навыков.
Оборудование: штатив с пробирками, спиртовка, спички, пробиркодержатель, растворы сульфата меди, гидроида натрия, глюкозы, крахмал, спиртовой раствор йода, чёрный хлеб, крахмальный клейстер, пипетка.
Краткие теоретические сведения. К углеводам относят вещества, состав которых, за небольшим исключением, выражается общей формулой C n(H2O)m.
В молекулах этих веществ отношение числа атомов водорода и кислорода то же, что и в воде; по своему составу углеводы представляют собой как бы сочетание угля (С) и воды (H2O); этим и обусловлено их название.
Важнейшими углеводами являются глюкоза С6Н12О6 , или
СН2(ОН)- СН(ОН)- СН(ОН)- СН(ОН)- СН(ОН)- СОН ,
сахароза С12Н22О11, крахмал (С6Н10О5)n ,
клетчатка или целлюлоза (С6Н10О5)m или [C6H7O2(OH)3]m.
Указанные вещества обладают смешанными свойствами.
Например, глюкоза проявляет свойства альдегидов и многоатомных спиртов ( альдегидоспирт). Как альдегид глюкоза окисляется в глюконовую кислоту с помощью аммиачного раствора оксида серебра, реакция «серебряного зеркала» или щелочного раствора гидроксида меди(II).
Как многоатомный спирт глюкоза взаимодействует с гидроксидом меди(II) с образованием глюконата меди. как углевод глюкоза вступает в реакции брожения: спиртовое и молочнокислое.
Изомер глюкозы – фруктоза пpоявляет свойства многоатомных спиртов и кетонов, т.к. является кетоноспиром.
Углеводы также называют сахарами. Среди углеводов имеются простые сахара, сложные сахара.
К простым сахарам относятся глюкоза, фруктоза и другие вещества.
К сложным относятся сахароза (свекловичный или тростниковый сахар) или дисахарид.
К полисахаридам относятся крахмал и целлюлоза (клетчатка).
Качественная реакция на крахмал – взаимодействие со спиртовым раствором йода. Образуется темно-синее окрашивание.
Инструктаж по технике безопасности
Ход работы:
Опыт №1. Свойства глюкозы.
В пробирку налейте 1мл раствора глюкозы, 1мл раствора сульфата меди и 2мл гидроксида натрия (щёлочь должна быть в избытке). Что доказывает образование ярко-синего раствора? Полученный раствор нагрейте. Что наблюдаете? Наличие, каких функциональных групп в молекуле глюкозы подтверждает этот опыт?
Опыт № 2. Отношение крахмала к воде.
В пробирку с 1мл воды поместите немного крахмала. Содержимое пробирки взболтайте. Растворяется ли крахмал в воде при комнатных условиях? Содержимое пробирки порциями влейте при помешивании в стакан с горячей водой. Что вы наблюдаете?
Опыт № 3. Взаимодействие крахмала с йодом.
В пробирку внесите 2мл крахмального клейстера и добавьте 1 каплю спиртового раствора йода. Что наблюдаете?
Результаты занесите в таблицу.
| № п/п | Название и описание опыта | Наблюдения | Уравнения реакций(рисунок) | Вывод |
|
|
|
|
|
|
Контрольные вопросы:
1. В чем сходство и различие в строении крахмала и целлюлозы? 2. Составьте уравнение реакции: Крахмал → Глюкоза → Этанол → Оксид углерода (IV) → Крахмал
Практическое занятие № 11
Тема: Необратимое осаждение белков
Цель: Подробное изучение свойств белков. Исследование процессов необратимой денатурации белков. Определять наличие белковых соединений качественными реакциями.
Оборудование: Штатив с шестью пробирками, концентрированные кислоты – соляная, азотная, 10% - раствор сульфата меди (II), гидроксид натрия, 5% - раствор ацетата свинца, кристаллический хлорид натрия, раствор белка, этиловый спирт.
Краткие теоретические сведения. Белки (протеины) – высокомолекулярные органические вещества, построенные из аминокислот и других соединений, играют фундаментальную роль в структуре и жизнедеятельности живых организмов. Белки обладают различными свойствами. При повышении температуры белки свертываются и становятся нерастворимыми. Белки являются амфотерными соединениями. С гидроксидом меди (II) белки образуют характерное фиолетовое окрашивание. Эта реакция называется биуретовой. С азотной кислотой при нагревании белок образует осадок ярко-желтого цвета. Реакция называется ксантопротеиновой. Эти две цветные реакции являются качественными реакциями на белок.
Инструктаж по технике безопасности
Ход работы:
В пробирки налейте раствор куриного белка, добавьте реагенты, что наблюдаете? Напишите, в каких пробирках прошли качественные реакции на белковые молекулы и назовите эти реакции. Результаты оформите в таблице.
| Номер пробирки | Реагент | Наблюдения |
| 1 | HCl концентр. |
|
| 2 | HNO3 концентр. |
|
| 3 | NaCl |
|
| 4 | C2H5OH |
|
| 5 | CuSO4 |
|
| 6 | Pb(CH3COO)2 |
|
| 7 | Cu(OH)2 |
|
Контрольные вопросы:
1. Как называется процесс необратимого свертывания белков?
2. Какими способами можно вызвать необратимое свертывание белков?
3. Какими свойствами обладают амины?
4. Дайте характеристику строению белков.
Практическое занятие № 12
Тема: Определение витамина С и Д в продуктах питания
Цель: формирование умений и навыков проводить исследовательскую работу по определению витаминов С и Д в продуктах питания, работать с лабораторным оборудованием.
Оборудование: штатив с пробирками, яблочный сок, вода, крахмальный клейстер, 5% раствор йода, рыбий жир или куриный желток, раствор брома.
Краткие теоретические сведения. Аскорбиновая кислота (витамин С) содержится в свежих овощах – капусте, свекле, салате, картофеле; во фруктах – лимонах, апельсинах; в ягодах – землянике, черной смородине; в молоке, яйцах. Аскорбиновая кислота регулирует окислительно-восстановительные процессы в организме. Ускоряет свертывание крови и повышает сопротивляемость организма инфекциям. Количественное определение аскорбиновой кислоты основано на окислении ее йодом. Как только йод окислит всю аскорбиновую кислоту, следующая капля, прореагировав с крахмалом, окислит раствор в синий цвет. Витамин D (кальциферол). Суточная потребность 2,5- 10 мкг. Регулирует содержание кальция и фосфора в крови, минерализация костей, зубов. Отсутствие приводит к развитию рахита у детей и размягчению костей (остеопороз) у взрослых. Кальциферол содержится в рыбьем жире-125 мкг, печени трески- 100 мкг говяжьей печени 2, 5 мкг. Витамин D почти не разрушается при кулинарной обработке. Витамин Д можно обнаружить раствором брома. По изменившейся окраске, при наличии витамина Д появляется зеленовато-голубое окрашивание.
Инструктаж по технике безопасности
Ход работы:
Опыт №1. Определение витамина С. Налейте в пробирку 2 мл сока и добавьте воды на 10 мл. затем влейте немного крахмального клейстера (1 г крахмала на стакан кипятка). Далее по каплям добавляйте 5% раствор йода до появления устойчивого синего окрашивания, не исчезающего 10-15 с. Напишите наблюдения.
Опыт №2. Определение витамина Д в рыбьем жире или курином желтке. В пробирку с 1 мл рыбьего жира прилейте 1 мл раствора брома. Пронаблюдайте, как изменится цвет.
Результаты запишите в таблицу
| № опыта | Название и описание опыта | Наблюдения | Выводы |
|
|
|
|
|
Контрольные вопросы
1.Что такое гиповитаминозы, авитаминозы, гипервитаминозы? 2. Как классифицируют витамины?
3. Как взаимосвязаны кулинарная обработка плодов и овощей и сохранность витаминов?
Практическое занятие № 13
Тема: Изучение органоидов эукариотической клетки.
Цель: Закрепить умение готовить микропрепараты и рассматривать их под микроскопом, находить особенности строения клеток различных организмов, сравнивать их между собой.
Время: 2 часа
Оборудование: микроскопы, предметные и покровные стекла, стеклянные палочки, лук репчатый, разведенные дрожжи, культура сенной палочки, микропрепараты клеток многоклеточных животных.
Краткие теоретические сведения. Клетка - элементарная единица живой системы. Клетка обладает всеми свойствами живой системы: она осуществляет обмен веществ и энергии, растет размножается и передаёт по наследству все свои признаки, реагирует на внешние раздражители и способна двигаться. Она обладает низшей ступенью организации, обладающей всеми этими свойствами.
Все организмы, имеющие клеточное строение делятся на две группы: безъядерные (прокариоты) и ядерные (эукариоты).Клетки прокариот имеют относительно простое строение. Но во всех клетках специфические функции выполняют ОРГАНОИДЫ, имеющие определённую форму и отвечающие за разные функции. Строение большинства клеточных органоидов во всех клетках очень сходно.
Инструктаж по технике безопасности.
Ход работы:
Приготовьте микропрепараты кожицы лука, дрожжевых грибов, бактерии сенной палочки. Под микроскопом рассмотрите их, а также готовый микропрепарат клеток многоклеточного микроорганизма.
Зарисуйте клетки в тетрадях и обозначьте видимые в световой микроскоп органоиды.
Сравните между собой эти клетки. Ответьте на вопросы: В чём заключается сходство и различие клеток? Каковы причины сходства и различия клеток разных организмов? Объясните как шла эволюция бактерий, грибов, животных и растений.
Практическое занятие № 14
Тема: Антропогенное воздействие на окружающую среду.
Цель: Сформировать у студентов понимание, что все мы загрязняем окружающую среду, как непосредственно, так и косвенно. И все мы можем что-то сделать для уменьшения этого загрязнения.
Время: 2 часа
Оборудование:
Краткие теоретические сведения. Качество воды в водоёме в определённой степени зависит от того, что происходит на площади водосбора; эрозия почв может вызвать помутнение воды; сбросы промышленных предприятий, коммунальных хозяйств вызывают загрязнения; свалки и мусор на берегу водоёма не только портят ландшафт, но могут быть источником вредных веществ, вымываемых из отходов и попадающих в водоёмы.
Инструктаж по технике безопасности.
Ход работы:
Студенты делятся на группы, и каждая группа готовит сообщение: что им известно о местной реке; откуда водоём собирает воду; протекает ли река через города; как используются земли, окружающие водоём; какие источники загрязнения могут влиять на качество воды.
Полевой выход к водоёму. Побережье реки делится между группами. Размер участка от 100 до 200 м.
Каждая группа описывает свой участок, принимая во внимание все возможные источники загрязнения, идущего из населённого пункта, бытовые и промышленные отходы на берегу. Каждая группа оценивает роль источников загрязнения и свалок ( велики или малы, постоянны или временны, длительно действующие или вновь появившиеся и т.д.).
Планы участков выполняют в установленном масштабе, чтобы затем можно было составить единый план. На планы наносят полученные задания.
Работа в кабинете. Происходит обсуждение результатов: источники загрязнения, их местонахождение, влияние на реку как по их течению так и против него.
Каждая группа выступает с предложениями: что можно сделать, чтобы уменьшить загрязнение водоёма, что могут сделать местные власти и что могут сделать сами студенты для того, чтобы уменьшить будущие загрязнения и исправить существующие положение дел. Каждая группа должна проектировать меры спасения прежде всего для своего участка.




















