
Сучасна модель атома. Ядерні сили. Ізотопи.
Урок з фізики у 9 класі
вчитель фізики І категорії
Сербівської ЗШ І – ІІІ ст.
Попик Г.Л.

Мета уроку:
сформувати знання про сучасні погляди на модель атома та атомного ядра, ізотопи, сильну взаємодію нуклонів
Очікуванні
результати:
учні повинні пояснювати дослід Резерфорда, характеризувати ядерну модель атома та протонно – нейтронну модель атомного ядра, давати означення нуклона, знати, що таке сильна взаємодія, називати основні властивості ядерних сил.

Актуалізація опорних знань:
Гра “ Так – ні”
Так
1. Існують два види зарядів – « позитивні» й « негативні».
2. На скляній паличці, потертій об шовк, заряд «негативний».
3. Два однойменні заряди відштовхуються.
4. Навколо нерухомого заряду існує магнітне поле.
5. Чим ближче до заряду, тим сильніше електричне поле.
6. Найменший заряд має частинка йон.
7. За звичайних умов атом електрично нейтральний.
8. До складу ядра входять електрони.
Ні
Так
Ні
Так
Ні
Так
Ні


Етапи у розвитку поглядів на будову атома
І етап
Атомістика давніх греків: Левкіпп та Демокріт
ІІ етап:
Теорія М. Ломоносова і Дж. Дальтона
ІІІ етап
Модель атома за Дж. Томсоном

І етап
атомістика давніх греків: Левкіпп та Демокріт
Левкіпп вважав, що найдрібніші, неподільні частинки
атоми - вічні. Усі зміни, що відбуваються в природі, спричиняються з'єднанням і роз'єднанням атомів

Демокріт вважав, що світ складається з незмінних та неподільних атомів, які рухаються в порожньому просторі; їх існує безліч. І вони можуть набувати силу – силенну різних форм; якісно всі атоми однакові; відмінність усіх тіл залежить від кількості атомів, їхньої величини, форми та порядку; атоми – це найпростіші частинки, які не мають ніякої внутрішньої будови.

ІІ етап:
Теорія М. Ломоносова і Дж. Дальтона
Уперше вдалося пов'язати теоретичні уявлення про
атоми з дослідними даними про будову й властивості різних речовин славетному російському вченому М.В. Ломоносову ( 1711 – 1765).
М. Ломоносов указав на те, що має існувати певна найменша кількість кожної речовини, яка зберігає її властивості, - корпускула. Усі речовини складаються з молекул, усі молекули цієї речовини зовсім однакові, а молекули різних речовин різні. Частинки речовини перебувають у безперервному русі.

Відомий французький учений Ж. Лавуазьє ( 1743 – 1794) дослідним шляхом підтвердив справедливість відкритого М. Ломоносовим закону збереження мас. Він встановив точний склад води, розвинув уявлення про найпростіші речовини – хімічні елементи.
Згодом англієць Джон Дальтон з'ясував, чим відрізняється будова простих речовин від будови складних. За Дж. Дальтоном, молекула складної речовини являє собою стійке сполучення кількох атомів.

ІІІ етап
Модель атома за Дж. Томсоном
Професорові Кавендиської лабораторії ДЖ. Томсону ( 1856 – 1940) у 1897 р. вдалося встановити, що з атомів можуть вилітати малесенькі негативно заряджені частинки – електрони.
Згідно з його першою моделлю, атом складається з
позитивного заряду, який рівномірно заповнює сферу, розміри якої мають той самий порядок, що й атом. Усередині сфери містяться від'ємні заряди – електрони, розміри яких набагато менші за розміри сфери. Кількість корпускул в атомі велика. Електрони всередині атома можуть рухатися, наприклад обертатися навколо його центра, або перебувати в спокої.
В історії фізики модель атома Томсона залишилася під назвою «пиріг із родзинками»

ІV етап
Планетарна модель атома за Резерфордом
Модель атома Томсона проіснувала в науці недовго
– лише 15 років, бо виявилася неправильною.
У 1911 році завдяки наполегливій праці англійському вченому – експериментатору Ернесту Резерфорду, учневі Дж. Томсона, разом зі своїми учнями Ернстом Марсденном і Гансом Гейгером вдалося з'ясувати істинну будову атома.
Ця модель будови атома назвали ядерною, або планетарною

Планетарна модель атома
Атом складається з центрального ядра, у якому
зосереджено майже всю масу атома й весь позитивний заряд; навколо ядра по колових орбітах, подібно до планет навколо Сонця, рухаються окремі електрони.
Число електронів у кожному атомі таке, що їхній сумарний заряд дорівнює позитивному заряду ядра, тому загалом атом нейтральний.
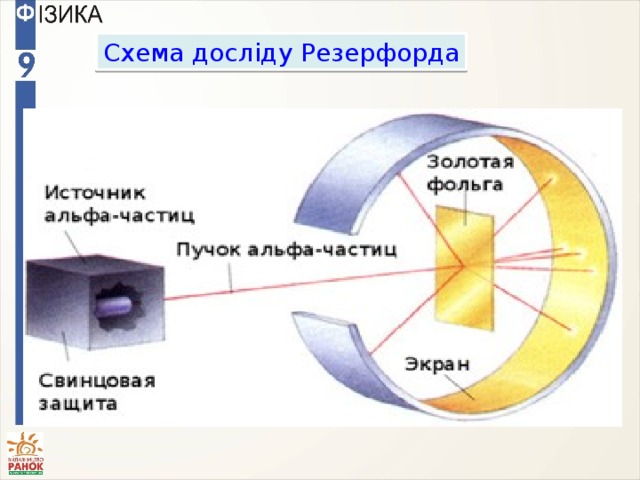
Схема досліду Резерфорда

Результати досліду Резерфорда:
- Більшість а-частинок не відхиляється від початкового напрямку руху.
- Невелика кількість а-частинок відхиляється від початкового напрямку руху на невеликі кути.
- Декілька а-частинок практично повертає назад.
Пояснення результатів досліду:
- В атомі багато порожнеч.
- Відхилення а-частинок обумовлено кулонівською взаємодією з атомним ядром.
- В ядрі атома сконцентровано позитивний заряд та значна маса, тому при ударі о ядро а-частинка практично відкидається назад.

А́том (від грец. άτομοσ — неподільний) — найменша частинка хімічного елемента, яка зберігає всі його хімічні властивості. Атом складається з щільного ядра з позитивно заряджених протонів та електрично нейтральних нейтронів, яке оточене набагато більшою хмарою негативно заряджених електронів.
Кількість електронів, що рухаються навколо ядра, дорівнює кількості протонів в ядрі. Ця кількість називається порядковим номером елемента в періодичної системі Менделєєва.
Загальне число нуклонів (тобто протонів і нейтронів) у ядрі позначається через А і називається масовим числом.
A – масове число атома
Z – заряд ядра (число протонів)
N – число нейтронів
z X A
А = Z + N

Протонно – нейтронна модель атома
Нейтрон було відкрито англійським фізиком Джеймсом Чедвіком у 1932 р. Маса нейтрона приблизно дорівнює масі протона, а електричного заряду нейтрон не має (тобто є електрично нейтральним), що зумовлює його назву. Майже одразу після цього відкриття українські фізики
Д.Д. Іваненко і Є.М. Гапон висловили гіпотезу щодо протонно- нейтронної будови ядра.
нейтрони
протони

Склад атома речовини

У деяких випадках атом може зазнати суттєвих зовнішніх впливів. За таких умов нейтральний атом втрачає один або кілька електронів.
Якщо атом втратить один або кілька електронів, то позитивний заряд ядра ( кількість протонів) переважатиме над негативним зарям атома
( кількістю електронів). Такий атом називають позитивним йоном.
Якщо атом приєднає один або кілька зайвих електронів, то його називають негативним йоном .
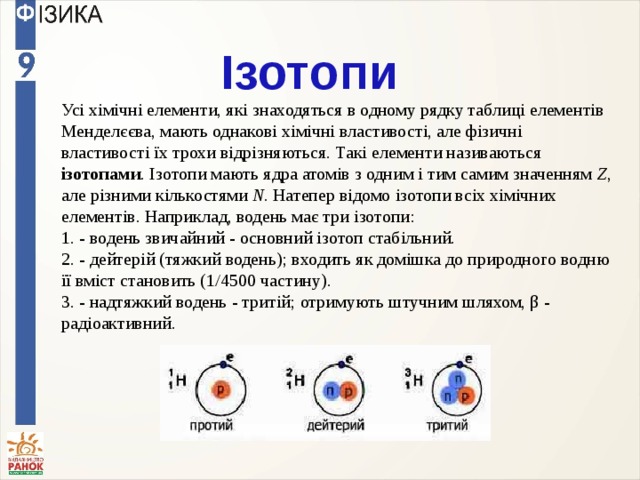
Ізотопи
Усі хімічні елементи, які знаходяться в одному рядку таблиці елементів Менделєєва, мають однакові хімічні властивості, але фізичні властивості їх трохи відрізняються. Такі елементи називаються ізотопами . Ізотопи мають ядра атомів з одним і тим самим значенням Z , але різними кількостями N . Натепер відомо ізотопи всіх хімічних елементів. Наприклад, водень має три ізотопи:
1. - водень звичайний - основний ізотоп стабільний.
2. - дейтерій (тяжкий водень); входить як домішка до природного водню її вміст становить (1/4500 частину).
3. - надтяжкий водень - тритій; отримують штучним шляхом, β - радіоактивний.

Для того, щоб атомні ядра були стійкими, протони та нейтрони повинні утримуватися всередині ядер сильними силами, які в багато разів перевищують сили кулонівського відштовхування протонів. Сили, які утримують нуклони в ядрі, називаються ядерними
Особливості ядерних сил:
- Ядерні сили приблизно в 100 разів перевищують електростатичні сили и на десятки порядків перевищують сили гравітаційної взаємодії нуклонів.
2. Важливою особливістю ядерних сил являється їх короткодіючий характер. Ядерні сили проявляються, як показали досліди Резерфорда по розсіюванню a-частинок, лиш на відстанях порядку розмірів ядра (10 –14 –10 –15 м). Ядерні сили дуже швидко зменшуються з відстанню. Радіус їх дії порядку 0,000 000 000 000 001 метра .

Ядерні сили
На основі дослідних даних можна зробити висновок, що протони та нейтрони в ядрі ведуть себе однаково по відношенню до сильної взаємодії, тобто ядерні сили не залежать від існування чи відсутність у частинок електричного заряду.
ЯДЕРНІ СИЛИ:
- сили притягування;
- діють між всіма нуклонами в ядрі;
- короткодіючі.

Розв'язування задач
1. У ядрі атома срібла 107 частинок. Навколо ядра обертаються 47 електронів. Скільки в ядрі цього атома нейтронів і протонів?
2. У ядрі атома цинку 65 частинок, з них 30 протонів. Скільки нейтронів в ядрі і скільки електронів обертаються навколо ядра цього атома?
3. У ядрі атому урану мітиться 238 частинок. Навколо ядра рухається 92 електрони. Скільки в ядрі цього атома нейтронів і протонів?
4. У ядрі атома золота 197 частинок, з них 79 протонів. Скільки нейтронів в ядрі і скільки електронів обертаються навколо ядра цього атома?
5. У ядрі атома азоту 14 частинок, з них 7 нейтронів. Скільки протонів і електронів міститься в цьому атомі?
6. Навколо ядра атома кисню рухаються 8 електронів. Скільки протонів має ядро атома
кисню?

Домашнє завдання
§31, впр.28
стр.178 - 179 підручника







































