
Модель атома бора. Постулаты бора
Выполнила:
Звездина Дарья
Ученица 11 класса
МБОУ «Арх-ГОЛИЦИНСКАЯ СОШ»

Бор Нильс Хенрик Давид (7.10.1885—18.11.1962)
- Датский физик, один из создателей современной физики. Основатель (1920) и руководитель Института теоретической физики в Копенгагене (Институт Нильса Бора); создатель мировой научной школы; иностранный член АН СССР (1929). Создал теорию атома, в основу которой легли планетарная модель атома, квантовые представления и предложенные им Бора постулаты. Важные работы по теории металлов, теории атомного ядра и ядерных реакций.
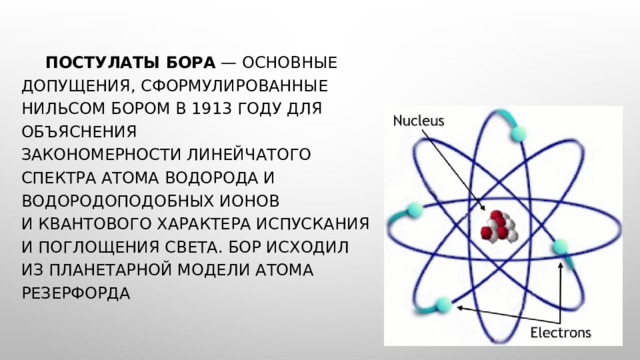
Постулаты Бора — основные допущения, сформулированные Нильсом Бором в 1913 году для объяснения закономерности линейчатого спектра атома водорода и водородоподобных ионов и квантового характера испускания и поглощения света. Бор исходил из планетарной модели атома Резерфорда

I постулат - постулат стационарных состояний:
В атоме существуют стационарные квантовые состояния, не изменяющиеся с течением времени без внешнего воздействия на атом. В этих состояниях атом не излучает электромагнитных волн, хотя и движется с ускорением. Каждому стационарному состоянию атома соответствует определенная энергия атома. Стационарным состояниям соответствуют стационарные орбиты, по которым движутся электроны.

II ПОСТУЛАТ - ПОСТУЛАТ квантования МОМЕНТА ДВИЖЕНИЯ ЭЛЕКТРОНА НА ОРБИТЕ
- В стационарном состоянии атома электрон, двигаясь по круговой орбите, должен иметь дискретные, квантовые значения момента импульса.
m e - масса электрона,
υ – скорость электрона
r n – радиус стационарной круговой орбиты
Квантование-придание физическим величинам в микро мире дискретного набора значений.
Правило квантования Бора позволяет вычислить радиусы стационарных орбит электрона в атоме водорода и определить значения энергий.
 Eп происходит излучение фотона. где k и n - номера стационарных состоянии, или главные квантовые числа. " width="640"
Eп происходит излучение фотона. где k и n - номера стационарных состоянии, или главные квантовые числа. " width="640"
III постулат - правило частот:
При переходе атома из одного стационарного состояния в другое излучается или поглощается 1 фотон. а) Атом излучает 1 фотон(который несет 1 квант энергии), когда электрон переходит из состояния с большей энергией (Е k) в состояние с меньшей энергией (Е n).
Энергия излученного фотона: Частота излучения:
Здесь (Ek - En) - разность энергий стационарных состояний. При Ек Eп происходит излучение фотона.
где k и n - номера стационарных состоянии, или главные квантовые числа.

- б) Атом поглощает 1 фотон, когда переходит из стационарного состояния с меньшей энергией (E n) в стационарное состояние с большей энергией (E k). При Ек происходит поглощение фотона. После экспериментальных проверок правильности модели атома Резерфорда и принятия постулатов Бора ученым пришлось признать ограниченность применения законов классической физики для микроскопических тел.
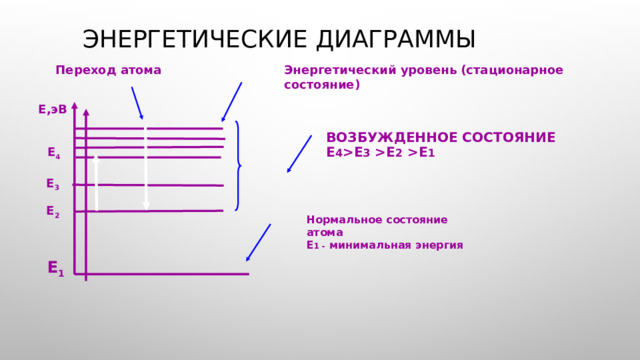 Е 3 Е 2 Е 1 Е 4 Е 3 Е 2 Нормальное состояние атома Е 1 - минимальная энергия Е 1 " width="640"
Е 3 Е 2 Е 1 Е 4 Е 3 Е 2 Нормальное состояние атома Е 1 - минимальная энергия Е 1 " width="640"
Энергетические диаграммы
Переход атома
Энергетический уровень (стационарное состояние)
Е,эВ
Возбужденное состояние
Е 4 Е 3 Е 2 Е 1
Е 4
Е 3
Е 2
Нормальное состояние атома
Е 1 - минимальная энергия
Е 1

Модель атома водорода по Бору
- Свои постулаты Н. Бор применил для построения теории строения простейшего атома (атома водорода). Согласно этой теории Бор смог вычислить для атома водорода: - возможные радиусы орбит электрона и размеры атома - энергии стационарных состояний атома - частоты излучаемых и поглощаемых электромагнитных волн.

Модель атома водорода по Бору
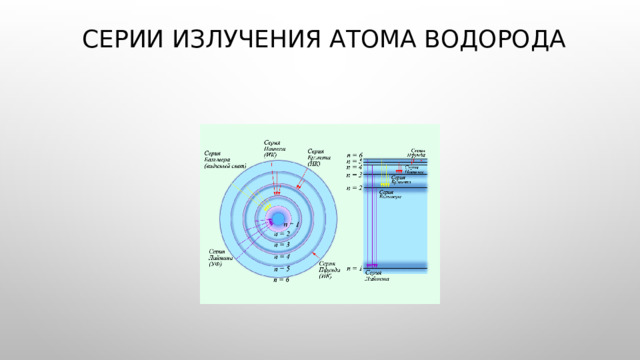
Серии излучения атома водорода

Применение теории Бора и её экспериментальные обоснования
- Объясняет строение атома водорода и водородоподобных атомов
- Существование спектральных серий: Лаймана, Бальмара, Пашина, Брекета, и Пфунда
- Опыты Франка и Герца

Недостатки теории Бора
- Является половинчатой (были использованы законы классической механики и квантовые постулаты)
- Постулаты Бора являются следствием квантовой механики и электродинамики
- Правило квантования Бора применяется не всегда
- Электроны не имеют определенных орбит, как в теории Бора













 Eп происходит излучение фотона. где k и n - номера стационарных состоянии, или главные квантовые числа. " width="640"
Eп происходит излучение фотона. где k и n - номера стационарных состоянии, или главные квантовые числа. " width="640"

 Е 3 Е 2 Е 1 Е 4 Е 3 Е 2 Нормальное состояние атома Е 1 - минимальная энергия Е 1 " width="640"
Е 3 Е 2 Е 1 Е 4 Е 3 Е 2 Нормальное состояние атома Е 1 - минимальная энергия Е 1 " width="640"


























