
Молекулярная физика. Тепловые явления.

Подсказка купить шарики маленькие

Рассматриваемые вопросы:
1. Основы молекулярно-кинетической теории.
2. Температура. Энергия теплового движения молекул .
3. Уравнение состояния идеального газа. Газовые законы.
4. Взаимные превращения жидкостей и газов.
5. Твердые тела .
6. Основы термодинамики.

Основы МКТ
- Основные положения МКТ
- Молекулярно-кинетическая теория
- Масса и размеры молекул
- Количество вещества
- Строение газов, жидкостей и твердых тел
- Идеальный газ
- Среднее значение квадрата скорости молекул
- Основное уравнение МКТ

Температура и энергия теплового движения молекул
- Температура и тепловое равновесие
- Температура – мера средней кинетической энергии молекул
- Скорости молекул

Уравнение состояния идеального газа
- Уравнение Менделеева-Клапейрона
- Газовые законы
- Изотермический процесс Изобарный процесс Изохорный процесс
- Изотермический процесс
- Изобарный процесс
- Изохорный процесс

Взаимные превращения жидкостей и газов
- Насыщенный пар
- Испарение и кипение
- Влажность воздуха
- Измерение влажности

Твердые тела
- Закон Гука
- Кристаллические тела
- Аморфные тела

Основы термодинамики
- Внутренняя энергия
- Работа в термодинамике
- Количество теплоты
- Первый закон термодинамики и его применение к различным процессам
- Тепловые двигатели

Основные положения МКТ
1. Все вещества состоят из молекул
2. Молекулы находятся в непрерывном беспорядочном движении
3. Между молекулами действуют силы взаимного притяжения и отталкивания

Молекулярно-кинетическая теория
- МКТ объясняет свойства макроскопических тел и тепловых процессов, на основе представлений о том, что все тела состоят из отдельных, беспорядочно движущихся частиц.
- Макроскопические тела – тела, состоящие из большого количества частиц.
- Микроскопические тела – тела, состоящие из малого количества частиц.

Броуновское движение
Броуновское движение - это тепловое движение взвешенных частиц в жидкости (или газе). Броуновское движение стало доказательством непрерывного и хаотичного (теплового) движения молекул вещества. - открыто английским ботаником Р. Броуном в 1827 г. - дано теоретическое объяснение на основе МКТ А. Эйнштейном в 1905 г. - экспериментально подтверждено франц. физиком Ж. Перреном.
Траектория броуновской частицы

Броуновское движение
- Причина броуновского движения состоит в том, что удары молекул жидкости о частицу не компенсируют друг друга.

Масса и размеры молекул
Оценка размера молекулы
Оценка массы молекулы

Подсказка шарики, связанные верёвкой на поверхности воды.

Масса и размеры молекул
В 1 г воды содержится 3,7 * 10 22 молекул.
Массы молекул в макроскопических масштабах чрезвычайно малы.

Масса и размеры молекул
этанол
кофе

Масса и размеры молекул
1961 год
Относительной молекулярной (или атомной) массой вещества (М r ) называют отношение массы молекулы (или атома) m 0 данного вещества к 1/12 массы атома углерода m 0C .

Количество вещества
Количество вещества наиболее естественно было бы измерять числом молекул или атомов в теле. Но число частиц в любом макроскопическом теле так велико, что в расчетах используют не абсолютное число частиц, а относительное.
Один моль – это количество вещества, в котором содержится столько же молекул или атомов, сколько содержится в углероде массой 12 г.

Количество вещества
В 1 моле любого вещества содержится одно и то же число атомов или молекул.
- постоянная
Авогадро
Количество вещества равно отношению числа молекул в данном теле к постоянной Авогадро.

Количество вещества
Молярной массой вещества называют массу вещества, взятого в количестве
1 моль.
m 0 - масса одной молекулы или атома

Количество вещества
m – масса вещества
- формула для расчета числа частиц в теле

Строение газов, жидкостей и твердых тел
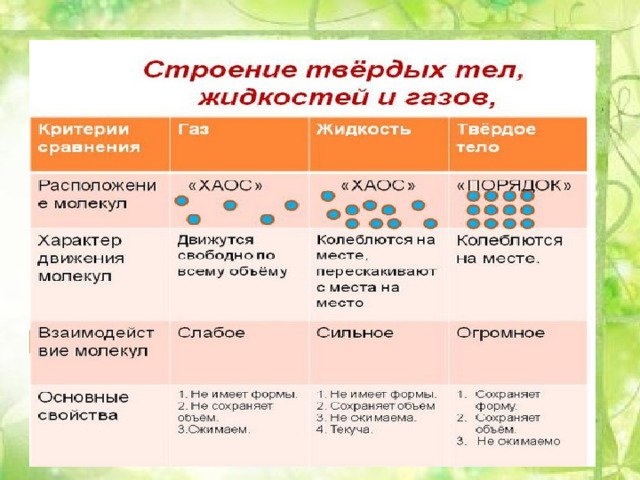

Подсказка строение вещества(агрегатные состояния и шариков)

Идеальный газ
Идеальный газ – это газ, в котором
- Частицы – материальные точки
- Частицы взаимодействуют только при соударениях
- Удары абсолютно упругие

Среднее значение квадрата скорости молекул
- Скорость – величина векторная, поэтому средняя скорость движения частиц в газе равна нулю.

Среднее значение квадрата скорости молекул

Основное уравнение мкт
- Основное уравнение мкт устанавливает зависимость давления газа от средней кинетической энергии его молекул.
- Газ оказывает давление на стенки сосуда путем многочисленных ударов молекул (или атомов).
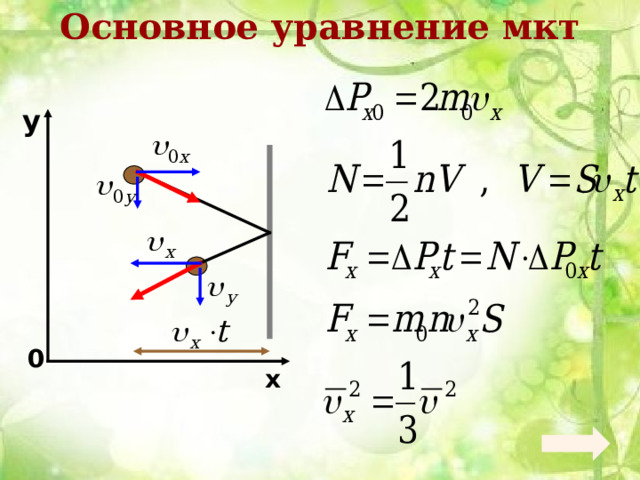
Основное уравнение мкт
y
0
x


Температура и тепловое равновесие
- Макроскопические параметры (макропараметры) – величины, характеризующие состояние макроскопических тел без учета молекулярного строения. ( V, p, t ).
- Тепловым равновесием называют такое состояние, при котором все макроскопические параметры всех тел системы остаются неизменными сколь угодно долго.

- Любое макроскопическое тело или группа макроскопических тел при неизменных внешних условиях самопроизвольно переходит в состояние теплового равновесия.
- Все тела системы, находящиеся друг с другом в тепловом равновесии имеют одну и ту же температуру.

- Термометр – прибор для измерения температуры тела.
- Термометр входит в состояние теплового равновесия с исследуемым телом и показывает свою температуру.

Основная деталь термометра – термометрическое тело , то есть тело, макропараметры которого изменяются при изменении температуры. (Например, в ртутных термометрах термометрическим телом является ртуть – при изменении температуры изменяется ее объем.)

- Изобретателем термометра является Галилео Галилей (ок. 1600 г.)
- Термометрическим телом в его термометре являлся газ – при повышении температуры его объем увеличивался, вытесняя жидкость.
- Недостатком термометра Галилея являлось отсутствие температурной шкалы.

Температурные шкалы

Постоянная Больцмана
- Разность полученных в эксперименте значений величины pV/N равна 1,38*10 -21 Дж.
- Разделим полученную величину на 100, и найдём, что одному градусу по Цельсию соответствует k=1,38 *10 -23 по Кельвину.
- k=1,38 *10 -23 Дж / К – постоянная Больцмана.

Температура тела – мера средней кинетической энергии движения молекул.
- Какая физическая величина одинакова у любых тел при тепловом равновесии?
- Предположим, что при тепловом равновесии средние кинетические энергии молекул одинаковы.
- Из основного уравнения МКТ можно получить :

Абсолютная температура и абсолютный нуль
- Из полученного равенства следует, что при Т = 0 должны равняться нулю или давление (т.е. движение и соударение молекул со стенками прекращается) или объём газа (т.е. сжатие до нуля).
- Отсюда понятие абсолютного нуля температуры (0 К) – температуры, при которой должно прекратиться движение молекул.
- Установим связь между абсолютной температурой и температурой по Цельсию:
т. к. при t = 0 kT = 3,76*10 -21 Дж,
где k = 1,38 *10 -23 Дж /K ,
то T = 3,76*10 -21 / 1,38 *10 -23 ≈ 273,15 (K)
Таким образом Т ≈ t + 273

Зависимость давления газа от температуры и концентрации молекул газа

Скорости молекул
- средняя квадратичная скорость

Уравнение состояния идеального газа ( ур-е Менделеева – Клапейрона)
- универсальная газовая постоянная

Если в ходе процесса масса газа остается неизменной, то

Изопроцессы
- Изотермический процесс Изобарный процесс Изохорный процесс
- Изотермический процесс
- Изобарный процесс
- Изохорный процесс

Изотермический процесс
- Процесс, происходящий с газом неизменной массы при постоянной температуре называется изотермическим.
- Изотермический процесс описывается законом Бойля – Мариотта (конец 17 века):

Изобарный процесс
- Процесс, происходящий с газом неизменной массы при постоянном давлении называется изобарным.
- Изобарный процесс описывается законом Гей-Люссака (1802 г.):

Изохорный процесс
- Процесс, происходящий с газом неизменной массы при постоянном объеме называется изохорным.
- Изохорный процесс описывается законом Шарля (1787 г.):

Графики изопроцессов


Давление насыщенного пара
p 2 , V 2
p 1 , V 1
p 1 = p 2
Давление насыщенного пара не зависит от занимаемого объема.

Давление насыщенного пара
Давление насыщенного пара зависит только от температуры.
p 0
T

Давление насыщенного пара
Точка росы – это температура, при которой ненасыщенный пар становится насыщенным .
p 0
p
T
T
T р

Испарение и кипение
Процесс парообразования с поверхности жидкости.
Процесс парообразования по всему объему жидкости.
Происходит при любой температуре.
Происходит при температуре кипения.
Скорость испарения зависит от:
- Вида жидкости
- Температуры
- Площади поверхности
- Наличие ветра
Чем ниже давление, тем ниже температура кипения.

Кипение
- Кипение начинается при температуре, при которой давление насыщенного пара в пузырьках сравнивается с давлением в жидкости.
- Чем больше внешнее давление, тем выше температура кипения.
- Чем выше давление насыщенного пара, тем ниже температура кипения соответствующей жидкости.



Измерение влажности
Приборы для измерения влажности:

Закон Гука
F
- абсолютное удлинение.
F упр
- относительное удлинение
k – жесткость

Закон Гука
- механическое напряжение
- предел прочности – максимальное механическое напряжение, которое выдерживает данное вещество
Е – модуль Юнга

Закон Гука
k 2
k 1
k 1
k 2

Кристаллические тела
монокристаллы
поликристаллы
Анизотропия – зависимость физических свойств от направления внутри кристалла.
Кристаллическая решетка поваренной соли

Аморфные тела
- Нет строгого порядка в расположении атомов.
- Все аморфные тела изотропны , т.е их физические свойства одинаковы по всем направлениям.
- Аморфные тела не имеют определенной температуры плавления .
- При внешних воздействиях аморфные тела обнаруживают одновременно упругие свойства , подобно твердым телам, и текучесть , подобно жидкости.

Внутренняя энергия
Внутренняя энергия макроскопического тела равна сумме кинетических энергий беспорядочного движения всех молекул (или атомов) тела и потенциальных энергий взаимодействий всех молекул друг с другом (но не с молекулами других тел).
- Внутренняя энергия макроскопического тела равна сумме кинетических энергий беспорядочного движения всех молекул (или атомов) тела и потенциальных энергий взаимодействий всех молекул друг с другом (но не с молекулами других тел).

В идеальном газе частицы не взаимодействуют между собой, следовательно их потенциальные энергии равны нулю.

3
2
- Коэффициент применим только для одноатомного газа.
- В общем случае используется коэффициент , где i – число степеней свободы движения частицы.
i
2
Одноатомный газ (неон, аргон, гелий) – i = 3 .
Двухатомный газ (водород, азот) – i = 5 .
Трехатомный газ (углекислый газ, озон) – i = 6 .

Способы изменения внутренней энергии:
- Передача теплоты
- Совершение работы

Работа в термодинамике
Работа газа:
По третьему закону Ньютона:
Работа внешних сил над газом:

Работа в термодинамике
- Если процесс не изобарный, используется графический метод: работа равна площади фигуры под графиком процесса в осях pV .
- Работа газа считается положительной, если объем газа увеличивается и отрицательной, если объем газа уменьшается.
p
- В случае изохорного процесса работа газа равна нулю.
S
V
0

Количество теплоты
Количество теплоты – это энергия полученная или отданная телом в процессе теплопередачи.
Виды теплопередачи:
- Теплопроводность
- Конвекция
- излучение

Количество теплоты
- Q = cm(t 0 2 -t 0 1 ) – нагревание (охлаждение)
- Q = m - плавление (отвердевание)
- Q = Lm - парообразование (конденсация)
- Q = qm – сгорание топлива

Первый закон термодинамики
Обмен энергией между термодинамической системой и окружающими телами в результате теплообмена и совершаемой работы

Изменение внутренней энергии системы при переходе ее из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе:
Если А - работа внешних сил, а А' - работа газа, то А = - А' (в соответствии с 3-м законом Ньютона). Тогда:
другая форма записи первого закона термодинамики

Применение первого закона термодинамики к различным процессам
- Изотермический процесс
- Изобарный процесс
- Изохорный процесс
- Адиабатный процесс

Изотермический процесс ( Т= const)


Изобарный процесс (p=const)
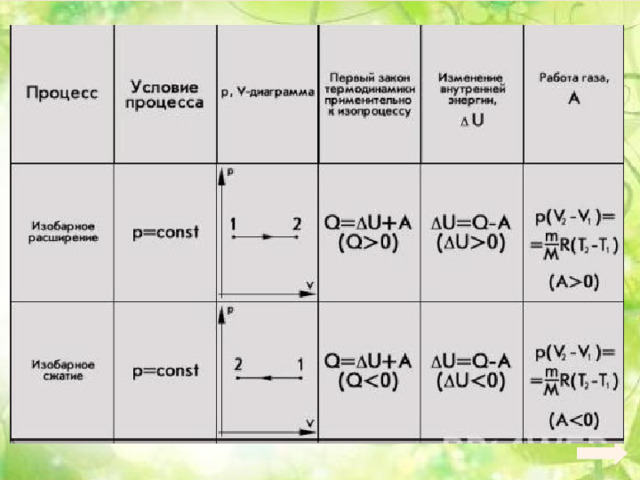

Изохорный процесс (V=const)


Адиабатный процесс


Тепловые двигатели
Машины, преобразующие внутреннюю энергию в механическую работу, называют тепловыми двигателями
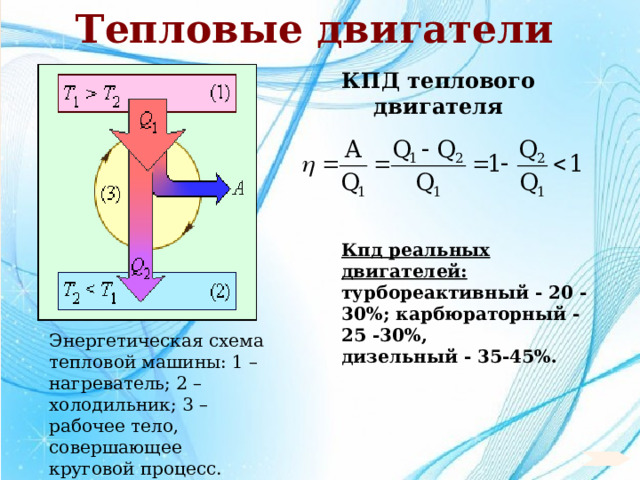
Тепловые двигатели
КПД теплового двигателя
Кпд реальных двигателей:
турбореактивный - 20 -30%; карбюраторный - 25 -30%,
дизельный - 35-45%.
Энергетическая схема тепловой машины: 1 – нагреватель; 2 – холодильник; 3 – рабочее тело, совершающее круговой процесс.

Идеальная тепловая машина - машина Карно (Сади Карно, Франция, 1815)
Машина работает на идеальном газе.
1 - 2 - при тепловом контакте с нагревателем газ расширяется изотермически.
2 -3 - газ расширяется адиабатно.
После контакта с холодильником:
3 -4 - изотермическое сжатие.
4 -1 - адиабатное сжатие.
КПД идеальной машины:
Теорема Карно: кпд реальной тепловой машины не может быть больше кпд идеальной машины, работающей в том же интервале температур.

Спасибо за внимание!



















































































































