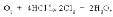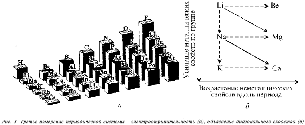УДК 544.11
ПРОГНОСТИЧЕСКОЕ ЗНАЧЕНИЕ ПЕРИОДИЧЕСКОЙ СИСТЕМЫ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ Д.И. МЕНДЕЛЕЕВА
Гаврик А.Л.
Россия, Республика Адыгея, г. Майкоп, МБОУ «СШ№7»
Аннотация: Возможность предсказания свойств элементов и их соединений по положению элемента в периодической системе широко использовалась и используется в различных областях промышленности техники для решения разнообразных проблем, связанных с созданием новых материалов с определёнными, заранее заданными свойствами. Таким образом: появление периодической системы открыло новую, подлинно научную эру в истории химии и ряде смежных наук — взамен разрозненных сведений об элементах и соединениях появилась стройная система, на основе которой стало возможным обобщать, делать выводы, предвидеть.
Ключевые слова: прогностичность, амфотерность, группа, период, химический элемент, электроотрицательность, триады, «правило звездности», «метод атомной аналогии».
«Периодическому закону будущее не грозит разрушением,
а только надстройка и развитие обещаются».
Д. И. Менделеев
Бурное развитие новых информационных и коммуникационных технологий изменяет характер приобретения и распространения знаний. Новые технологии открывают возможности для обновления содержания обучения и методов преподавания.
При увеличении объема информации необходимой для освоения учебной дисциплины, остро встаёт вопрос об эффективности ее передачи, организации максимальной активности обучающихся при восприятии, способах и средствах, способствующих повышению творческого интереса к изучаемой дисциплине.
Актуальность темы исследования определяется целесообразностью совершенствования методики обучения химии школьников, с использованием прикладных программных средств, реализованных на базе мультимедийных и интернет технологий.
Периодическая система Д.И. Менделеева обладает огромным дидактическим потенциалом, предоставляя прекрасные возможности для составления заданий, направленных на формирование познавательных универсальных учебных действий, обозначенных в Федеральном государственном образовательном стандарте, в том числе, на развитие стратегий, смыслового чтения и навыков работы с информацией.
Многие свойства атомов химических элементов и их соединений можно представить периодической системе Д.И. Менделеева. Например, название элементов, значение их относительных атомных масс, величины электроотрицательности элементов, их атомных и ионных радиусов, энергии ионизации и энергии сродства к электрону, а также данные распространённости элементов в природе, времени их открытия, значения температур плавления и кипения простых веществ и так далее.
Это позволит легко находить необходимую информацию и переводить ее из одной наглядно-символической формы в другую (таблицы, диаграммы, графики), выявить закономерности изменения свойств химических элементов и их соединений в периодах слева направо и в группах сверху вниз.
Применение таких заданий в учебном процессе, основанных на систематизации и интерпретации, содержащихся в ПС значениях, позволяет значительно разнообразить методы обучения и активизации познавательной деятельности обучающихся, совершенствовать навыки поиска и работы с информацией.
В отличие от своих научных предшественников от И.В. Дёберейнера до Л.Ю.Мейера открытию периодического закона и созданию периодической таблицы способствовало то, что Дмитрий Иванович за основу взял не одну только атомную массу элементов, но и результаты применения «метода атомной аналогии».
Ученый этот метод разработал специально для анализа свойств элементов, и результаты его использования были потрясающими. Из 29 предсказанных элементов Менделеев с удивительной точностью описал 12. При этом подробности свойств относились не только к простому веществу, но и к соединениям.
В качестве аргумента в пользу важности этого метода сошлюсь на авторитет академика А.Е.Ферсмана, который очень удачно и образно назвал его «правилом звездности». В соответствии с этим правилом подтверждается закономерность связи свойств данного элемента и свойств всех восьми его соседей (рис. 1). Так магний должен иметь общие черты не только с Bе и Са – по группе, с Na и Al – по периоду, но и с Li и Ga, В и К – по диагоналям.
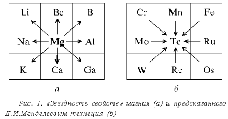
Теперь самый главный вопрос. Что дает включение в курс химии средней школы «правила звездности»? Что теряется сейчас, когда о нем отсутствует даже упоминание?
Во-первых, это исключит даже саму возможность сомнения в том, что Менделеев был первооткрывателем периодического закона и периодической системы. Напомню вам о знаменитом споре с представителем немецкой науки Мейером, отголоски которого доходят и до наших дней. Если мы привлечем к рассмотрению «правило звездности» как второе обоснование явления периодичности, то упомянутая дискуссия закончится в пользу Менделеева.
Ведь зависимость химических свойств от атомных весов элементов была известна и применялась задолго до рождения Менделеева (1834) и Мейера (1830). Еще в 1817 г. Дёберейнер представил первую триаду: литий–натрий–калий; к 1829 г. таких триад им обнародовано было уже пять. Принципиальных отличий между триадами Дёберейнера, таблицей Мейера или другими предложениями предшественников Менделеева не существует. Все они имели лишь иллюстративный характер, включали лишь известные элементы, да и то иногда не все из открытых (так в таблицу Мейера не были включены водород, иттрий и другие элементы). Предсказать, а тем более описать свойства неоткрытых элементов, их простых веществ и соединений ни одному из предшественников Менделеева не удалось. Именно «правило звездности» свойств подтверждает, что найденная зависимость и последовательность свойств элементов выражает периодический закон природы.
Во-вторых, из «правила звездности» напрямую следует «диагональное сходство» и, соответственно, «диагональное сечение» (выражения С.А.Щукарева) периодической системы. О них в современных школьных учебниках не упоминается, а сами диагонали не рассматриваются. Как следствие этого, становится непонятным появление амфотерных элементов и остается неясным обоснование этого свойства.
Опытными и добросовестными учителями упоминается последовательность амфотерных элементов, находящихся на границе с неметаллами по диагонали бор–астат. Однако таких «диагональных сечений» в периодической восьми- или шестнадцатиклеточной менделеевской таблице не одно, а значительно больше. Только для главных подгрупп, состоящих из s- и р-элементов, их десять (рис. 2). Более подробно см. статью «Диагонали периодической системы» («Химия в школе», 1999 г.)

В-третьих, без учета «правила звездности» трудно понять некоторые фактические сведения о свойствах конкретных элементов. Известно, например, что в группе щелочно-земельных элементов щелочи образуются только с кальция (IV период). Этого нельзя понять, если не рассматривать химическое сходство лития и магния.
Обратимая реакция Дикона:
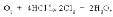
перестает быть феноменальной и является следствием естественных закономерностей свойств кислорода и хлора.
Представитель МГТУ им. Н.Э.Баумана профессор А.И.Горбунов рассказал о результатах поиска третьего измерения периодической системы, в качестве которого предлагается электроотрицательность . На рис. 3, а объем каждого элемента условно находится в зависимости от величины электроотрицательности. Кстати, это наглядно подтверждает «правило звездности» и диагональное сходство химических элементов, которое графически изображено на рис. 3, б.
Доклад академика Ю.Ц.Оганесяна также подтверждает актуальность «метода атомной аналогии». Синтез 114-го элемента, осуществленный в декабре 1998 г. в Объединенном институте ядерных исследований (г. Дубна) под руководством Оганесяна, доказал современность и справедливость такого подхода. Ядро 114-го элемента рассматривалось в этом поиске как аналог свинца. Здесь уместно напомнить, что «актиноидная теория» строения элементов в нижней части современной периодической таблицы была сформулирована также на принципах метода «атомной аналогии» в 1945 г.
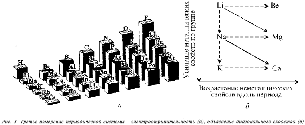
Как известно, обращение Менделеева к систематизации химических элементов было вызвано необходимостью найти основу для преподавания химии. Исходя из этого, следует все найденные им принципы построения периодической системы положить в основу преподавания химии в средней школе.
Прогностическая (предсказательная) функция Периодического закона получила самое яркое подтверждение в открытии неизвестных элементов с порядковыми номерами 21, 31 и 32. Их существование сначала было предсказано на интуитивном уровне, но с формированием системы Менделеев с высокой степенью точности смог рассчитать их свойства. Хорошо известная история открытия скандия, галлия и германия явилась триумфом менделеевского открытия. Он все предсказания делал на основе им же самим открытого всеобщего закона природы. Первоначальный вариант таблицы включал 63 элемента. За последние 50 лет она пополнилась 17 новыми элементами (порядковые номера 102-118). Российскими учеными из ОИЯИ было открыто 9 элементов, в том числе 5 сверхтяжелых элементов за последние 10 лет.
Всего же Менделеевым были предсказаны двенадцать элементов. С самого начала Менделеев указал, что закон описывает свойства не только самих химических элементов, но и множества их соединений.
Периодическая система явилась графическим отображением периодического закона. Она представляет собой классификацию химических элементов, устанавливающую зависимость различных свойств элементов от заряда атомного ядра.
Периодический закон и периодическая система элементов Д. И. Менделеева являются научной основой развития химической науки, познания строения и свойств простых и сложных веществ, преподавания общей и неорганической химии. При составлении периодической системы элементов Д. И. Менделеев руководствовался правилом возрастания атомной массы и принципом периодичности форм и свойств соединений химических элементов, прежде всего оксидов и гидроксидов элементов в высших степенях окисления. Как показали достижения физики в области квантовой механики строения атома, периодичность свойств элементов обусловлена периодической повторяемостью расположения валентных электронов на уровнях и подуровнях по мере роста заряда ядра атома. Велико прогностическое значение периодической системы химических элементов. Опираясь на периодическую систему, Д. И. Менделеев предсказал, например, существование и свойства неизвестных тогда химических элементов (Gа, Sc, Ge), которые были вскоре открыты; изменил атомные массы некоторых элементов (Au, Co, Ni…). В ХХ столетии были переосмыслены химическая природа и место в таблице трансурановых элементов, предсказана возможность открытия новых химических элементов. Закономерности периодической системы элементов широко используются в современной химии: геохимии, космохимии, ядерной химии, катализе при подборе катализаторов и т.д. При изучении химии очень полезно уметь пользоваться периодической системой элементов Д. И. Менделеева с целью написания формул многих веществ и прогнозирования их свойств. Настоящие методические указания могут помочь обучающемуся решить такие задачи, так как в них предлагаются пути определения строения атома, свойств многих простых и сложных веществ на основании положения химического элемента, их образующего, в периодической системе Д. И. Менделеева.
8 ноября 2016г. стало известно об официальном внесении четырех новых химических элементов в периодическую таблицу Менделеева. Об этом сообщает Международный союз теоретической и прикладной химии (IUPAC).
В периодической таблице Менделеева новые элементы обозначены номерами 113, 115, 117 и 118. По правилам IUPAC, правом давать названия новым химическим элементам обладают их первооткрыватели.
118-й элемент, которому было присвоено временное название "унуктоний", сменил его на постоянное и официальное «оганесон» (Og) в честь академика Российской академии наук Юрия Цолаковича Оганесяна за его инновационные исследования трансактиноидовых элементов.
Таким образом, седьмой ряд периодической таблицы Менделеева теперь полностью завершен.
Отметим, что на XX Менделеевском съезде ведущих химиков, проходившем в Екатеринбурге с 26 по 30 сентября 2016 года, директор Лаборатории ядерных реакций имени Г. Н. Флерова в ОИЯИ Сергей Николаевич Дмитриев заявил о том, что в ближайшее время ученые приступят к синтезу 119 и 120 элементов, которые станут первыми в восьмом периоде таблицы.
Периодический закон, основанный на теории строения атома, объяснил множество явлений природы, подтвердил философские категории.
Для формирования мировоззрения периодический закон подтверждает:
единство материального мира, развитие от простого к сложному, всеобщие законы развития природы: (единства и борьбы противоположностей, перехода количественных изменений в качественные, отрицание отрицания), философские категории: (содержание и форма, единичное, особенное, общее, причина и следствие), познаваемость мира.
За истекшее время закон Менделеева - подлинный закон природы – не только не устарел и не утратил своего значения, наоборот, значение его до конца еще не познано и не завершено, оно много шире, чем мог предполагать его творец, чем думали до недавнего времени ученые.
Таким образом, прогностическое значение периодической системы химических элементов Д.И. Менделеева показало, что изучение свойств химических элементов, основанных на знаниях периодического закона до сих пор актуально в наши дни.
Периодическую систему по праву называют "компасом исследователя, путеводной нитью в области химии физики, минералогии, техники, таблицей истории и мироздания". Открытие периодического закона и разработка периодической системы Д. И. Менделеевым явились вершиной развития химии XIX века, стали важнейшей вехой в развитии атомно-молекулярного учения. Благодаря им, сложилось современное понятие о химическом элементе, были уточнены представления о простых веществах и их соединениях, открыты предсказанные ранее химические элементы.
Литература
Азимов А. Краткая история химии. Развитие идей и представлений в химии. М.: Мир, 1983.
Аспицкая А.Ф. Роль химии в формировании мировоззрения учащихся. Химия (ИД «Первое сентября») 2011, № 3.
Агафошин И.П. Периодический закон и периодическая система химических элементов Д.И.Менделеева. М.: Просвещение. 1982.
Горбунов А.И., Филиппов Г.Г. Периодическая система химических элементов: симметрия, правильные конфигурации, третье измерение. М.: Аслан, 1996.
Щукарев С.А. Периодическая система Д.И.Менделеева и современная химия. В сб.: Периодический закон и строение атома. М.: Атомиздат, 1971.
PROGNOSTIC VALUE OF THE PERIODIC SYSTEM OF CHEMICAL ELEMENTS
D. I. MENDELEEV
Gavrik A. L.
Russia, Republic of Adygea, Maikop, Municipal State-Funded Educational Institution School №7
Abstract: The ability to predict the properties of elements and their compounds by the position of the element in the periodic table has been widely used and is used in various fields of engineering to solve various problems associated with the creation of new materials with certain predetermined properties. Thus: the emergence of the periodic table opened a new, truly scientific age in the history of chemistry and a number of related Sciences — instead of different kinds of information about the elements and compounds there was a coherent system, on the basis of which it became possible to generalize, draw conclusions and anticipate.
Key words: predictability, amphoteric character, group, row (period), chemical element, electronegativity, the triad, the «rule of stardom», «the method of nuclear analogy».