Районный конкурс научно-исследовательских работ школьников «Шаг в науку»
Знакомый незнакомец
(Углекислый газ и все о нем)
Автор: Гаврилова Александра Валерьевна
ученица 6 а класса МБОУ Верх-
Усуглинской средней
общеобразовательной школы
Научный руководитель: учитель химии
и географии Пляскина Т. В.
с. Верх – Усугли
2018- 2019
Краткая аннотация
Знакомый незнакомец
(Углекислый газ и все о нем)
Гаврилова Александра Валерьевна
Россия, Забайкальский край, Тунгокоченский район, с. Верх-Усугли,
МБОУ Верх-Усуглинская СОШ, 6 а класс
Цель работы: Изучение особенностей углекислого газа, его значения в природе и для человека и проведение с ним необходимых опытов.
Работа включает в себя план исследований, научную статью, экспериментальную часть и заключение. Во введении обосновывается актуальность, ставятся цель и задачи. В основной части рассматривается состав и строение углекислого газа, немного из истории открытия, его свойства, биологическая роль, образование в природе, получение и применение человеком. Затем описывается экспериментальная часть. В конце работы сформулированы выводы.
Содержание работы соответствует поставленным задачам. Материал излагается логично и научным языком. При написании работы используются следующие приемы: эксперимент, обобщение, анализ литературных источников, интернета. Работа направлена на расширение и углубление имеющихся знаний о таком казалось бы знакомом всем веществе как углекислый газ. Данный материал имеет практическую значимость. Материал этой работы можно использовать для проведения классных часов, на уроках химии, биологии, экологии, во внеклассной работе по этим предметам.
Руководитель: Пляскина Т.В
Аннотация
Знакомый незнакомец
(Углекислый газ и все о нем)
Гаврилова Александра Валерьевна
Россия, Забайкальский край, Тунгокоченский район, с. Верх-Усугли,
МБОУ Верх-Усуглинская СОШ, 6а класс
Работа включает в себя план исследований, научную статью, практическую часть, заключение.
Актуальность: углекислый газ – это знакомое всем вещество. Он не имеет цвета и запаха. Все знают, что он образуется при дыхании живых организмов и нужен растениям для фотосинтеза. Также известно, что он не поддерживает горение и используется для тушения пожаров.
Меня заинтересовали вопросы: из чего он состоит? Какие еще свойства имеет? Как он образуется и можно ли получить его в условиях школьной лаборатории? Какие опыты с ним можно провести? Где человек его применяет? Все ли одноклассники знают о нем?
Цель моей работы: Изучение особенностей углекислого газа, его значения в природе и для человека и проведение с ним необходимых опытов.
Объект исследования: углекислый газ.
Предмет исследования: свойства и биологическая роль углекислого газа, особенности его образования и применения.
Задачи:
-Изучить литературные источники и источники интернет – ресурсов по теме.
-Изучить состав и строение молекулы углекислого газа, его физические и химические свойства, биологическое значение, особенности образования в природе и антропогенные источники образования, получение и применение, а также способы его обнаружения.
- Получить углекислый газ разными способами и исследовать его свойства.
- Сделать выводы.
Содержание работы соответствует поставленным задачам. Материал излагается логично, доступно, и в то же время, научно. При написании работы используются следующие методы: анализ литературы по данной теме, данных из интернета, обобщение, сравнение, эксперимент. В процессе работы я приобрела знания вне школьной программы. Материал может использоваться на уроках и во внеклассной работе.
Руководитель: учитель химии и географии Пляскина Т.В.
Знакомый незнакомец
(Углекислый газ и все о нем)
Гаврилова Александра Валерьевна
Россия, Забайкальский край, Тунгокоченский район, с. Верх-Усугли,
МБОУ Верх-Усуглинская СОШ, 6а класс
План исследований
Цель моей работы: Изучение особенностей углекислого газа, его значения в природе и для человека и проведение с ним необходимых опытов.
Объекты исследования: углекислый газ.
Предмет исследования: свойства и биологическая роль углекислого газа, особенности его образования и применения.
Задачи:
-Изучить литературные источники и источники интернет – ресурсов по теме.
-Изучить состав и строение молекулы углекислого газа, его физические и химические свойства, биологическое значение, особенности образования в природе и антропогенные источники образования, получение и применение, а также способы его обнаружения.
- Получить углекислый газ разными способами и исследовать его свойства.
- Сделать выводы.
Гипотезы:
-я могу получить углекислый газ дома и в школьной лаборатории
-я могу обнаружить присутствие углекислого газа определенными способами
-я могу изучить некоторые свойства углекислого газа экспериментально
Методы исследования: 1. Изучение литературы.
2. Химический эксперимент.
3.Обобщение и систематизация информации.
Этапы работы:
-
Изучить информацию об углекислом газе.
-
Подготовить и провести эксперименты.
-
Сделать выводы
Данную работу можно использовать на уроках естественного цикла (биология, химия, физика) и во внеклассной работе.
Библиографический список
Интернет-ресурсы:
1. http://www.xumuk.ru/encyklopedia/1684.html
2. http://ru.wikipedia.org/wiki.
3. http://www.alhimik.ru
4. И.В.Гурина. Безопасный уровень углекислого газа требует ревизии. Журнал «Экологический Вестник России» (№10, 2008).
5. Е.О.Шилькрот, Ю.Д.Губернский. Сколько воздуха нужно человеку для комфорта? Журнал «АВОК» (№4, 2008).
6. Биология. Дополнительные материалы к урокам и внеклассным мероприятиям по биологии и экологии в 10-11 классах / авт.-сост. М.М.Боднарук, Н.В.Ковылина. – 2-е изд., стереотип. – Волгоград: Учитель, 2008 г.
7. http://www.enontek.ru.
Содержание
Введение
-
Состав и строение углекислого газа 7
-
История открытия углекислого газа 7
-
Физические и химические свойства углекислого газа 7
-
Биологическая роль углекислого газа 8
-
Образование углекислого газа в природе 11
-
Антропогенное образование углекислого газа 12
-
Получение углекислого газа в промышленности и школьной лаборатории 13
-
Применение углекислого газа человеком 13
-
Практическая часть 14
-
Заключение 18
1.Состав и строение углекислого газа
Химическая формула углекислого газа – СО2. Его молекула состоит из 1 атома углерода и 2 атомов кислорода. Углекислый газ – вещество, которое имеет множество названий: оксид углерода (IV), диоксид углерода или же двуокись углерода. Также его еще называют угольным ангидридом.
2. История открытия углекислого газа
Углекислый газ был первым между всеми другими газами противопоставлен воздуху под названием «дикий газ» алхимиком XVI века Вант Гельмонтом. Открытием СО2 было положено начало новой отрасли химии – пневматохимии (химии газов). Шотландский химик Джозеф Блэк (1728–1799) в 1754 году установил, что известковый минерал мрамор (карбонат кальция) при нагревании разлагается с выделением газа и образует негашеную известь (оксид кальция).
Этот газ был идентичен открытому Ван Гельмонтом «дикому газу», но Блэк дал ему новое название – «связанный воздух» – так как этот газ можно было связать и вновь получить твердую субстанцию – карбонат кальция. Несколько лет спустя Кавендиш обнаружил еще два характерных физических свойства углекислого газа – его высокую плотность и значительную растворимость в воде.
3.Физические и химические свойства углекислого газа.
Физические свойства. Он является совершенно бесцветным газом, который не имеет запаха (в больших концентрациях с кисловатым «содовым» запахом), с кисловатым вкусом. Кисловатый привкус вызван тем, что углекислый газ растворяется на слизистых и в слюне, образуя слабый раствор угольной кислоты. Именно способность диоксида углерода растворяться в воде используется для изготовления газированных вод. Первый аппарат для насыщения воды CO2 был изобретен еще в 1770 г., а уже в 1783 г. предприимчивый швейцарец Якоб Швепп начал промышленное производство газировки (торговая марка Schweppes).
Углекислый газ в 1,5 раза тяжелее воздуха, поэтому «оседает» в его нижних слоях, если помещение плохо вентилируется. Известен эффект «собачьей пещеры», где CO2 выделяется прямо из земли и накапливается на высоте около полуметра. Взрослый человек, попадая в такую пещеру, на высоте своего роста не ощущает избытка углекислого газа, а собаки оказываются в густом слое диоксида углерода и подвергаются отравлению.
Углекислый газ легко пропускает излучение в ультрафиолетовой и видимой части спектра, которое поступает на Землю от Солнца и обогревает её. Также он поглощает испускаемое Землёй инфракрасное излучение и является одним из парниковых газов, принимая участие в процессе глобального потепления.
В спокойном электрическом разряде светится характерным бело-зелёным светом. Растворим в воде.
В газообразном состоянии этот газ существует в нормальных условиях - при нормальном атмосферном давлении и обычной температуре. При температуре ниже -78 °С кристаллизуется и становится похожим на снег. При повышении давления, например на морской глубине, он превращается в жидкость. При атмосферном давлении диоксид углерода не существует в жидком состоянии, переходя из твёрдого состояния сразу в газообразное состояние (возгонка). Твёрдый диоксид углерода называют сухим льдом. При повышенном давлении и обычных температурах углекислый газ переходит в жидкость, что используется для его хранения.
Углекислый газ нетоксичен, но при вдыхании его повышенных концентраций в воздухе по воздействию живые организмы его относят к удушающим газам. По ГОСТу (ГОСТ 8050-85) углекислота относится к 4-му классу опасности.
По химическим свойствам диоксид углерода относится к кислотным оксидам. При растворении в воде образует угольную кислоту. Реагирует со щёлочами с образованием карбонатов и гидрокарбонатов. Оксид углерода(IV) не поддерживает горения. В нём горят только некоторые активные металлы.
4.Биологическая роль углекислого газа
Жизнь на Земле возникла 3-4 млрд. лет назад. Атмосфера в это время состояла в основном из углекислого газа. Кислород практически отсутствовал.
Углекислый газ и есть источник всего живого на Земле. Когда животные и растения развились, они начали поглощать его больше, чем выделяли вулканы, гейзеры и т.д. Огромные запасы углекислоты, съеденные растительностью и унесенные в подземелье в осадочные породы, образовали торф, сланцы, угли, нефти, почву. В воздухе осталось всего 0,03%углекислоты.
Углекислый газ атмосферы — основной источник углерода для растений. Растения в процессе фотосинтеза образуют из него разнообразные органические соединения, и углерод включается в структуру растений. Углерод может оставаться в растениях, пока растения не погибнут. Тогда их молекулы пойдут в пищу организмам, которые питаются мертвым органическим веществом (грибы). Углерод вернется в атмосферу в качестве CO2 при дыхании грибов. Растения могут быть съедены травоядными животными. В этом случае углерод либо вернется в атмосферу (дыхание животных, разложение после смерти), либо травоядные животные будут съедены плотоядными (углерод вернется в атмосферу теми же путями). Растения могут погибнуть и превратятся в ископаемое топливо – например, в уголь.
CO2 – один из конечных продуктов обмена веществ (расщепления глюкозы и жиров). Он выделяется в тканях и переносится при помощи гемоглобина к легким, через которые выдыхается. В выдыхаемом человеком воздухе около 4,5% диоксида углерода – в 60-110 раз больше, чем во вдыхаемом.
Углекислый газ играет большую роль в регуляции кровоснабжения и дыхания. Повышение уровня CO2 в крови приводит к тому, что капилляры расширяются, пропуская большее количество крови, которое доставляет к тканям кислород и выводит углекислоту. Дыхательная система тоже стимулируется повышением содержания углекислого газа, а не нехваткой кислорода, как может показаться. В действительности нехватка кислорода долго не ощущается организмом и вполне возможна ситуация, когда в разреженном воздухе человек потеряет сознание раньше, чем почувствует нехватку воздуха. Это особенно опасно для пилотов военных самолётов, летающих на больших высотах (в случае аварийной разгерметизации кабины пилоты могут быстро потерять сознание). Вот почему в самолётах стюардессы инструктируют пассажиров в случае разгерметизации салона самолёта в первую очередь надевать кислородную маску самим, прежде чем пытаться помочь кому-либо — делая это, помогающий рискует быстро потерять сознание сам, даже не ощущая до последнего момента дискомфорта и потребности в кислороде. Стимулирующее свойство CO2 используется в аппаратах искусственного дыхания: там углекислый газ подмешивается к кислороду, чтобы «запустить» дыхательную систему.
Углекислый газ необходим человеческому организму так же, как кислород. Но так же, как с кислородом, переизбыток углекислого газа вредит нашему самочувствию. Большая концентрация CO2 в воздухе приводит к интоксикации организма и вызывает состояние гиперкапнии. При гиперкапнии человек испытывает трудности с дыханием, тошноту, головную боль и может даже потерять сознание. Если содержание углекислого газа не снижается, то далее наступает черед гипоксии – кислородного голодания. Дело в том, что и углекислый газ, и кислород перемещаются по организму на одном и том же «транспорте» – гемоглобине. В норме они «путешествуют» вместе, прикрепляясь к разным местам молекулы гемоглобина. Однако повышенная концентрация углекислого газа в крови понижает способность кислорода связываться с гемоглобином. Количество кислорода в крови уменьшается и наступает гипоксия. Такие нездоровые для организма последствия наступают при вдыхании воздуха с содержанием CO2 (таким может быть воздух в шахтах, например). В обычной жизни мы практически не сталкиваемся с таким воздухом. Однако и намного меньшая концентрация диоксида углерода отражается на здоровье не лучшим образом. Повышение содержания CO2 вызывает утомление и головную боль. Духоту и дискомфорт многие люди начинают ощущать еще раньше. При дальнейшем повышении концентрации углекислого газа критически снижается работоспособность, мозг «ленится» проявлять инициативу, обрабатывать информацию и принимать решения.
Эксперимент показал, что в редко проветриваемых школьных классах уровень CO2 значительную часть времени повышен. Есть все основания предполагать, что во многих офисах и даже квартирах ситуация похожая. Еще одно исследование обнаружило связь между уровнем CO2 и окислительным стрессом: чем выше уровень диоксида углерода, тем больше мы страдаем от окислительного стресса, который разрушает клетки нашего организма.
Организм человека выделяет приблизительно 1 кг углекислого газа в сутки.
Дыхательный центр человека пытается поддерживать давление углекислого газа в артериальной крови на определенном уровне. При сознательной гипервентиляции содержание углекислого газа в артериальной крови может снизиться, при этом содержание кислорода в крови практически не изменится или увеличится незначительно, а потребность сделать очередной вдох уменьшится. Такая сознательная гипервентиляция с последующей задержкой дыхания может привести к потере сознания до того, как человек ощутит потребность сделать вдох. В безопасной обстановке такая потеря сознания ничем особенным не грозит (потеряв сознание, человек потеряет и контроль над собой, перестанет задерживать дыхание и сделает вдох, дыхание, а вместе с ним и снабжение мозга кислородом восстановится, а затем восстановится и сознание). Однако в других ситуациях, например, перед нырянием, это может быть опасным (потеря сознания и потребность сделать вдох наступят на глубине, и в отсутствие сознательного контроля в дыхательные пути попадёт вода, что может привести к утоплению). Именно поэтому гипервентиляция перед нырянием опасна и не рекомендуется.
Физиологическая роль углекислого газа: СО2 является не только естественным регулятором дыхания, кровообращения, обмена веществ, электролитного баланса, проницаемости легочных сосудистых и клеточных мембран, КОС, но и возбудимости нервных клеток, тонуса гладкой мускулатуры бронхов, сосудов, мочевыводящих путей и т. д. Интерес к вопросу о физиологической роли СО2 возрос не только в связи с достижениями клинической и спортивной медицины, но и развитием авиации, космонавтики, а также в связи с освоением новых сред обитания (высокогорье, аридная зона, Мировой океан, Крайний Север) и изысканием эффективных средств по управлению регуляторными системами организма для профилактики и лечения различных заболеваний.
Углекислота играет важную роль в синтезе белка. В опытах на кроликах установлено, что при добавлении в пищу препарата, содержащего большое количество углекислоты, происходило ускорение регенерации поврежденных тканей почки на 30%, а клеток крови после кровопотери – даже в 2 раза.
Несмотря на такое ничтожное процентное содержание диоксида углерода в атмосфере, он оказывает огромное влияние на климат планеты. Углекислый газ – один из парниковых газов. Он поглощает и удерживает инфракрасное излучение с поверхности Земли, что в конечном итоге способствует повышению температуры на планете. Этот процесс называется парниковым эффектом. Без парникового эффекта температура на земном шаре была бы примерно на 30°С ниже.
Рост уровня СО2 в атмосфере Земли ведет к усилению парникового эффекта, а тот, в свою очередь – к необратимым изменениям климата. Уже сейчас можно наблюдать таяние ледников.
4.Образование углекислого газа в природе
Содержание углекислого газа в атмосфере относительно небольшое, около 0,03%.В 60 раз больше углекислого газа содержится в растворенном виде в морях и океанах.
В течение каждого года из атмосферы извлекается примерно 1/50 часть всего содержащегося в ней CO2 растительным покровом земного шара в процессе фотосинтеза, превращающего минеральные вещества в органические.
Углекислый газ в природе образуется из различных источников:
-Дыхание животных и растений.
Каждому школьнику известно, что растения поглощают углекислый газ CO2 из воздуха и используют его в процессах фотосинтеза. Некоторые хозяйки пытаются обилием комнатных растений искупить недостатки приточной вентиляции. Однако растения не только поглощают, но и выделяют углекислый газ в отсутствие света – это часть процесса дыхания. Поэтому джунгли в плохо проветриваемой спальне – не очень хорошая идея: ночью уровень CO2 будет расти еще больше.
-Вулканическая деятельность.
Диоксид углерода входит в состав вулканических газов. В местностях с высокой вулканической активностью CO2 может выделяться прямо из земли – из трещин и разломов. Концентрация углекислого газа в долинах там столь высока, что многие мелкие животные, попав туда, умирают.
-Разложение органических веществ.
Углекислый газ образуется при горении и гниении органики. Объемные природные выбросы диоксида углерода сопутствуют лесным пожарам.
Углекислый газ «хранится» в природе в виде углеродных соединений в полезных ископаемых: угле, нефти, торфе, известняке. Гигантские запасы CO2 содержатся в растворенном виде в мировом океане.
Выброс углекислого газа из открытого водоема может привести к лимнологической катастрофе, как это случалось, например, в 1984 и 1986 гг. в озерах Манун и Ньос в Камеруне. Оба озера образовались на месте вулканических кратеров – ныне они потухли, однако в глубине вулканическая магма все еще выделяет углекислый газ, который поднимается к водам озер и растворяется в них. В результате ряда климатических и геологических процессов концентрация углекислоты в водах превысила критическое значение. В атмосферу было выброшено огромное количество углекислого газа, который наподобие лавины спустился по горным склонам. Жертвами лимнологических катастроф на камерунских озерах стали около 1 800 человек.
Ежегодные колебания концентрации атмосферной углекислоты на планете определяются, главным образом, растительностью средних (40—70°) широт Северного полушария. Вегетация в тропиках практически не зависит от сезона, сухой пояс пустынь 20—30° (обоих полушарий) даёт малый вклад в круговорот углекислоты, а полосы суши, наиболее покрытые растительностью, расположены на Земле асимметрично (в Южном полушарии в средних широтах находится океан).
Поэтому с марта по сентябрь содержание СО2 в атмосфере падает, а с октября по февраль — повышается. Вклад в зимний прирост дают как окисление древесины (гетеротрофное дыхание растений, гниение, разложение гумуса, лесные пожары), так и сжигание ископаемого топлива (угля, нефти, газа), увеличивающееся в зимний сезон.
Также углекислый газ получается в результате множества окислительных реакций у животных, и выделяется в атмосферу с дыханием.
6. Антропогенное образование углекислого газа
Основными антропогенными источниками диоксида углерода являются:
-промышленные выбросы, связанные с процессами сгорания;
-автомобильный транспорт.
Несмотря на то, что доля экологичного транспорта в мире растет, подавляющая часть населения планеты еще не скоро будет иметь возможность (или желание) перейти на новые автомобили.
Активное сведение лесов в промышленных целях также ведет к повышению концентрации углекислого газа СО2 в воздухе
7. Получение в промышленности и лаборатории
В промышленности углекислый газ получается главным образом как побочный продукт обжига известняка, спиртового брожения и др. В промышленных количествах углекислота выделяется из дымовых газов, или как побочный продукт химических процессов, например, при разложении природных карбонатов (известняк, доломит) или при производстве алкоголя (спиртовое брожение). Также углекислый газ получают на установках разделения воздуха как побочный продукт получения чистого кислорода, азота и аргона.
В химических лабораториях либо пользуются готовыми баллонами с жидким углекислым газом, либо получают CO2 в аппаратах Киппа или приборе для получения газов действием соляной кислоты на куски мрамора:
мрамор + соляная кислота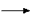 хлорид кальция + углекислый газ + вода
хлорид кальция + углекислый газ + вода
Для приготовления напитков может быть использована реакция пищевой соды с лимонной кислотой или с кислым лимонным соком.
Также для получения углекислого газа применяется реакция горения углерода в кислороде
8. Применение углекислого газа человеком
В пищевой промышленности углекислота используется как консервант и разрыхлитель, обозначается на упаковке кодом Е290.
Углекислый газ используется в медицине: в криохирургии используется как одно из основных веществ для лечения новообразований, для принятия углекислотных ванн.
Жидкая углекислота широко применяется в системах пожаротушения и в огнетушителях. Она эффективна, когда вода непригодна, например, при тушении огнеопасных жидкостей или при наличии в помещении не выключенной электропроводки или уникального оборудования, которое от воды может пострадать.
Устройство для подачи углекислого газа в аквариум может включать в себя резервуар с газом. Простейший и наиболее распространенный метод получения углекислого газа основан на конструкции для изготовления алкогольного напитка браги. При брожении, выделяемый углекислый газ вполне может обеспечить подкормку аквариумных растений.
Углекислый газ используется для газирования лимонада и газированной воды. Углекислый газ используется также в качестве защитной среды при сварке проволокой.
Углекислота в баллончиках применяется в пневматическом оружии (в газобаллонной пневматике) и в качестве источника энергии для двигателей в авиамоделировании.
Твёрдая углекислота — «сухой лёд» — используется в качестве хладагента в лабораторных исследованиях, в розничной торговле (хранение рыбы, мяса, мороженого), при ремонте оборудования и т. д. Сухой лед не только охлаждает, но и не дает продуктам плесневеть и гнить. Твердый CO2 скорее похож на спрессованный плотный снег, по твердости напоминающий мел. Температура «сухого льда» –78 оС. Сухой лед, в отличие от водяного льда, плотный. Он тонет в воде, резко охлаждая её. Горящий бензин можно быстро потушить, бросив в пламя несколько кусочков сухого льда. Сухим льдом испытывают в лабораториях детали, приборы, механизмы, которые будут служить в условиях пониженных температур. С помощью сухого льда испытывают морозоустойчивость резиновых покрышек автомобилей.
Практическая часть
При выполнении практической части я провела анкету, чтобы выяснить что знают об углекислом газе учащиеся 5-6 классов.
Анкета «Знакомый незнакомец (углекислый газ)»
1.Знаете ли вы о существовании углекислого газа?
2.Что вы знаете об углекислом газе?
3.Как он образуется?
4.Где используется?
5.Что хотели бы узнать о нем?
В анкетировании участвовали учащиеся 5-6 классов (37 человек).
На вопрос №1 «Знаете ли вы о существовании углекислого газа?» 31 человек ответили «да», 6 человек «нет». Таким образом, большинство учащихся знают о существовании углекислого газа. Не знают некоторые учащиеся 5 классов.
На вопрос №2 «Что вы знаете об углекислом газе?» были следующие ответы:
-что он выделяется при дыхании живых организмов-14 человек,
-что растения используют в процессе фотосинтеза-9 человек,
-без запаха-4 человека,
-бесцветный и тяжелее воздуха – 1 человек,
-содержание в воздухе небольшое-1 человек,
-опасен-1 человек.
Многие знают, что углекислый газ образуется при дыхании живых организмов и необходим для фотосинтеза. Остальные ничего не знают.
На вопрос №3 «Как он образуется?» ответили так:
-при дыхании живых организмов-12человек,
-образуется из углерода и кислорода-3 человека,
-образуется при сжигании топлива-1 человек.
В основном, знают один способ образования углекислого газа – при дыхании. Остальные не знают.
На вопрос №4 «Где используется?»
-для фотосинтеза растениями-12,
-в природе-4,
-изготовление газированной воды-2,
-в медицине-1,
-в науке-1.
Об использовании знают мало, самый распространенный ответ - фотосинтез растений, хотя это больше подходит к роли углекислого газа в природе или можно отнести к одной из отраслей сельского хозяйства – земледелие. Остальные не знают.
На вопрос №5 «Что хотели бы узнать о нем?»
-много или все-16
-где используется-6
-как образуется-4
-из чего состоит-2
-как растения из углекислого газа делают кислород-1
-сколько его во Вселенной-1
Ответы были разнообразны, хотя наибольшее количество ответов были все или многое. Часть детей ничего не хотят узнать.
Таким образом, учащиеся 5-6 классов мало знают об углекислом газе и большинство хотели бы знать о нем больше.
После проведения анкетирования я провела необходимые опыты.
1.Опыты по получению и обнаружению углекислого газа
Задачи: 1. Получить углекислый газ разными способами (гашение соды уксусной кислотой, гниение кусочка яблока, брожение дрожжей, взаимодействие мела с соляной кислотой, дыхание, горение спирта, фотосинтез)
2. Обнаружить углекислый газ при помощи известковой воды и горящей лучинки.
3. Сделать выводы.
1.Гашение соды уксусной кислотой. Гашение соды раствором уксусной кислоты мы применяем, когда готовим тесто. Это необходимо, чтобы тесто было более пышным и пористым.
Я насыпала в стакан 1 столовую ложку пищевой соды, прилила 50 мл яблочного уксуса. Наблюдала вспенивание массы. Это выделялся газ. Затем я аккуратно внесла в стакан горящую лучинку, и она потухла.
Вывод: при взаимодействии пищевой соды и яблочного уксуса образуется углекислый газ, который не поддерживает горение. Углекислый газ делает тесто более пышным и пористым.
2. Опыт с дрожжами. Чтобы сделать тесто пышным, можно использовать и дрожжи. Дрожжи – это микроскопические грибки, которые питаются сахаром и при этом выделяют углекислый газ.
В стакан с теплой водой насыпала немного сахара и дрожжей, оставила на 1 час. Я внесла в стакан горящую лучинку, и она потухла.
Вывод: в стакане присутствует углекислый газ, который образовался в результате жизнедеятельности дрожжей.
3.Взаимодействие мела с кислотой (лабораторный способ получения углекислого газа):
В фарфоровой чашке измельчила мел, насыпала его в пробирку и прилила раствор уксусной кислоты. Наблюдала вспенивание. Затем я аккуратно внесла в пробирку горящую лучинку, и она потухла.
Вывод: при взаимодействии мела с уксусной кислотой образовался углекислый газ, который не поддерживает горение.
4.Гниение яблока. Известно, что при гниении растительных остатков также образуется углекислый газ.
В банку положила кусочек яблока, закрыла крышкой и поставила в теплое место. Через 4 недели, когда яблоко стало гнить, я решила проверить, образовался ли там углекислый газ. Я внесла в стакан горящую лучинку, и она потухла.
Вывод: в банке присутствует углекислый газ, то есть он действительно образуется при гниении растительных остатков.
5. Получение углекислого газа при горении. При горении различных видов топлива также образуется этот газ. К топливу относятся дрова, торф, уголь, нефть, природный газ, гореть может спирт и другие вещества.
Зажгла 2 свечи, одну накрыла стаканом. Через некоторое время свеча под стаканом потухла, так как при горении образовался углекислый газ, который не поддерживает горение. Повторила опыт с 2 стаканами разных размеров. Под большим стаканом свеча горела дольше. При горении свечи образовывался углекислый газ, который и не давал гореть свече дальше.
6.Обнаружение углекислого газа известковой водой. Кроме горящей лучинки, подтвердить наличие углекислого газа может известковая вода.
А) Получила в пробирке углекислый газ при взаимодействии пищевой соды и уксусной кислоты, закрыла пробирку пробкой с газоотводной трубкой. Эту трубку поместила в пробирку с известковой водой. Через некоторое время известковая вода начала мутнеть.
Вывод: в пробирке образовалось вещество белого цвета - карбонат кальция.
Б) в пробирку с известковой водой поместила коктейльную трубочку, подышала в нее в течение нескольких минут и наблюдала ее помутнение.
2. Изучение свойств углекислого газа.
1.Определение кислой среды. Углекислый газ образует в воде слабую кислоту. Это можно проверить при помощи универсальной лакмусовой бумажки, которая в кислой среде приобретает красный цвет. Внесла влажный универсальный индикатор в пробирку с углекислым газом. Наблюдала покраснение индикатора.
Вывод: действительно, углекислый газ образует в воде кислоту.
2. Углекислый газ тяжелее воздуха. Это можно проверить с помощью опыта. Я насыпала соды в бутылку, прилила яблочный уксус. Наблюдала вспенивание. Затем я зажгла свечу. Наклоняя осторожно бутылку, я «вылила» углекислый газ на свечу. Свеча потухла. Таким образом, газ не улетучился и его можно переливать из одного сосуда в другой.
Проделав опыты, я убедилась, что углекислый газ образуется при гашении соды уксусом, взаимодействии мела с кислотой, при гниении, брожении и горении. Углекислый газ можно получить домашних условиях и в условиях школьной лаборатории и изучить его свойства. Он не поддерживает горение и делает мутной известковую воду. Газ тяжелее воздуха и его можно переливать из сосуда в сосуд. При взаимодействии с водой образует кислоту.
Таким образом, мои гипотезы подтвердились: я получила углекислый газ разными способами в домашних условиях и условиях школьной лаборатории, обнаружила его присутствие и изучила некоторые свойства.
ЗАКЛЮЧЕНИЕ
В процессе работы я узнала строение углекислого газа, его свойства, что он выделяется в тканях и переносится при помощи гемоглобина к легким, через которые выдыхается.
Углекислый газ в природе образуется из различных источников: дыхание животных и растений, вулканическая деятельность, разложение органических веществ, при горении (в том числе, лесные пожары) и гниение органики. Углекислый газ «хранится» в природе в виде углеродных соединений в полезных ископаемых: угле, нефти, торфе, известняке.
Углекислый газ атмосферы - основной источник углерода для растений.
Основными антропогенными источниками диоксида углерода являются:
промышленные выбросы, связанные с процессами сгорания, автомобильный транспорт.
В промышленности углекислый газ получается главным образом как побочный продукт обжига известняка, спиртового брожения и др. В промышленных количествах углекислота выделяется из дымовых газов.
В химических лабораториях либо пользуются готовыми баллонами с жидким углекислым газом, либо получают CO2 в специальных аппаратах.
В пищевой промышленности углекислота используется как консервант и разрыхлитель, для получения лимонада и газированной воды. Применяется в медицине, в системах пожаротушения и в огнетушителях, как подкормка аквариумных растений. Необходим в качестве защитной среды при сварке проволокой, в пневматическом оружии и в качестве источника энергии для двигателей в авиамоделировании. «Сухой лёд» используется в качестве хладагента в лабораторных исследованиях, в розничной торговле (хранение рыбы, мяса, мороженого), при ремонте оборудования, испытании в лабораториях деталей, приборов, механизмов.
При выполнении практической части я выяснила, что большинство учащихся знают о существовании углекислого газа, но знают о нем мало. Наибольшее количество человек знают, что он выделяется при дыхании живых организмов и что растения используют его в процессе фотосинтеза. Многие дети хотели бы узнать о нем что-то еще.
Проделав опыты, я убедилась, что углекислый газ образуется при гашении соды уксусом, взаимодействии мела с кислотой, при гниении, брожении и горении. Углекислый газ можно получить домашних условиях и в условиях школьной лаборатории и изучить его свойства. Он не поддерживает горение и делает мутной известковую воду. Газ тяжелее воздуха и его можно переливать из сосуда в сосуд. При взаимодействии с водой образует кислоту. Таким образом, мои гипотезы подтвердились.



























