

СДЕЛАЙТЕ СВОИ УРОКИ ЕЩЁ ЭФФЕКТИВНЕЕ, А ЖИЗНЬ СВОБОДНЕЕ
Благодаря готовым учебным материалам для работы в классе и дистанционно
Скидки до 50 % на комплекты
только до
Готовые ключевые этапы урока всегда будут у вас под рукой
Организационный момент
Проверка знаний
Объяснение материала
Закрепление изученного
Итоги урока

«Научно-методический анализ и методика изучения темы «Основы термодинамики»»
В работе рассмотрена методика изучения раздела «Основы термодинамики».
Объектом исследования работы является организация учебного процесса на различных этапах урока физики
Просмотр содержимого документа
««Научно-методический анализ и методика изучения темы «Основы термодинамики»»»
| МИНИСТЕРСТВО НАУКИ И ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ |
| Федеральное государственное бюджетное образовательное учреждение высшего образования |
| «Тихоокеанский государственный университет» |
Факультет естественных наук, математики и информационных технологий
Направление подготовки: 44.03.05 «Педагогическое образование (с двумя профилями подготовки)»
Профили: Информатика. Физика
Кафедра информатики и информационных технологий
Реферат
«Научно-методический анализ и методика изучения темы «Основы термодинамики»»
Выполнил студент гр. ПОИФ (б)-81
Горбачева А.О.
Проверил: Горбанева Л.В.
Хабаровск
2022
ОглавлениеВведение: 3
1. Методический анализ структуры и содержания темы «Основы термодинамики» 4
1.1. Основные задачи изучения темы «Основы термодинамики» 4
1.2. Структура темы «Основы термодинамики» 4
1.3. Формирование основных видов знаний 4
1.4. Формирование основных умений и навыков учебной работы учащихся при изучении темы. 5
1.5. Историческая справка и блок-схема 6
1.6. Особенности изучения содержания темы «Основы термодинамики» 8
1.6.1.Термодинамический метод изучения тепловых явлений 8
1.6.2. Внутренняя энергия. Количество теплоты. 10
1.6.3. Первый закон термодинамики 12
1.6.4. Работа тепловых двигателей 15
1.7 Возможности учебного материала для формирования научного мировоззрения и мышления учащихся, формирования политехнических знаний и умений. 17
1.8. Пути формирования познавательного интереса у учащихся и развитие их творческих способностей. 18
2. Методические разработки по теме «Основы термодинамики» 20
2.1. Урок изучения нового материала по теме «Основы термодинамики» 20
2.2. Урок систематизации и обобщения знаний. Нетрадиционный урок по теме «Основы термодинамики» 23
2.3. Урок решения задач по теме «Основы термодинамики» 29
2.4. Урок лабораторной работы по теме «Основы термодинамики» 34
2.5. Конспект урока контрольной работы по теме «Основы МКТ» 35
Заключение: 41
Список использованной литературы 42
Термодинамика – феноменологическая теория, которая изучат явления и свойства макроскопических тел, связанные с превращением энергии, и не рассматривает их внутреннее строение. Начало термодинамике как науке было положено в работе С.Карно «Размышления о движущей силе огня и о машинах, способных развивать эту силу» (1827), в которой рассматривались тепловые процессы, в частности вопросы изменения внутренней энергии при совершении работы и вопросы теории тепловых машин. В настоящее время термодинамика изучает превращение энергии не только в тепловых процессах, но и в электрических, магнитных, химических и др.
Термодинамика представляет собой науку о тепловых явлениях, в которых не учитывается молекулярное строение тел. Законы термодинамики и их применение будут рассмотрены в этом реферате.
Тема «Основы термодинамики» изучается в 10 классе. На её изучение отводится 21 учебный час.
Цель работы – проанализировать методику изучения раздела «Основы термодинамики».
Объектом исследования работы является организация учебного процесса на различных этапах урока физики.
Предмет исследования – методика обучения элементам термодинамики в средней школе.
Задачи данной работы:
рассказать и описать особенности данной темы;
разработать методический материал для применения в учебном процессе;
разработать дидактическое обеспечение некоторых отдельных уроков.
проанализировать и сделать выводы о структуре и содержании темы.
Образовательные: формирование знаний и умений применять законы термодинамики и объяснение тепловых процессов.
Развивающие: развивать творческое мышление, интеллектуальные способности учащихся; развивать умения наблюдать, анализировать, делать выводы.
Воспитательные: развивать коммуникативные качества, сформировать навыки работы в группах, развивать творчество.
1.2. Структура темы «Основы термодинамики»Структура:
Термодинамическая система.
Термодинамическое равновесие.
Внутренняя энергии, количество теплоты и работа в термодинамике.
Внутренняя энергия одноатомного идеального газа.
Первый закон термодинамики.
Применение первого закона термодинамики к изопроцессам в идеальном газе.
Адиабатный процесс.
Принцип действия тепловых машин.
Тепловые двигатели.
Коэффициент полезного действия тепловых двигателей.
Экологически проблемы использования тепловых двигателей.
В ходе изучения темы «Основы термодинамики» учащиеся должны получить теоретические знания и практические умения.
Структурные элементы знаний включают в себя основные понятия, физические законы, идеализированные объекты и модели, основные физические величины.
Основные понятия:
Термодинамическая система — совокупность макроскопических тел, которые могут взаимодействовать между собой и с другими телами (внешней средой), обмениваться с ними энергией и веществом;
Адиабатный процесс — термодинамический процесс в макроскопической системе, при котором система не обменивается теплотой с окружающим пространством;
Нагреватель — устройство, от которого рабочее тело получает энергию, часть которой идет на совершение работы;
Рабочее тело — это вещество, посредством которого происходит взаимное превращение одного вида энергии в другой;
Холодильник — тело, поглощающее часть энергии рабочего тела;
КПД теплового двигателя — отношение работы, совершаемой двигателем, к количеству теплоты, полученной от нагревателя;
Основные законы:
Первый закон термодинамики
Идеализированные объекты:
Идеальный газ;
Макросистема в тепловом равновесии;
Основные физические величины:
Внутренняя энергия;
КПД;
Количество теплоты;
Общий уровень умений. Учащийся должен:
Иметь представление:
О термодинамическом равновесии;
О необратимости процессов в природе;
О роли тепловых машин в жизни человека и об экологических проблемах их использования;
Знать и понимать:
Смысл физических понятий: термодинамическая система, адиабатный процесс, нагреватель, рабочее тело, холодильник, КПД теплового двигателя
Смысл физических законов: первого закона термодинамики;
Уметь:
Применять первый закон термодинамики к процессам в идеальном газе;
Владеть:
Практическими умениям: решать качественные, графические, расчётные задачи на определение работы, количества теплоты и изменения внутренней энергии идеального газа, КПД тепловых двигателей с использованием первого закона термодинамики, формулы КПД.
До 50-х годов XIX века наука рассматривала теплоту как особое невесомое, неуничтожимое и несоздаваемое вещество, которое имело название теплород. М.В.Ломоносов был одним из первых, кто опроверг эту теорию. В своей работе "Размышление о причинах теплоты и холода", изданной в 1774 г., он писал, что теплота является формой движения мельчайших частиц тела, заложив тем самым основы механической теории теплоты. М.В.Ломоносов один из первых высказал идею закона сохранения энергии, В его формулировке этого закона еще не содержатся количественные соотношения, но, несмотря на это, отчетливо и полно определяется сущность закона сохранения и превращения энергии.
Лишь столетие спустя этот закон, благодаря работам Майера, Гельмгольца, Джоуля получил всеобщее признание. В 1842 году появилась работа естествоиспытателя Майера "Размышления о силах неживой природы". Его формулировка первого закона термодинамики в основном была философски умозрительной. В 1847 году была издана монография немецкого врача Гельмгольца "О сохранении силы", где подчеркивается общее значение первого начала как закона сохранения энергии, дается его математическая формулировка и приложение к технике. В 1856 году Джоуль экспериментально доказал существование этого закона.
В 1824 году появился труд французского инженера Сади Карно "Размышления о движущей силе огня и о машинах, способных развивать эту силу”, в котором были заложены основы термодинамики. В этой работе он указал причины несовершенства тепловых машин, пути повышения их коэффициента полезного действия (кпд), сформулировал второй закон термодинамики, идеальный цикл тепловых машин (цикл Карно) и другие важные положения термодинамики.
В 1906 г. Нернст сформулировал третье начало термодинамики, в котором предположил, что с приближением абсолютной температуры к нулю интенсивность теплового движения и энтропия стремятся к нулю. Принцип недостижимости абсолютного нуля температур - одно из следствий известной тепловой теоремы Нернста.
Существует еще понятие так называемого нулевого начала термодинамики. Изучая явления в рамках классической термодинамики, как правило, отвлекаются от характера молекулярного и атомного строения вещества. При исследовании явлений обращают внимание исключительно на макроскопические свойства системы, которые оцениваются по опытным данным измерения макроскопическими приборами: термометрами, калориметрами, манометрами и т.д. Поэтому классическая термодинамика является феноменологической наукой. Таким образом, в классической термодинамике отвлекаются от движения микрочастиц тела и рассматривают лишь результат этого движения, который есть не что иное, как температура тела. Это и есть нулевое начало термодинамики. Оно формулируется в виде следующей аксиомы: все тела при тепловом равновесии обладают температурой. Нулевое начало является исходным положением термодинамики, так как тепловое движение происходит во всех телах. Оно неуничтожимо, как неуничтожимо всякое движение в природе.
В конце XIX века Л.Больцманом и У.Гиббсом были заложены основы статистической термодинамики. В отличие от классической термодинамики она позволяет вычислить макроскопические характеристики по данным о состоянии микрочастиц тела - их расположению, скоростях, энергии. У.Гиббс внес существенный вклад и в классическую термодинамику, разработав метод потенциалов, установив правило фаз и др.
После создания фундамента термодинамического метода началась разработка его приложений и, прежде всего, к теории тепловых машин. Большое значение имело введенное Ж.Гюи и А.Стодолой понятие работоспособности теплоты, или максимальной технической работы, которую можно получить от имеющегося количества теплоты в заданном интервале температур. В 1956 году Р.Рант дал этой величине название "эксергия", В отличие от энтропии, всегда возрастающей в реальных процессах, в отличие от энергии, количество которой строго сохраняется (согласно первому закону термодинамики), эксергия - запас работоспособности или это то количество полезной работы, которое можно получить от имеющейся теплоты в заданном интервале температур.

В основе термодинамического метода лежат следующие понятия: термодинамическая система, состояние термодинамической системы, термодинамические параметры состояния и равновесное состояние.
Термодинамической системой называют тело или совокупность тел, обменивающихся энергией между собой и с внешними телами. Если обмена энергией с внешними телами нет, то система является изолированной. Понятие изолированной системы – абстракция, все реальные системы можно считать изолированными с той или иной степенью точности.
С понятием состояния учащиеся уже знакомы из курса механики. Они знают, что механическое состояние системы определяется совокупностью величин, характеризующих свойства системы и называемых параметрами состояния. К ним в механике относят координату, импульс и т.д. Состояние термодинамической системы также определяется рядом параметров (термодинамических). Термодинамическими параметрами состояния являются температура, объём, давление и т.д.
Число параметров, характеризующих состояние системы, зависит от свойств системы и от условий, в которых она находится. Трёх выше названных параметров достаточно для описания изолированной системы «идеальный газ», но если рассматривать, например, неоднородный газ, то необходимо учитывать ещё и концентрацию.
Параметры могут быть внешними и внутренними, Температура и давление, например, зависят только от состояния самой системы и не связаны с внешними условиями. Объём же зависит от внешних условий. Некоторые параметры состояния, например объём, обладают свойством аддитивности, другие, такие, как давление и температура, не обладают. При изменении состояния системы меняются и её параметры. Однако для целого ряда термодинамических систем между параметрами можно установить функциональную зависимость. Уравнение, выражающее эту зависимость, называют уравнением состояния (для системы «идеальный газ» это уравнение 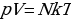 ).
).
Состояние системы может быть равновесным и неравновесным. Равновесное состояние характеризуется неизменностью всех термодинамических параметров системы во времени и одинаковостью в пространстве в отсутствие внешних воздействий. Термодинамика изучает в основном равновесные состояния. Если система находится в неравновесном состоянии (т.е. параметры ее с течением времени меняются), то постепенно она придёт в состояние равновесия и её параметры выровняются во всех частях системы. Изолированная термодинамическая система с течением времени всегда приходит в равновесное состояние, из которого не может самопроизвольно выйти. Это утверждение составляет сущность закона термодинамического равновесия, являющегося одним из важнейших опытных законов термодинамики. Иногда закон термодинамического равновесия делает возможным измерение температуры системы.
Целесообразно подчеркнуть, что уравнение состояния идеального газа и частные газовые законы справедливы лишь для равновесных процессов. К неравновесным процессам они неприменимы, так как в этом случае параметры состояния различны для разных частей системы. Из одного равновесного состояния в другое система может перейти под влияние внешнего воздействия.
Такой переход в термодинамике называют процессом. Если во время процесса система остаётся равновесной, то и процесс называется равновесным. Равновесный процесс осуществляется тогда, когда время релаксации (время перехода системы из неравновесного состояния в равновесное) много меньше времени осуществления процесса. В этом случае систему в каждый момент времени с той или иной степенью точности считают равновесной, или статической. Поскольку в действительности отклонения от статичности имеются (иначе нельзя было бы осуществить процесс), то состояние системы называют квазистатическим, а процесс – квазистатическим процессом. Следует иметь ввиду, что на графике можно изобразить только равновесное (квазистатическое) состояние или равновесный (квазистатический) процесс.
Существуют различные формы энергии. Каждая форма присуща определённому типу движения материи, например, механическому движению соответствует механическая энергия, движению электрических зарядов – энергия электрического и магнитного полей и т.д. С тепловым движением связана внутренняя энергия.
Понятие «внутренняя энергия» возникло, развилось в науке в 19 в. в связи установлением закона сохранения энергии и благодаря успехам, достигнутым в области молекулярно-кинетической теории. Этот термин не сразу получил правильную трактовку. Во второй половине 19 в. для обозначения внутренней энергии использовали термины: «механическая энергия тела в данном состоянии», «функция действия», «энергия тела» и др. В слове «теплота» очень долго объединялись три понятия: 1) получаемое или отдаваемое телом количество теплоты; 2) внутренняя энергия; 3) тепловое движение. Такое смешение методически не является правомерным, так как в этом случае первый закон термодинамики превращается в бессмыслицу. Именно введение понятия внутренней энергии позволило распространить закон сохранения энергии на тепловые процессы: при наличии диссипативных сил убыль механической энергии системы равна увеличению её внутренней энергии.
Под внутренней энергией тела в термодинамике понимают энергию, зависящую только от его внутреннего состояния и не связанную с движением относительно других тел. Внутренняя энергия является однозначной функцией состояния тела, которое определяется рядом параметров (давление, объём, температура). Это означает, что в каждом состоянии (или система) обладает лишь одним значением внутренней энергии. Это положение можно доказать на примере следующего рассуждения: если бы одному и тому же состоянию соответствовали два значения внутренней энергии 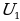 и
и 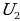 , то можно было бы отнять от системы разность энергий (
, то можно было бы отнять от системы разность энергий (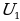 -
-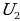 ), а состояние бы её не изменилось. Такая система могла бы служить источником энергии, не претерпевая никаких изменений, что противоречит первому закону термодинамики (закону сохранения энергии).
), а состояние бы её не изменилось. Такая система могла бы служить источником энергии, не претерпевая никаких изменений, что противоречит первому закону термодинамики (закону сохранения энергии).
Следовательно, изменение внутренней энергии системы при переходе из одного состояния в другое не зависит от этого перехода, т.е. внутренняя энергия является функцией состояния системы, а не функцией процесса.
Термодинамическая трактовка понятия внутренней энергии не полностью раскрывает его смысл. Для более полного определения этого понятия необходимо рассмотреть его молекулярно-кинетическую трактовку.
В современной физике под внутренней энергией понимают сумму энергий хаотического движения и взаимодействия молекул и энергии движения и взаимосвязи частиц, составляющих молекулы (энергия колебательного движения частиц, энергия электронных оболочек атомов, внутриядерная энергия и т.д.). Поскольку в термодинамике изучают тепловые процессы, происходящие при не слишком высоких температурах, изменение внутренней энергии происходит лишь за счёт изменения двух первых её составляющих. Поэтому при рассмотрении тепловых явлений под внутренней энергией можно понимать сумму кинетической энергии хаотического движения молекул и потенциальной энергии их взаимодействия:
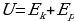 .
.
Как правило, нас интересует не само значение внутренней энергии, а её изменение, поэтому начало отсчёта внутренней энергии выбирают произвольно.
Внутренняя энергия может изменяться под действием каких-либо внешних факторов, либо при совершении работы, либо в процессе теплопередачи. В первом случае мерой изменения внутренней энергии является работа, во втором количество переданного теплоты. Работа, так же как и количество теплоты, зависит не только от конечного и начального состояния системы, но и от того, при каком процессе происходило изменение состояния. Количество теплоты и работа характеризуют процесс изменения состояния и не являются функциями состояния.
Следует разъяснить школьникам, что работа и теплопередача – неравноценные способы изменения внутренней энергии. Работа – изменение энергии упорядоченного движения, совершение работы может привести к изменению как механической, так и внутренней энергии. При теплопередаче изменяется энергия хаотического движения частиц системы, а это ведёт лишь к изменению её внутренней энергии. Впервые с понятием внутренней энергии учащихся знакомят в базовом курсе. В старших классах понятие внутренней энергии получает дальнейшее развитие и обобщение на основе молекулярно-кинетических представлений. В частности, внутреннюю энергию рассматривают как величину, зависящую от состояния тела (или системы), определяемого термодинамическими параметрами (p,V,T). Подчеркивают мысль: внутренняя энергия является однозначной функцией состояния.
Развитие и усугубление понятия внутренней энергии идёт по пути его применения к идеальному газу. Если в рамках термодинамики нас интересует изменение внутренней энергии, то для идеального газа можно вычислить значение внутренней энергии в данном состоянии:
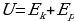 ;
; 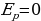 ;
; 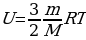 (для одноатомного газа).
(для одноатомного газа).
Внутренняя энергия идеального газа зависит только от его температуры.
Используя первый закон термодинамики, показывают, как изменяется внутренняя энергия идеального газа при различных изопроцессах, и объясняют характер этого изменения с молекулярно-кинетической точки зрения
Понятие количества теплоты и калориметрические расчёты достаточно полно изучают в базовом курсе физики, поэтому в старших классах, этот материал лишь повторяют.
1.6.3. Первый закон термодинамикиИзучение первого закона термодинамики продолжает формировать представления старшеклассников о фундаментальном естественнонаучном принципе – принципе сохранения энергии.
Открытие первого закона термодинамики относится к числу трех крупнейших события 19 в., наряду с открытием клетки и созданием теории Дарвина. В школьном курсе физики первый закон термодинамики изучают как обобщение большого числа опытных данных, установивших соотношение между количеством теплоты, получаемых за счёт работы, и совершённой работой.
Прежде чем приступить к изучению первого закона термодинамики, целесообразно повторить закон сохранения энергии в механических процессах, при этом особое внимание уделяют обсуждению вопроса о том, что механическая энергия сохраняется в замкнутых консервативных системах. Если система не является консервативной, то её механическая энергия не сохраняется, она частично или полностью превращается во внутреннюю энергию, но при этом сохраняется полная энергия системы.
Далее рассматривают, какими способами можно изменить внутреннюю энергию системы. Этот материал изучали в базовом курсе физики, поэтому здесь его повторяют и обобщают. В результате школьников подводят к выводу: внутреннюю энергию можно изменить либо в процессе теплопередачи, либо при совершении работы, либо при совершении работы и при теплопередаче одновременно.
Обсуждают вопрос о мерах измерения внутренней энергии при том или ином процессе. Учащиеся делают вывод: мерой изменения внутренней энергии в процессе совершения работы является работа, а мерой изменения внутренней энергии в процессе теплопередачи – количество теплоты. Здесь же целесообразно повторить вопрос о знаках этих величин. Условились считать количество теплоты положительным (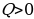 ), если количество теплоты сообщается системе, и отрицательным (
), если количество теплоты сообщается системе, и отрицательным (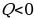 ), если количество теплоты отдано системой.
), если количество теплоты отдано системой.
Работу 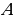 , совершаемую внешними силами над системой, считают положительной (
, совершаемую внешними силами над системой, считают положительной (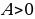 ), если газ сжимается: работа внешних сил отрицательна, если газ расширяется (
), если газ сжимается: работа внешних сил отрицательна, если газ расширяется (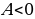 ).
).
Рассмотрев ряд примеров, делают вывод: изменение внутренней энергии системы равно сумме количества теплоты, переданного системе, и работе внешних сил над системой:
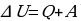 , где
, где 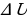 – изменение внутренней энергии, равное разности значений внутренней энергии в конечном и в начальном состояниях. Эту формулу можно записать иначе:
– изменение внутренней энергии, равное разности значений внутренней энергии в конечном и в начальном состояниях. Эту формулу можно записать иначе:
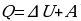 , (
, (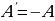 ).
).
Количество теплоты, сообщённое системе, идёт на увеличение её внутренней энергии и на совершение системой работы над внешними телами.
Анализируя формулу первого закона термодинамики, целесообразно ещё раз подчеркнуть, что внутренняя энергия характеризует состояние системы независимо от способа изменения этого состояния, так как внутренняя энергия системы однозначно определяется параметрами: объёмом 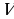 и температурой
и температурой 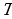 . Работа и количество теплоты характеризуют процесс изменения состояния. При одинаковом изменении состояния эти величины различны (в зависимости от способа перехода системы из одного состояния в другое), хотя сумма их будет одна и та же.
. Работа и количество теплоты характеризуют процесс изменения состояния. При одинаковом изменении состояния эти величины различны (в зависимости от способа перехода системы из одного состояния в другое), хотя сумма их будет одна и та же.
После изучения первого закона термодинамики целесообразно разобрать со школьникам ряд упражнений на применение его к конкретным процессам. Например, описать энергетически:
1) Теплообмен между телами в калориметре; 2) нагревание воды на спиртовке; 3) нагревание при ударе.
В первом случае система замкнутая и теплоизолированная (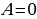 ,
, 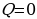 ,
, 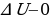 ). Внутренняя энергия системы не изменяется. Во втором случае система замкнутая (
). Внутренняя энергия системы не изменяется. Во втором случае система замкнутая (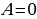 ,
, 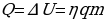 ): изменение внутренней энергии равно количеству теплоты. В третьем случае система теплоизолированная (
): изменение внутренней энергии равно количеству теплоты. В третьем случае система теплоизолированная (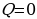 ,
, 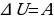 ); изменение внутренней энергии равно совершённой работе.
); изменение внутренней энергии равно совершённой работе.
Далее целесообразно рассмотреть примеры применения первого закона термодинамики к изопроцессам в идеальных газах. При изобарном нагревании (рис 1) количество теплоты, переданное системе, идёт на увеличение её внутренней энергии и на совершение системой работы расширения при постоянном давлении. Работа расширения положительна (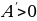 ) и равна
) и равна 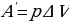 . Из рис.1 видно, что работа численно равна площади заштрихованного прямоугольника, Увеличение внутренней энергии при данном процессе равно:
. Из рис.1 видно, что работа численно равна площади заштрихованного прямоугольника, Увеличение внутренней энергии при данном процессе равно:
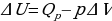 .
.
При изобарном охлаждении внутренняя энергия системы уменьшается. Количество теплоты, которое система отдаёт равно изменению внутренней энергии системы и работе по сжатию газа. В этом случае и количество теплоты, и работа системы отрицательны. Внутренняя энергия системы уменьшается.
П ри изохорном процессе (рис.2) работа равно нулю, так как объём газа не меняется (
ри изохорном процессе (рис.2) работа равно нулю, так как объём газа не меняется (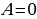 ), поэтому изменение внутренней энергии равно количеству теплоты. При нагревании количество теплоты
), поэтому изменение внутренней энергии равно количеству теплоты. При нагревании количество теплоты 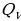 и изменение внутренней энергии положительны, т.е. внутренняя энергия увеличивается, при охлаждении – внутренняя энергия уменьшается.
и изменение внутренней энергии положительны, т.е. внутренняя энергия увеличивается, при охлаждении – внутренняя энергия уменьшается.
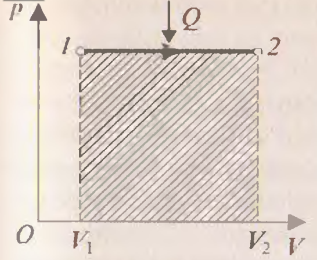
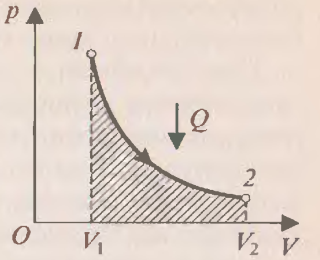
Рис.1
Рис.2
Рис.3
Рис.4
Рис.4
При изотермическом процессе температура постоянна, поэтому 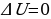 , т.е. внутренняя энергия не изменяется. Если система получает некоторое количество теплоты, то оно идёт на работу, совершаемую газом при расширении. Работа численно равна площади заштрихованной фигуры (рис.3).
, т.е. внутренняя энергия не изменяется. Если система получает некоторое количество теплоты, то оно идёт на работу, совершаемую газом при расширении. Работа численно равна площади заштрихованной фигуры (рис.3).
При адиабатическом процессе (рис.4) не происходит теплообмена с окружающей средой, поэтому количество теплоты 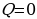 . Следовательно, внутренняя энергия изменяется только за счёт совершения работы. При этом при расширении система совершает положительную работу; внутренняя энергия системы уменьшается.
. Следовательно, внутренняя энергия изменяется только за счёт совершения работы. При этом при расширении система совершает положительную работу; внутренняя энергия системы уменьшается.
При сжатии внешние силы совершают работу, а газ отрицательную; внутренняя энергия увеличивается, газ нагревается.
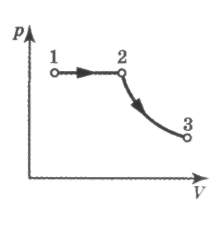
Из графиков адиабатического и изотермического процессов, изображённых на рис.4, видно, что при адиабатном расширении совершается работа меньшая, чем при изотермическом, а при адиабатном сжатии – большая, чем при изотермическом. Полезно так же с учащимися решать графические задачи, требующие выяснения знаков величин, входящих в формулу первого закона термодинамики, например такую: на рис.5 изображён график зависимости давления от температуры. Как изменяется при этом изменении состояния газа его внутренняя энергия, совершается ли работа, получает или отдаёт система теплоту?
П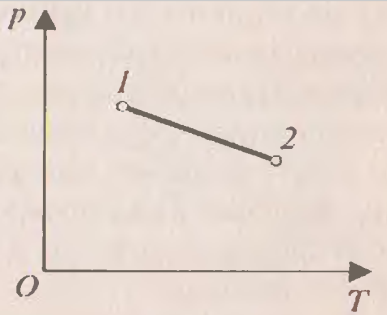
Рис.5
ри переходе газа из состояния 1 в состояние 2 давление уменьшается, температура и внутренняя энергия газа увеличиваются. Объём газа также увеличивается (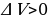 ), следовательно, газ совершает работу расширения, являющуюся положительной. Количество теплоты также положительно (
), следовательно, газ совершает работу расширения, являющуюся положительной. Количество теплоты также положительно (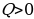 ), следовательно, газ получает некоторое количество теплоты.
), следовательно, газ получает некоторое количество теплоты. Усвоение первого закона термодинамики способствует и решение вычислительных задач.
Рассмотрение применения первого начала термодинамики к изопроцессам создает основу для понимания старшеклассниками принципов работы тепловых двигателей.
1.6.4. Работа тепловых двигателейС тепловыми двигателями учащихся знакомят впервые в базовой школе, когда рассматривают общий принцип работы тепловых двигателей (совершение полезной работы за счёт внутренней энергии рабочего тела), изучают двигатель внутреннего сгорания и паровую турбину, а также вводят понятии о КПД тепловых двигателей. Основное внимание уделяют конструкции и принципам работы названных выше двигателей. В курсе физики старших классов рассматривают энергетические процессы, происходящие при работе тепловых двигателей.
При изучении принципов работы тепловых двигателей, прежде всего, вводят понятие необратимости, формируют представление о втором законе термодинамики. Понятие необратимости раскрывают с помощью примеров: рассматривают абсолютно упругий удар, как пример обратимого явления, уточнив, что такой удар является идеализацией. Затем обращаются к таким явлениям, как пластическая деформация, диффузия и другие и вводят понятие необратимости процесса как такого, обратный которому самопроизвольно протекать не может. Далее подводят учащихся к формулировке второго закона термодинамики, говорят о том, что осуществить обратный процесс можно только в том случае, ели он будет являться частью другого процесса, связанного с затратами энергии. Так, можно восстановить форму тела при пластической деформации, но для этого необходимы внешние силы и затраты энергии.
Изучение принципов работы тепловых двигателей можно построить по следующему плану:
- обсуждение вопроса о том, что механическая работа может быть совершена за счёт внутренней энергии; устройство, в котором это происходит, называют тепловым двигателем;
- обсуждение вопроса о том, что для непрерывной работы двигатель необходимо возвращать в первоначальное состояние, т.е. он должен быть циклическим;
- обсуждение вопроса о том, что для получения положительной работы в первоначальное состояние двигатель должен возвращаться при более низкой температуре, следовательно, он должен иметь нагреватель, рабочее тело и холодильник.
Далее учащимся говорят, что рабочее тело (им может быть пар, газ или специальная смесь) получается некоторое количество теплоты 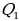 от нагревателя и расширяется. При расширении рабочее тело совершает работу. При сжатии рабочее тело отдаёт количество теплоты
от нагревателя и расширяется. При расширении рабочее тело совершает работу. При сжатии рабочее тело отдаёт количество теплоты 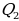 холодильнику. Температуры холодильника и нагревателя поддерживают постоянными, при этом температура нагревателя всегда выше температуры холодильника (
холодильнику. Температуры холодильника и нагревателя поддерживают постоянными, при этом температура нагревателя всегда выше температуры холодильника (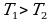 ).
).
После этого целесообразно рассмотреть принцип работы идеальной тепловой машины Карно, рабочим телом в которой является идеальный газ. При расширении газа во время его контакта с нагревателем температуру поддерживают постоянной, во время сжатия и контакта с холодильником температура также постоянна, следовательно, расширение и сжатие происходит изотермически (на рис.6 соответственно изотермы 1-2 и 3-4). Но если температура расширения больше температуры сжатия, то необходимо произвести процессы, при которых температура меняется от 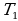 до
до 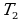 , а затем опять от
, а затем опять от 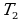 до
до 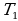 . В принципе это осуществимо при изобарном, изохорном или адиабатном процессах. Наиболее целесообразным является условием максимальной работы (на рис.6 графики 2-3 и 4-1 – адиабаты). Полезная работа численно равная площади заштрихованной фигуры.
. В принципе это осуществимо при изобарном, изохорном или адиабатном процессах. Наиболее целесообразным является условием максимальной работы (на рис.6 графики 2-3 и 4-1 – адиабаты). Полезная работа численно равная площади заштрихованной фигуры.
В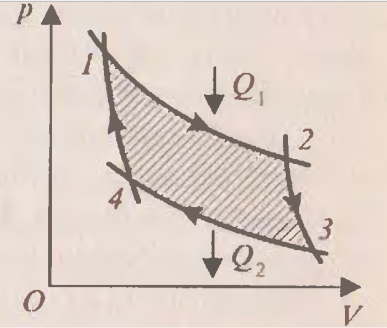 ажным является вопрос о коэффициенте полезного действия. Как известно КПД – это отношение полезной работы к количеству теплоты, полученному от нагревателя:
ажным является вопрос о коэффициенте полезного действия. Как известно КПД – это отношение полезной работы к количеству теплоты, полученному от нагревателя:
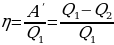
Рис.6
.Задача повышения КПД – одна из основных технических задач. Она связана, прежде всего, с созданием материалов, имеющих достаточную прочность при высоких температурах. В настоящее время температурные границы рабочего тела составляют 303 – 853 K. КПД идеальной машины, работающей по циклу Карно, при таких значениях температур равен 65%. Однако с учётом потерь КПД примерно равен 40%. Необходимо, чтобы школьники поняли принципиальное отличие решения задачи КПД тепловых двигателей от решения этой же задачи применительно к механическим и электрическим двигателям. КПД последних стремятся приблизить к 100%, а КПД тепловых двигателей к КПД идеальной машины Карно, работающей при тех же температурах холодильника и нагревателя. Поэтому повышение КПД тепловых двигателей связано с повышением температуры нагревателя и понижением температуры холодильника.
Полезно привести значения мощностей и КПД некоторых тепловых двигателей. Например, карбюраторный двигатель внутреннего сгорания, установленный на автомобиле «Волга ГАЗ-24» имеет мощность 70кВт, КПД около 25%; мощность паровых турбин, установленных на электростанциях, составляет 500-800 МВт, а КПД 40%.
В заключение изучения рассматриваемой темы обращают внимание учащихся на значение развития теплоэнергетики для народного хозяйства, в частности рассказывают о той экономии, которую даёт страну развитие теплоэлектроцентралей.
1.7 Возможности учебного материала для формирования научного мировоззрения и мышления учащихся, формирования политехнических знаний и умений.Раздел «Молекулярная физика» дает возможность продолжить знакомство учащихся с экспериментальным методом исследования, который находит отражение в фундаментальных опытах (броуновское движение, опыт Штерна) и опытах, иллюстрирующих газовые законы (опыт Бойля, Шарля и пр.).
Мировоззренческое значение раздела «Молекулярная физика» трудно переоценить. При его изучении происходит углубление понятия материи. Молекулы и атомы являются вещественной формой материи, объективно существующей в окружающем мире. Они обладают массой, импульсом, энергией. Являясь видом материи, молекулы и атомы имеют присущие материи свойства, одно из которых – движение. Молекулы и атомы участвуют в особом движении, называемом тепловым, которое отличается от простейшего механического движения большой совокупностью участвующих в нем частиц и хаотичностью. Тепловое движение описывается статистическими законами. В связи с этим важно показать школьникам различие между статистическими и динамическими закономерностями, соотношение между ними и обратить внимание учащихся на отражение в этих закономерностях категорий необходимого и случайного. Таким образом, изучение раздела «Молекулярная физика» создает базу для формирования научного мировоззрения учащихся.
Большое воспитательное значение имеет рассмотрение истории развития термодинамики, которая представляет собой пример того, как в процессе развития науки, ее методов человечество переходило от незнания к знанию, как в борьбе идей и мнений рождалось истинное знание.
Раздел «Молекулярная физика» дает прекрасную возможность для демонстрации дедуктивного метода изучения явлений природы. Применение дедукции в преподавании вносит свой вклад в развитие абстрактного мышления учащихся.
Велико политехническое значение этого раздела курса физики. Достижения молекулярной физики являются научной основой такой отрасли промышленности, как материаловедение. Знание внутреннего строения тел позволяет создавать материалы с заранее заданными свойствами, целенаправленно работать над повышением твердости, термостойкости, теплопроводности металлов и сплавов.
Изучение тепловых явлений дает возможность ознакомить учащихся с основами теплоэнергетики - отрасли, занимающей в нашей стране первое место в обеспечении энергией нужд промышленности и быта. Связь теоретических знаний с их практическим применением можно реализовать при применении законов термодинамики к рассмотрению принципов работы тепловых двигателей, играющих огромную роль в экономике страны.
1.8. Пути формирования познавательного интереса у учащихся и развитие их творческих способностей.Существует множество различных методов формирования интереса учащихся к учебному предмету.
Одним из методов является организация межпредметных связей на уроке. Этот метод имеет двухстороннюю направленность. С одной стороны, учащиеся, интересующиеся физикой, должны проявлять интерес и к другим предметам. Но этот метод также позволяет учащимся со стойким познавательным интересом к другим предметам находить для себя интерес и на уроках физики.
Термодинамика рассматривает общие закономерности превращения энергии в форме тепла и работы между телами. В открытых биологических системах постоянно происходит процесс обмена энергией с внешней средой. Внутренние метаболические процессы также сопровождаются превращениями одних форм энергии в другие. Достаточно напомнить о механических процессах, трансформации энергии кванта света в энергию электронного возбуждения молекул пигментов, а затем в энергию химических связей восстановленных соединений в фотосинтезе. Другой пример - преобразование энергии электрохимического трансмембранного потенциала в энергию АТФ в биологических мембранах.
Сейчас мы понимаем, что механизмы трансформации энергии в биоструктурах связаны с конформационными превращениями особых макромолекулярных комплексов, таких, как реакционные центры фотосинтеза, Н-АТФаза хлоропластов и митохондрий, бактериородопсин. Однако помимо выяснения детального характера происходящих здесь процессов особый интерес представляют общие характеристики эффективности преобразования энергии в таких макромолекулярных машинах
Тема урока: «Применение первого закона термодинамики к изопроцессам в газе»
Цели урока:
Сформировать умение использовать первый закон термодинамики для описания газовых процессов;
Ввести понятие - адиабатный процесс.
Рассмотреть теплоемкость газа для каждого процесса
План урока:
| 1 | Оргмомент | 1 мин |
|
| 2 | Актуализация знаний | 5 мин | Постановка цели |
| 3 | Изучение нового | 30 мин | Работа по группам, лекция |
| 4 | Рефлексия | 3 мин | опрос |
| 5 | Задание на дом | 1 мин |
|
Оборудование:
Компьютер, проектор мультимедийный – для учителя;
Ноутбуки с OMS – плеером -4 шт – для учащихся
Содержание:
Актуализация знаний:
Что называют изопроцессом?
Что называют изотермическим процессом?
Что называют изохорным процессом?
Что называют изобарным процессом?
Формула изменения внутренней энергии газа
Формула работы для газа
Первый закон термодинамики
Изучение нового:
Работу построим следующим образом: разделимся на 4 группы, каждая группа изучает один из процессов и рассматривает закон термодинамики применимо к этому процессу.
1 группа – адиабатный
2 группа – изотермический
3 группа – изохорный
4 группа – изобарный
| Изопроцесс | Постоянный параметр | Переменные параметры | Математическая запись закона | 1 закон термодинамики | Теплоемкость |
| Изотермический | Т | p, V | pV = const | Q=A |
|
| Изобарный | P | T, V | V/T= const | Q= ΔU+A A= ΔU+Q |
|
| Изохорный | V | p, T | p/T= const | ΔU=Q |
|
| Адиабатный | Q=0 | P,V |
| ΔU=A |
|
Обратите внимание, адиабата идет обязательно круче изотермы. Ведь при адиабатном процессе давление газа уменьшается не только за счет увеличения объема, как при изотермическом, но и за счет его температуры.
Если нагревать тело при постоянном давлении, то оно будет расширяться и совершать работу. Для нагревания тела на 1 К при постоянном давлении ему нужно передать большее количество теплоты, чем при таком же нагревании при постоянном объеме.
Как же определить количество теплоты, получаемое телом при нагревании или отданное при охлаждении?
Из 8 класса известно, сто Q=cmΔT, где с – удельная теплоемкость вещества. Теплоемкость зависит не только от свойств вещества, но и от процесса, при котором осуществляется теплопередача.
Теплоемкость газа при постоянном объеме
Найдем молярную теплоемкость газа при постоянном объеме. Согласно определению теплоемкости 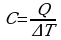 , где ΔT — изменение температуры. Если процесс происходит при постоянном объеме, то эту теплоемкость обозначим через Cv. Тогда QV = CVΔT.
, где ΔT — изменение температуры. Если процесс происходит при постоянном объеме, то эту теплоемкость обозначим через Cv. Тогда QV = CVΔT.
При постоянном объеме работа не совершается. Поэтому первый закон термодинамики запишется так: CVΔT = ΔU.
Изменение энергии одного моля достаточно разреженного (идеального) одноатомного газа равно 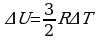 . Следовательно, молярная теплоемкость при постоянном объеме одноатомного газа равна
. Следовательно, молярная теплоемкость при постоянном объеме одноатомного газа равна 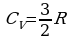 .
.
Теплоемкость газа при постоянном давлении
Согласно определению теплоемкости при постоянном давлении Ср Qp = СрΔТ.
Работа, которую совершит 1 моль идеального газа, расширяющегося при постоянном давлении, равна A' = RΔT.
Это следует из выражения для работы газа при постоянном давлении А' = pΔV и уравнения состояния (для одного моля) идеального газа. pV = RT.
Внутренняя энергия идеального газа от объема не зависит. Поэтому и при постоянном давлении изменение внутренней энергии ΔU = CVΔT, как и при постоянном объеме. Применяя первый закон термодинамики, получим СрΔТ = CVΔT + RΔT.
Следовательно, молярные теплоемкости идеального газа связаны соотношением Cp = Cy + R.
Впервые эта формула была получена Р. Майером и носит его имя.
В случае идеального одноатомного газа 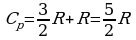
Теплоемкость идеального газа при изотермическом процессе
Можно формально ввести понятие теплоемкости и при изотермическом процессе. Так как при этом процессе внутренняя энергия идеального газа не меняется, какое бы количество теплоты ему ни было передано, то теплоемкость бесконечна.
Теплоемкость при адиабатном процессе равна 0, т.к. Q=0.
Сегодня на уроке мы изучили новый изопроцесс – адиабатный, научились использовать первый закон термодинамики для описания газовых процессов. На следующем уроке мы будем решать задачи на применение первого закона термодинамики.
Чтобы понять, на сколько интересен и полезен материал, который мы изучили на уроке, выполните задание:
Оцените сегодняшний урок: 0 –нет, 1- да.
Вам было интересно на уроке?
Вы узнали, что-то новое?
Был ли доступен изучавшийся материал?
Вы его поняли?
Готовы ли вы работать на материалом на следующем уроке?
Количество баллов
Ваша оценка урока.
Спасибо за урок.
Оценки за урок.
Цели урока: повторение и обобщение знаний учащихся по теме «Основы МКТ», используя их творческий потенциал; развитие учебно-познавательных потребностей учащихся при обучении физике.
Тип урока: нетрадиционный урок в форме игры.
Содержание урока.
1. Вступительное слово учителя.
Наш нетрадиционный урок мне хочется начать словами Д. Хевеши: «Мыслящий ум не чувствует себя счастливым, пока ему не удастся связать воедино разрозненные факты, им наблюдаемые».
Связать воедино разрозненные факты, объяснить их, получить новые, найти им применение, - вот цель любой научной теории, в том числе и МКТ, которая является одной из фундаментальных научных теорий, утверждающая древнейшую научную идею – идею о дискретности вещества. Она служит основой для объяснения многих физических, химических, биологических явлений; без неё не может обойтись ни одна из естественных наук. О значении этой теории своеобразно сказал известный американский физик Ричард Фейнман. Он задал вопрос: какое утверждение, составленное из наименьшего количества слов, содержало бы наибольшую информацию для передачи грядущим поколениям, если бы в результате какой-то мировой катастрофы все накопленные научные знания оказались уничтоженными? И сам ответил: это – атомная гипотеза: все тела (продолжите...).
Учащиеся отвечают: все тела состоят из частиц, которые находятся в непрерывном хаотическом движении и взаимодействуют друг с другом.
В этой фразе содержится огромная информация о мире.
На основании основных положений МКТ мы с вами смогли получить основное уравнение МКТ, уравнения состояния идеального газа, газовые законы; объяснить давление газа на стенки сосуда, броуновское движение, диффузию и многие другие явления.
Цель нашего урока сегодня повторить полученные знания по данной теме, обобщить их, найти им применение при решении некоторых интересных задач, увидеть, что за «сухой» теорией стоит много необычного и интересного. Для этого нужны не только ваши знания, но и ваши любознательность, наблюдательность, а главное, желание думать.
Сегодня каждый из вас не просто ученик на уроке, но и участник команды. Коллективизм, умение слушать друг друга, желание помочь своей команде – вот те качества, которые помогут вам выйти вперёд. Каждому участнику команды – победительницы добавляется один балл при выставлении оценок.
Представляю команды:
1). Команда 1;
2).Команда 2;
3). Команда 3;
4). Команда 4.
2. В качестве разминки командам предлагался конкурс «Чёрный ящик».
Каждая команда должна была заранее положить в «чёрный ящик» прибор или предмет и написать вопрос-представление для другой команды.
Пример задания:
«Прост в устройстве, применении,
Но опасен, без сомнения.
Может запросто сломаться,
Его стоит опасаться».
Вопрос: «Что находится в «Чёрном ящике?»
( Ответ: ртутный термометр)
3. Команды немного согрелись и готовы к дальнейшим конкурсам. Следующий конкурс «Устами младенца». Каждая команда получает по одному вопросу, написанному на листочках. Если команда не даёт ответа, то отвечать могут из других команд.
Без него люди умирают, растения тоже, у детей возникает грипп. Когда его много, хочется в душ. Наверху его всегда больше, чем внизу. Животные и растения получают его от Солнца. (Тепло).
Она нужна всем. Когда работают, её теряют. (Энергия).
Вокруг носа вьётся, а в руки не даётся. (Запах).
Без рук, без ног по полю рыщет, поёт да свищет, деревья ломает, к земле траву прижимает. (Ветер)
4. Конкурс «Дальше, дальше...» (блицтурнир)
Командам необходимо закончить фразы. Учитывается количество правильных ответов.
Вопросы команде 1:
В равных объёмах газов при одинаковых T и Р содержится...
Процесс изменения состояния термодинамической системы при постоянном объёме называют...
Опыт по определению скоростей молекул предложил...
«Молекула» в переводе с латинского означает…
Уравнение Менделеева-Клапейрона...
Вопросы команде 2:
Тело, состоящее из огромного числа частиц, называют...
Процесс изменения состояния идеального газа при Р константа называют...
Температура – это мера...
Диффузия доказывает, что...
Закон Бойля-Мариотта гласит...
Вопросы команде 3:
В молях измеряют...
Хаотическое движение огромного числа частиц называют...
Предельную температуру, при которой давление газа при фиксированном объёме обращается в нуль, называет...
Процесс изменения состояния идеального газа при Т константа называют...
Закон Гей-Люссака гласит...
Вопросы команде 4:
Газ, взаимодействие между молекулами которого пренебрежимо мало, называют...
Движение взвешенных в газе или жидкости частиц называют...
Температура характеризует состояние...
Количественную зависимость между двумя параметрами газа при фиксированном значении третьего называют...
Закон Шарля гласит...
5. Конкурс «Творцы теории».
При изучении МКТ мы узнали имена замечательных учёных, таких как Демокрит, Ломоносов, Дальтон, Авогадро, Бойль, Мариотт, Больцман, Джоуль, Клапейрон и т.д.
Мы знаем их законы, постоянные величины, названные в их честь, а знаем ли мы что-нибудь о самих учёных?
Я просила команды «добыть» некоторые интересные факты из жизни этих учёных. Слово командам.
6. Конкурс «Фантазии на тему « Из жизни молекул».
Каждая команда получает листочек, на котором есть начало рассказа (рассказ может быть написан в стихотворной форме) и слова – подсказки, которые можно использовать.
Задание командам: продолжить рассказ.
1) «Была молекулой я Газа, чудеса…».
Слова – подсказки: простор, полёт, удары, хаос.
2) «Попала в Жидкий городок – ну прямо детский сад…»
Слова- подсказки: толкутся, прыгают, колеблются, «резвятся».
3) «Я видно за свои грехи попала в Тело Твёрдое – кромешный ад…»
Слова – подсказки: теснота, закон, порядок, как часовые на посту.
4). «Вот это жизнь, что значит – идеал…».
Слова – подсказки: гармония и абсолют, тоска и одиночество вокруг.
(Пример выполненного задания одной из команд):
Была молекулой я газа – чудеса:
Везде простор, свобода велика.
Полёт, падение и взлёт – вот это да!
И расширение возможно без труда.
Когда сближают нас – сближаемся легко.
И носимся мы, ударяясь друг о друга,
Поверьте, в газе двигаться не трудно,
А скорости большие любят все, и хаос - это чудно!
Мы везде, где только можно.
Без объёма и без формы
Нам, поверьте, жить не сложно.
Со всех сторон нас тут толкают,
Только боли мы не знаем.
Даже очень интересно
Двигаться там, где не тесно.
Я б осталась там ещё,
Но сон прошёл – исчезло всё.
Конкурс «Что? Где? Когда?» и «Почему?».
Вопросы командам.
Почему «…на морском берегу, разбивающем волны, платье сыреет всегда, а на Солнце, вися, оно сохнет...»? (Лукреций Кар «О поэме вещей»)
Ответ: Относительная влажность воздуха на морском берегу больше, чем вдали от него, вследствие этого одежда сыреет. Испарение влаги с одежды, развешенной в солнечном месте, происходит быстрее, так как воздух сух.
Почему пыль, представляющая частицы твёрдого вещества, довольно долго удерживается в воздухе во взвешенном состоянии?
Ответ: Пылинки испытывают непрерывные удары со стороны хаотически движущихся молекул воздуха.
Почему угарный газ быстрее проникает в организм, чем кислород? Во сколько раз скорость его проникновения больше, чем скорость проникновения кислорода?
Ответ: Скорость молекул угарного газа больше, чем скорость молекул кислорода, так как при одинаковой температуре их средние кинетические энергии равны, а масса молекул кислорода больше, чем масса молекул угарного газа.
Пуская кровь заболевшему матросу, корабельный врач Роберт Майер обратил внимание на необычно алый цвет венозной крови. Его наблюдения показали, что в жарких странах венозная кровь гораздо светлее, чем в северных. Как этот факт помог Майеру в открытии закона сохранения и превращения энергии?
Ответ: Алый цвет венозной крови обусловлен тем, что в вены возвращается кровь, богатая кислородом. Это происходит потому, что в тропиках человек потребляет меньше кислорода, так как для поддержания процессов жизнедеятельности, нормальной температуры тела там нужно меньше энергии.
Серёжа дежурил в столовой. Вот уже минут пять он терпеливо возился с чистыми стаканами: стаканы после мытья были вставлены один в другой и не хотели разделяться. «Что делать?» - спросил сам себя Серёжа. Как бы вы посоветовали ему разделить стаканы?
Ответ: При нагревании тела расширяются, а при охлаждении сжимаются, поэтому наружный стакан надо опустить в горячую воду, а во внутренний налить холодную воду.
При надувании щёк давление воздуха и объём увеличиваются. Как это согласуется с законом Бойля-Мариотта? При каких условиях выполняются газовые законы?
Ответ: Применять закон Бойля-Мариотта в этом случае нельзя, так как масса воздуха не остаётся по условию задачи постоянной.
Будет ли гореть спичка, зажжённая внутри искусственного спутника Земли, выведенного на орбиту?
Ответ: Нет, так как в невесомости нет конвекции воздуха, а значит, и притока кислорода к зажжённой спичке.
8. Конкурс «Графики учись читать, пятёрки будешь получать».
Команды получают по листочку бумаги, на котором изображены графики изопроцессов. Надо назвать эти изопроцессы и изобразить их в других координатах.
9. Конкурс «Аукцион формул».
Командам предлагались три формулы (одна за другой после того, как первая формула была «куплена» какой-либо командой).
Уравнение Менделеева-Клапейрона: P·V =  ·R·T
·R·T
Основное уравнение МКТ: Р =  ·m0 ·n·
·m0 ·n· 2
2
Формула средней квадратичной скорости молекул:  =
=  .
.
Чтобы «купить» формулу с соответствующим количеством баллов, учащиеся должны были сказать как можно больше информации о ней (как называется, почему, где её можно применить и т.д.).
10. Задание для команд «Теория с длинной историей» (по схеме «Структура научной теории)
Каждой группе выдавался листочек, на котором они должны были представить основные элементы МКТ:
Команда 1– перечислить несколько научных фактов и записать основные свойства идеализированного объекта;
Команда 2– записать основные положения теории, составляющие её ядро (гипотезу, постулаты, законы, понятия, константы);
Команда 3 – записать несколько следствий, вытекающих из основных закономерностей МКТ (уравнения, полученные из основных закономерностей, формулы);
Команда 4 – перечислить экспериментальные доказательства основных положений и законов МКТ.
После выполнения задания группы представляли свои работы у доски и с помощью керамического магнита закрепляли свой листочек на доске; таким образом, на доске появилась заполненная структурная схема МКТ. Эта схема позволила обобщить
знания, полученные при изучении молекулярной физики идеального газа.
После выполнения этого задания подводились итоги. Группа получала определённое количество баллов, которые она распределяла между членами своей команды, учитывая коэффициент полезного участия (КПУ). Это позволяет сделать оценку более объективной. При этом даже слабые учащиеся могут получить хорошую оценку, так как игра подобного рода предполагает разные виды деятельности (учащиеся подчас, представляя домашнее задания, показывают различные сценки, кто-то из них сочиняет, кто-то готовит вопросы для другой команды, кто-то ищет материал о жизни учёного и т.д.).
Проведение подобных игр активизирует деятельность учащихся, повышает их интерес к предмету.
Класс: 10.
Тема урока: «Решение задач по теме «Первый закон термодинамики».
Тип урока: урок проверки знаний, умений и навыков.
Цели урока
создать условия для проверки знаний, умений и навыков учащихся по теме «Первый закон термодинамики»;
содействовать развитию самостоятельности мышления учащихся, способствовать развитию памяти и внимания учащихся;
способствовать воспитанию дисциплинированности, аккуратности; содействовать формированию научного мировоззрения учащихся.
Форма урока: решение задач.
Ход урока
Организация начала урока.
Актуализация знаний.
1. Запишите обозначения следующих величин:
– внутренняя энергия
– изменение внутренней энергии
– количество теплоты
– работа внешних сил
– работа газа
2. Запишите формулу 1 закона термодинамики
3. Запишите формулу расчета изменения внутренней энергии для одноатомного газа
4. Запишите формулу работы внешних сил при сжатии
5. Запишите соотношение между работой внешних сил и работой газа
6. Запишите формулу 1 закона термодинамики для изобарного процесса
7. Запишите формулу 1 закона термодинамики для изохорного процесса
8. Запишите формулу 1 закона термодинамики для изотермического процесса
9. Запишите формулу 1 закона термодинамики для адиабатного процесса
Решение задач.
Фронтально (уровень В и С)
№ 1.
Гелий нагревается при постоянном давлении. При этом ему сообщено 20 кДж теплоты. Определить изменение внутренней энергии газа и совершённую им работу.
Решение.
А/ = рΔV = 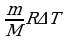 , ΔU =
, ΔU = 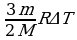 , Q = ΔU + А/ =
, Q = ΔU + А/ = 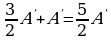 ,
, 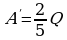 , ΔU =
, ΔU = 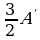 ,
,
А/ = 8 кДж, ΔU = 12 кДж.
№ 2.
При адиабатном сжатии 1 моля одноатомного газа внешними силами была совершена работа А. Во сколько раз увеличилась средняя квадратичная скорость молекул этого газа, если начальная температура газа равна Т1?
Решение.
ΔU = А = U2 - U1, U = 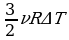 , U =
, U = 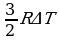 , A =
, A = 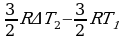 , T2 =
, T2 = 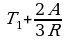
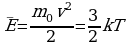 ,
, 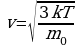 ,
, 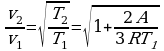
Самостоятельная работа.
Вариант 1
А1. Идеальный газ совершил работу 400 Дж, при этом его внутренняя энергия увеличилась на 100 Дж. Чему равно количество теплоты, которое получил или отдал газ в этом процессе?
1) газ получил 500 Дж 3) газ отдал 500 Дж
2) газ получил 300 Дж 4) газ отдал 300 Дж
A2. Идеальный одноатомный газ в количестве 6 молей поглощает количество теплоты Q. При этом температура газа повышается на 20 К. Работа, совершаемая газом в этом процессе равна 1 кДж. Поглощённое количество теплоты равно
1) 0,5 кДж 3)1,5 кДж
2) 1 кДж 4)2,5 кДж
A3. Идеальный одноатомный газ находится в сосуде с жесткими стенками объёмом 0,6м3. При нагревании его давление возросло на 3.103Па. Насколько увеличилась внутренняя энергия газа?
1) на 0,2 кДж 3) на 0,9 кДж
2) на 1,8 кДж 4) на 2,7 кДж
А4. Какое количество теплоты нужно передать молю одноатомного идеального газа, чтобы изобарно увеличить его объём в 3 раза? Начальная температура газа Т0.
1) 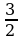 RT0 2) 3 RT0 3)
RT0 2) 3 RT0 3) 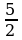 RT0 4) 5RT0
RT0 4) 5RT0
A5. На рисунке представлен график зависимости давления идеального одноатомного газа от его объёма. Газ получил 500 кДж теплоты. Внутренняя энергия при этом
1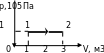 ) уменьшилась на 300 кДж
) уменьшилась на 300 кДж
2) увеличилась на 300 кДж
3) уменьшилась на 700 кДж
4) увеличилась на 700 кДж
B1. Установите соответствие между описанными в первом столбце особенностями применения первого закона термодинамики к различным изопроцессам и названием изопроцесса.
| ОСОБЕННОСТИ ПРИМЕНЕНИЯ ПЕРВОГО ЗАКОНА ТЕРМОДИНАМИКИ | НАЗВАНИЕ ИЗОПРОЦЕССА | ||
| А) | Все переданное газу количество теплоты идет на совершение работы, а внутренняя энергия газа остается неизменной. | 1) изотермический
2) изобарный
3) изохорный
4) адиабатный | |
| Б) | Изменение внутренней энергии газа происходит только за счет совершения работы, так как теплообмен с окружающими телами отсутствует. | ||
В2. Какое количество теплоты выделится при изобарном охлаждении 80 г гелия с 200ºС до 100 ºС? Ответ выразите в килоджоулях (кДж) и округлите до целых.
С1. Какое количество теплоты получит 1 моль идеального одноатомного
газа при изобарном нагревании от некоторой начальной температуры и
последующем адиабатном расширении, если при адиабатном расширении газ совершает работу А, а в конечном состоянии температура равна начальной?
Вариант 2
А1. Идеальный газ совершил работу, равную 300 Дж. При этом внутренняя энергия увеличилась на 300 Дж. В этом процессе газ…
1) отдал 600 Дж 3) получил 600 Дж
2) отдал 300 Дж 4) получил 300 Дж
А2. Внутренняя энергия идеального одноатомного газа U = 300 Дж. Газ занимает объём V = 2л. Давление газа равно…
1) 102 Па 3) 104 Па
2) 103 Па 4) 105 Па
A3. Чему равно изменение внутренней энергии газа, если ему передано количество теплоты 500 Дж, а газ при постоянном давлении 105 Па расширился на 3 .10 – 3 м3?
1) 300 Дж 3) 200 Дж
2) 250 Дж 4) 400 Дж
А4. Как изменяется внутренняя энергия идеального газа при повышении его температуры в 2 раза при неизменном объёме
1) увеличивается в 2 раза
2) уменьшается в 2 раза
3) увеличивается в 4 раза
4) уменьшается в 4 раза
A5. На рисунке представлен график зависимости давления идеального
одноатомного газа от его объёма. Газ отдал 500 кДж теплоты.
В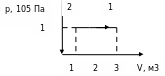 нутренняя энергия при этом
нутренняя энергия при этом
1) уменьшилась на 300 кДж
2) увеличилась на 300 кДж
3) уменьшилась на 700 кДж
4) увеличилась на 700 кДж
В1. Установите соответствие между описанными в первом столбце особенностями применения первого закона термодинамики к различным изопроцессам и названием изопроцесса.
| ОСОБЕННОСТИ ПРИМЕНЕНИЯ ПЕРВОГО ЗАКОНА ТЕРМОДИНАМИКИ | НАЗВАНИЕ ИЗОПРОЦЕССА | |
| А) | Внутренняя энергия газа изменяется только за счёт теплообмена с окружающими телами. | 1) изотермический
2) изобарный
3) изохорный
4) адиабатный |
| Б) | Изменение внутренней энергии газа происходит за счет совершения работы и теплообмена с окружающими телами. | |
В2. 1 моль инертного газа сжали, совершив работу 600 Дж. В результате сжатия температура газа повысилась на 40С. Какое количество теплоты отдал газ? Ответ округлите до целых.
С1. Масса т идеального газа, находящегося при температуре Т, охлаждается
изохорно так, что давление падает в п раз. Затем газ расширяется при
постоянном давлении. В конечном состоянии его температура равна
первоначальной. Молярная масса газа и. Определить совершенную
г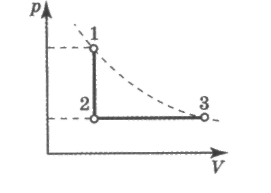 азом работу.
азом работу.
Итоги урока.
Домашнее задание
Рефлексия.
Тема урока: «Лабораторная работа № 3 Измерение удельной теплоёмкости твёрдого тела»
Цели урока: научить обучающихся использовать измерительные приборы для расчёта удельной теплоёмкости, представлять результаты измерений в виде таблиц и делать выводы.
Тип урока: урок комплексного применения знаний и способов действий.
Оборудование: лабораторный комплект по термодинамике: термометр, калориметр, весы, стакан с холодной водой, алюминиевый цилиндр, нить, сосуд с горячей водой.
Ход урока:
1 Организационный момент.
2 Выполнение лабораторной работы по описанию в учебнике.
1) Повторить правила по охране труда при выполнении лабораторных работ:
- при проведении работ с использованием воды нужно пользоваться лотками;
- проявлять особую осторожность с сосудом с горячей водой;
- при измерении температуры жидкости термометром, его нельзя вынимать;
- направление взгляда на шкалу прибора при отсчёте показаний должно быть перпендикулярно её плоскости;
- после погружения термометра в воду необходимо выждать некоторое время, пока длина столбика с подкрашенной жидкостью не перестанет меняться.
2) Ответить на вопросы:
- По какой формуле рассчитывают количество теплоты, которое получает тело при нагревании или отдаёт при охлаждении?
-Какая физическая величина обозначается буквой С?
3) Объявление цели урока.
4) Подготовка оборудования для выполнения лабораторной работы.
5) Подготовка отчёта (оформление тетрадей, зарисовка таблиц.)
6) Выполнение эксперимента.
7) Вывод: какой результат получился и как он сравнивается с табличным, почему расхождения (если они есть)?
3 Дополнительные задачи.
1) Для охлаждения двигателя внутреннего сгорания часто применяют воду. Как это можно объяснить с точки зрения физики?
2) Почему нагретые детали охлаждаются в воде быстрее, чем на воздухе?
3) Почему шерстяная одежда сохраняет тепло лучше, чем хлопчатобумажная?
4) Прежде чем налить в стакан кипяток, в стакан опускают чайную ложку. Объясните, для чего это делают?
5) Почему грязный снег в солнечную погоду тает быстрее, чем чистый?
6) Можно ли термос временно использовать как холодильник?
4. Подведение итогов урока.
2.5. Конспект урока контрольной работы по теме «Основы МКТ»Цели урока:
Образовательная: осмысление структуры и внутренней логики всей темы «основы МКТ», выявление усвоения обобщенных знаний и формирование умений учащихся решать задачи по теме «основы МКТ».
Развивающая: развитие логического мышления учащихся путем применения общих формул к частным случаям.
Воспитательная: формирование диалектика - материалистического мировоззрения путем показа роли теории и опыта в изучении закономерностей физики на примере темы «основы МКТ».
Методы обучения: практические.
Структура урока:
Организационный момент (2 мин).
Контрольная работа (43 мин).
Ход урока:
I. Организационный момент.
II. Контрольная работа.
Вариант 1
Запишите формулу средней квадратичной скорости.
При температуре 15°С относительная влажность воздуха 80%. Найдите его абсолютную влажность.
Молекула азота при нормальных условиях движется со средней скоростью 454 м/с. Определите модуль среднего импульса
молекулы.
При температуре воздуха -3°С относительная влажность его 40%. Какую массу воды нужно дополнительно испарить в каждый кубометр воздуха, чтобы при температуре 20°С относительная влажность была 90%?
В комнате на полу лежит прочный полый шарик радиусом 2 см и массой 10 г. При каком давлении атмосферы p он смог бы всплыть к потолку? Температура в комнате 20°С. Для оценки атмосферу считать идеальным газом.
Вариант 2
Запишите формулу средней кинетической энергии.
Определите массу одной молекулы кислорода.
На сколько процентов возрастет средняя квадратичная скорость молекул идеального газа, если абсолютная температура увеличится в n = 2 раза?
В комнате объемом 40 м3 при температуре 20°С относительная влажность воздуха 20%. Какую массу воды нужно испарить для увеличения относительной влажности воздуха до 50%?
Температура воздуха в комнате 14°С, относительная влажность 60%. В комнате затопили печь, и температура воздуха повысилась до 22°С. Сколько воды надо испарить в комнате, чтобы точка росы при этом увеличилась на 6°С? Какой стала относительная влажность воздуха, если объем комнаты 50 м3?
Решение контрольной работы
Вариант 1
1 )
) 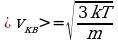 .
.
2) Дано: Решение:
t = 15°C 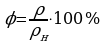 ;
; 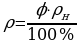 ;
;
φ = 80% ρ = 80*12,8/100 = 10,24 г/м3.
ρн = 12,8 г/м3
ρ = ? Ответ: ρ = 10,24 г/м3.
3 ) Дано: Решение:
) Дано: Решение:
vкв = 454 м/с p = mvкв;
T = 293 К 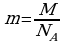 ;
; 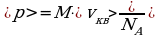 ;
;
p = ? 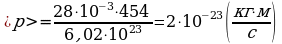 .
.
Ответ: 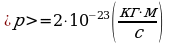 .
.
4) Дано: Решение:
V = 1 м3 ∆m = m2 – m1
t1 = -3°C 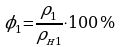 ;
; 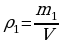 ;
; 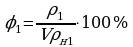 ;
;
φ1 = 40% 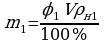 ;
;
ρн1 = 3,81 г/м3 Аналогично:
t 2 = 20°C
2 = 20°C 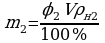 ;
;
φ2 = 90% 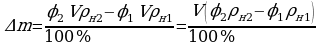 ;
;
ρн2 = 17,3 г/м3 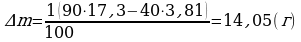 .
.
∆m = ? Ответ: 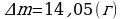 .
.
5 ) Дано: Решение:
) Дано: Решение:
r = 2 см mg = ρвgV; m = ρвV; 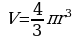 ;
;
T = 293 К 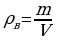 ;
; 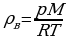 ;
; 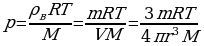 ;
;
m = 10 г 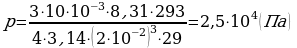 .
.
p = ? Ответ: 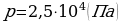 .
.
Вариант 2
1) 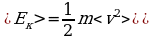 .
.
2 ) Дано: Решение:
) Дано: Решение:
O2 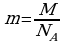 ;
; 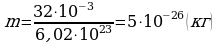 .
.
m = ? Ответ: 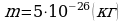 .
.
3 ) Дано: Решение:
) Дано: Решение:
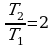
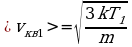 ;
; 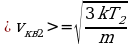 ;
;
x% = ? 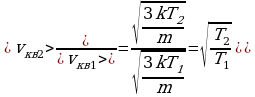 ;
; 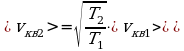 ;
;
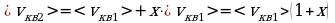 ;
; 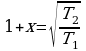 ;
;
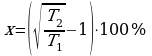 ;
; 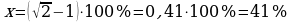 .
.
Ответ: 41%.
4 ) Дано: Решение:
) Дано: Решение:
V = 40 м3 ∆m = m2 – m1
t1 = 20°C 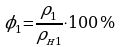 ;
; 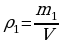 ;
; 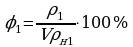 ;
;
φ1 = 20% 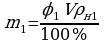 ; Аналогично:
; Аналогично:
ρн1 = 3,81 г/м3 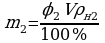 ;
;
φ2 = 50% 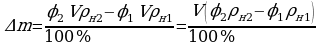 ;
;
ρн2 = 17,3 г/м3 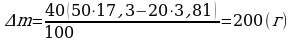 .
.
∆m = ? Ответ: 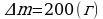 .
.
5 ) Дано: Решение:
) Дано: Решение:
V = 50 м3 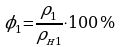 ;
; 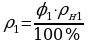 ;
; 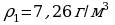 ;
;
t1 = 14°C 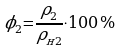 ;
; 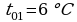 (по таблице);
(по таблице);
φ1 = 60% 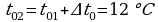 ;
; 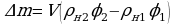 ;
;
t2 = 22°C 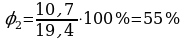 ;
;
∆t0 = 6°C ρн1 = 12,1 г/м3; ρн2 = 19,4г/м3;
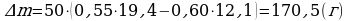 .
.
∆m = ?
φ2 = ? Ответ: 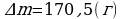 ,
, 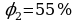 .
.
Проанализировав тему и описав методику изучения материала, можно сделать вывод, что данная тема имеет большую важность для школьного курса. Рассмотрение таких понятий как внутренняя энергия, количество теплоты на более глубоком уровне делает эту тему достаточно сложной и интересной. Поясняется понятие работы в термодинамике и даётся подробное объяснение расчёта её.
Также прослеживаются межпредметные связи с биологией, так как именно в биологии проводятся самые красочные примеры преобразования энергии. Изучив эту тему учащиеся получат представление о необратимость процессов в природе и более того, они получат обоснование этим процессам.
При изучении темы сформулируется понятии о принципе работы тепловых двигателей. Определение их КПД и расчёт задач на эту тему. Также решается проблема экологического плана, вызванные использованием самих тепловых машин.
Так же в этой теме изучается первое начало термодинамики и происходит применение его к изотермическим процессам в идеальном газе. В этой теме вводится новое для учащихся, в частности адиабатный процесс. Идёт подробный разбор изотермических процессов с использованием новых знаний, полученных в этой теме.
Теория и методика обучения физики в школе: Частные вопросы: Учеб. пособие для студ. пед. вузов / С. Е. Каменецкий, Н. С. Пурышева, Т. И. Носова; под ред. С. Е. Каменецкого. – М.: Издательский центр «Академия», 2000. – 384 с.
Теория и методика обучения физики в школе: Общие вопросы: Учеб. пособие для студ. высш. пед. учеб. заведений / С. Е. Каменецкий, Н. С. Пурышева, Н. Е. Важеевская; под ред. С. Е. Каменецкого. – М.: Издательский центр «Академия», 2000. – 368 с.
Учебная программа по физике для общеобразовательных учреждений с русским языком обучения. – Минск: национальный институт образования, 2009. – 64 с.
Образовательный стандарт учебного предмета «ФИЗИКА» (VI—XI классы)
Горелова Т. И. Профессиональные знания в аспекте политехнического образования школьников / Т.И. Горелова // Сибирский учитель. – 2009. - № 2. – С. 62.
Николаев В.И. «Методика преподавания физики» Курс лекций».
Методика преподавания физики в средней школе: Частные вопросы: Учеб. пособие для студентов пед. ин-тов по физ.-мат. спец./С. В. Анофрикова, М. А. Бобкова, Л. А. Бордонская и др.; Под ред. С. Е. Каменецкого, Л. А. Ивановой. – М.: Просвещение, 1987. – 336 с.
Мякишев Г. Я. Физика. 10 класс : учеб. для общеобразоват. организаций с прил. На электрон. Носителе: базовый уровень / Г. Я. Мякишев, Б. Б. Буховцев, Н. Н. Сотский; под ред. Н. А. Парфентьевой. – М. : Просвещение, 2014. – 416 с.












