
Химические свойства серной кислоты

Цели урока:
- Знать строение и свойства серной кислоты.
- Уметь составлять уравнения реакций, отражающие свойства этих веществ.
- Развивать наблюдательность, внимание, умение работать самостоятельно и в группе, умение анализировать.
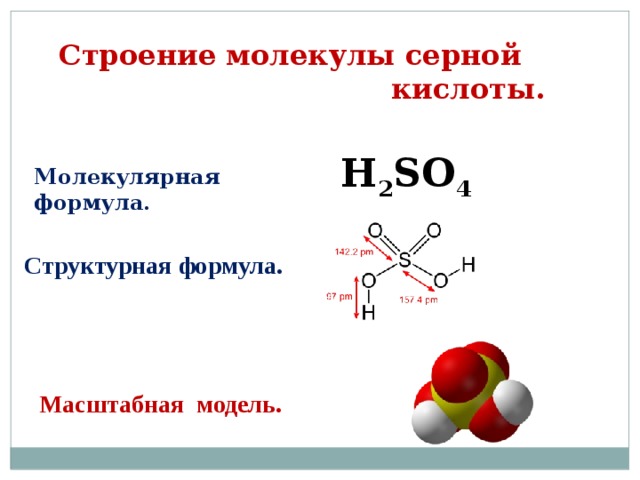
Строение молекулы серной кислоты.
H 2 SO 4
Молекулярная формула.
Структурная формула.
Масштабная модель.

Серная кислота
H 2 SO 4 , сильная двухосновная кислота. Безводная серная кислота бесцветная маслянистая жидкость, плотность 1,9203 г/см³, tпл 10,3 .С, tкип 296,2 .С. С водой смешивается во всех отношениях.

Получение
Сырьем для получения серной кислоты служат: S,сульфиды металлов,H 2 S, отходящие газы теплоэлектростанций, сульфаты Fe, Ca и другие.

Серная кислота H 2 SO 4
Серная кислота сильная, т.е. в водных растворах полностью распадается на ионы:
H 2 SO 4 = 2H + +SO 4 2-
Растворы кислоты не имеют запаха.


Химические разбавленной серной кислоты
А. Взаимодействие с металлами, стоящими в ряду активности до водорода:
H 2 SO 4 + Zn = ZnSO 4 + H 2
Допишите:
H 2 SO 4 +Mg =

Б. С оксидами металлов:
H 2 SO 4 + CuO = CuSO 4 + H 2 O
Допишите:
H 2 SO 4 + ZnO= (самостоятельно)

В. С гидроксидами металлов:
H 2 SO 4 + NaOH →
H 2 SO 4 + 2NaOH → Na 2 SO 4 + 2H 2 O
Допишите:
H 2 SO 4 + Сu(OH) 2 →

Г. С солями (при условии, если образуется осадок или газ).
H 2 SO 4 + BaCI 2 →
H 2 SO 4 + BaCI 2 = BaSO 4 ↓ + 2HCI
Допишите:
H 2 SO 4 + Na 2 CO 3 →

Приготовление раствора серной кислоты.
Вода легче серной кислоты. При вливании воды в серную кислоту, при контакте с поверхностью кислоты, она сразу же вступает в бурную реакцию, разогревается, вскипает, разбрызгивается из сосуда и может попасть в глаза, в лицо. Поэтому одно из важнейших правил химика: "Не лей воду в кислоту!"

Правила техники безопасности при работе с серной кислотой .
• Работать в перчатках.
• При попадании кислоты на кожу промыть проточной водой.
• Обработать 5% раствором питьевой соды.
• При разбавлении концентрированной серной кислоты, сначала наливают воду, затем – кислоту.

Серная кислота высокой концентрации (практически безводная) не взаимодействует с железом и алюминием в результате
пассивации металлов .

Концентрированная серная кислота
-довольно сильный окислитель, особенно при нагревании.; окисляет HI и частично НВг до свободных галогенов, углерод - до СО 2 , S-до SO 2 , окисляет многие металлы Сu, Hg и др.).
C +2H 2 SO 4 =2SO 2 + CO 2 +2H 2 O

Продуктами восстановления кислоты обычно является оксид серы (IV), сероводород и сера (H 2 S и S) образуется в реакциях кислоты с активными металлами- магнием, кальцием, натрием, калием и др.
Cu + 2H 2 SO 4 = CuSO 4 + SO 2 + 2H 2 O Mg + 2H 2 SO 4 = MgSO 4 + SO 2 + 2H 2 O 4Mg + 5H 2 SO 4 = 4MgSO 4 + H 2 S + 4H 2 O
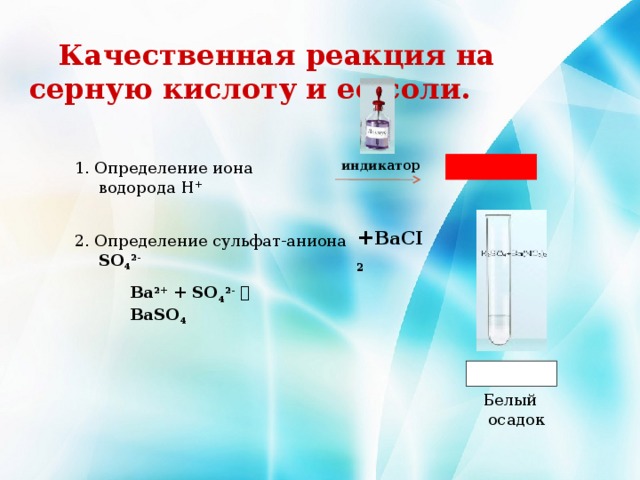
Качественная реакция на серную кислоту и ее соли.
1. Определение иона водорода Н +
индикатор
+ BaCI 2
2. Определение сульфат-аниона SO 4 2-
Ba 2+ + SO 4 2- BaSO 4
Белый осадок

Перечислите общие свойства раствора серной кислоты
Me X O Y
Me x O y
Me(OH) n
Соль
Соль +H 2
H 2 SO 4
Соль +H 2 O
Соль + Кислота

вещества
кислота Н n +1 (KO) -n
1.металл
признаки и
Ме
металл + кислота = соль + водород ↑
2.основной
3.основание
основный оксид + кислота = соль + вода
оксид
условия реакций
МеО
Ме(ОН) n
основание + кислота = соль + вода
4.соль
Ме n (КО) m
соль + кислота = новая кислота + новая соль

С какими из перечисленных веществ может вступить во взаимодействие серная кислота, находящаяся в водном растворе :
H 2 SO 4 + MgO= MgSO 4 + H 2
H 2 SO 4 +BaCI 2 =BaSO 4 + 2HCI
H 2 SO 4 +CO 2 =?
3H 2 SO 4 +2AI= AI 2 (SO 4 ) 3 + 3H 2
H 2 SO 4 +KOH=K 2 SO 4 + H 2
H 2 SO 4 +NaNO 3 =?

Ответьте на вопросы.
1.Что нового вы узнали сегодня о кислотах? 2.Какие из изученных сегодня вопросов вызвали наибольшие трудности при усвоении? Как вы думаете, почему? 3.Какие задания вам выполнить не удалось? Почему? 4.Каким баллом вы бы оценили свою работу.

Домашнее задание
§22 стр.104-106
1.упр.4 стр.107
2.Написать уравнения реакций
– взаимодействия серной кислоты
с оксидом железа(ІІІ),
оксидом кальция,
гидпрксидом кальция,















































