

СДЕЛАЙТЕ СВОИ УРОКИ ЕЩЁ ЭФФЕКТИВНЕЕ, А ЖИЗНЬ СВОБОДНЕЕ
Благодаря готовым учебным материалам для работы в классе и дистанционно
Скидки до 50 % на комплекты
только до
Готовые ключевые этапы урока всегда будут у вас под рукой
Организационный момент
Проверка знаний
Объяснение материала
Закрепление изученного
Итоги урока


Предмет и задачи общей и неорганической химии. Растворы. Способы выражения концентрации растворов
Предмет и задачи общей и неорганической химии. Растворы. Способы выражения концентрации растворов
Цели занятия:
- формирование представлений о месте химии в современной научной картине мира, важности изучения законов и теорий общей и неорганической химии, которые являются фундаментом для освоения других естественнонаучных, специальных и профессиональных дисциплин,
- сформировать представления о растворах, способах выражения концентрации растворов,
- ознакомление с медико-биологическим значением воды и биологических жидкостей, значение растворов для медицины и фармации,
- формирование навыков безопасной работы в химической лаборатории, формирование навыков работы с научной и справочной литературой, подготовки рефератов и выступления с сообщениями по ним,
- ведение дискуссий.
Знать:
- правила работы и технику безопасности в химической лаборатории,
- номенклатуру основных классов неорганических соединений,
- классификацию дисперсных систем,
- физико-химические свойства воды. Вода — важнейший растворитель,
- способы выражения концентрации веществ в растворах.
Уметь:
- производить расчеты, используя знания единиц концентрации в растворах,
- обращаться с химической посудой,
- рассчитывать концентрацию растворов (массовую долю, моляльность, молярную концентрацию раствора).
Содержание занятия.
1. Определение исходного уровня знаний студентов по химии.
2. Практическая часть. Содержание раздела.
Введение. Техника безопасности и правила работы в химической лаборатории. Номенклатура неорганических соединений: адаптированный и неадаптированный варианты номенклатуры ИЮПАК; фармакопейная номенклатура неорганических лекарственных веществ, международные непатентованные названия лекарственных веществ неорганической природы (МНН). Ознакомление с химической посудой.
Правила техники безопасности при работе в химической лаборатории.
Работа в химической лаборатории требует определенных правил поведения и соблюдения техники безопасности.
Работа с небольшими количествами химических веществ снижает возможность несчастных случаев до минимума, но не исключает их полностью. Поэтому каждому работающему в химической лаборатории нужно знать и строго соблюдать все правила техники безопасности.
1. При всех работах следует соблюдать осторожность, учитывая, что неаккуратность, невнимательность, недостаточное знакомство со свойствами веществ, с которыми ведется работа, могут повлечь за собой несчастный случай.
2. При работе с металлическим натрием, калием и литием нельзя допускать соприкосновения их с водой, так как образующийся водород воспламеняется и взрывается. При попадании щелочных металлов на кожный покров и слизистую оболочку образуются тяжелые ожоги.
Едкие щелочи и концентрированные кислоты, попадая на кожу, также вызывают ожоги. Особенно опасно поражение глаз.
3. Смыв концентрированных кислот и щелочей осуществляется под сильной струей воды. Разлитые концентрированные кислоты и щелочи необходимо засыпать песком, после чего производить уборку.
При попадании на кожу концентрированной кислоты или щелочи нужно сильной струей воды промыть место ожога, после чего обработать 0,5% раствором соды (при ожоге кислотой) и борной кислотой, разбавленным раствором уксусной или лимонной кислоты — при ожоге щелочью.
4. Растворять серную кислоту в воде следует, приливая кислоту к воде по каплям, постоянно перемешивая раствор, а не наоборот!
При мытье посуды хромовой смесью необходимо остерегаться попадания смеси на кожу, одежду, обувь.
5. Если при проведении опыта разбился термометр и разлилась ртуть, нужно собрать ее при помощи специальной ловушки или груши. Мельчайшие частицы ртути собираются кисточкой из белой жести. Поверхность стола или пола, на которой была ртуть, тщательно смачивают 20% раствором хлорида железа (III) или засыпают серой.
6. Нагревать жидкость в пробирке следует постепенно, направляя отверстие пробирки в сторону от себя и от работающих рядом товарищей, т.к. вследствие частичного перегрева может произойти выбрасывание жидкости.
7. Нельзя наклоняться над пробиркой, в которой кипит жидкость.
8. Нельзя вдыхать какие бы то ни было вещества в лаборатории, даже если количество вещества очень мало. Для того, чтобы понюхать вещество, следует движением руки направить к себе пары или газы.
9. Все опыты с дурно пахнущими, а также ядовитыми веществами (анилин, бром и др.) следует проводить в вытяжном шкафу.
10. Никаких веществ в лаборатории не пробовать на вкус.
11. При работе с газоотводной трубкой убирать горелку из-под пробирки с реакционной смесью можно лишь тогда, когда конец газоотводной трубки, опущенной в жидкость, удален из нее. Если убрать горелку до того, как газоотводная трубка удалена, жидкость засосет в раскаленную реакционную пробирку, и может произойти разбрызгивание реакционной смеси на лицо и руки.
12. Работу с легковоспламеняющимися жидкостями (эфир, бензол, ацетон, спирт и др.) проводить вдали от открытого огня. Нагрев их осуществляется на водяной или песчаной бане.
13. Отбор жидких веществ (растворы кислот, щелочей, солей тяжелых металлов, летучих веществ) производить специальной пипеткой (с грушей).
14. Перегонять и нагревать низкокипящие вещества (ацетон, бензол, эфиры, спирты и т.п.) следует в круглодонных колбах из тугоплавкого стекла на банях с соответствующим теплоносителем, в вытяжном шкафу, вдали от огня.
Правила поведения в химической лаборатории.
1. На лабораторные занятия студенты должны являться в халатах, медицинских шапочках и сменной обуви.
2. Все опыты следует проводить в чистой посуде. По окончании работы посуду вымыть и подготовить к следующему занятию.
3. Склянки с реактивами обязательно ставить на место и закрывать теми же пробками (пипетками), которыми они были закрыты. Запрещается переносить склянки с реактивами с одного стола на другой.
4. Книги и портфели, а также другие личные вещи студентов хранить в ящиках лабораторного стола.
5. В каждой группе поочередно выделяется ответственный дежурный на этом занятии. В его обязанности входит:
а) принести все необходимое для данного занятия из лаборантской;
б) следить за порядком в лаборатории;
в) в конце занятия у каждого студента принять рабочее место;
г) сдать лабораторию лаборанту.
Форма записи протокола лабораторной работы
1. Название темы лабораторной работы.
2. Краткое описание опытов.
3. Уравнения химических реакций.
4. Вычисления.
5. Выводы.
Ознакомление с химической посудой.
Для проведения различных опытов применяется специальная химическая посуда из тонкостенного или толстостенного лабораторного стекла. Посуда из тонкостенного стекла должна быть устойчива по отношению к химическому взаимодействию и к колебаниям температуры. Посуда, в которой проводятся реакции при нагревании, изготовляется из жаростойкого пирексного стекла и кварца.
Пирексное стекло содержит ~80% двуокиси кремния, ~5% щелочей и обладает низким коэффициентом расширения; посуда из него обладает высокой термической устойчивостью. Температура размягчения стекла около 620 °С.
Для проведения реакций при более высокой температуре химическая посуда изготовляется из кварцевого стекла. Кварцевое стекло содержит ~99,95% двуокиси кремния, отличается высокой термической стойкостью, инертностью по отношению к ряду химических реагентов (кроме плавиковой и фосфорной кислот).
Температура размягчения кварцевого стекла около 1650° С.
Стеклянная посуда.
Наиболее часто в химических лабораториях употребляется стеклянная посуда, изображённая на рис. 1.
Рис. 1. Стеклянная посуда:
1а - пробирки, 1б - пробирки Вюрца, 2 - стаканы, 3 - колбы плоскодонные, 4 - колбы круглодонные, 5 - колбы Вюрца, 6- колбы конические, 7 - колба Бюнзена, 8 - кристаллизаторы, 9 - воронки, 10 - эксикаторы, 11 - бюксы, 12 - аллонжи, 13 - хлоркальциевые трубки, 14 - тройники, 15 - переходные трубки, 16 - U-образные трубки, 17 — дефлегматоры, 18 - холодильники, 19а - промывные склянки, 19б - осушительные колонки, 20 - часовые стёкла, 21 - реторты, 22 - капельные воронки
Фарфоровая посуда.
Кроме стеклянной посуды в лабораторной практике применяется фарфоровая посуда (рис. 2)
Рис. 2. Фарфоровая посуда:
1 — чашка, 2 — воронка Бюхнера, 3 — тигль с крышкой, 4 — ступка с пестиком, 5 - стакан, 6 — шпатель
Для работы с небольшими количествами веществ применяется химическая посуда малых размеров и емкостей, например, колбы ёмкостью 25, 10 мл; стаканы – 20, 10, 5 мл и т. д.
Мерная посуда.
В лабораторных работах по неорганической химии обычно используется следующая мерная посуда: колбы, пипетки, бюретки, мензурки.
Мерные колбы (рис. 3) служат для приготовления раствора точной концентрации и представляют собой плоскодонные колбы с длинным и узким горлом, на котором нанесена тонкая черта. Эта отметка показывает границу жидкости, которая при определенной температуре занимает указанный на колбе объем. Горло мерной колбы делают узким, поэтому сравнительно небольшое изменение объема жидкости в колбе заметно отражается на положении мениска. Мерные колбы имеют притёртые пробки. Обычно применяются колбы на 50, 100, 250, 500 и 1000 мл.
Рис. 3. Мерная колба Рис. 4. Пипетки Рис. 5. Бюретки
Пипетки служат для точного отмеривания определенного объема жидкости и представляют собой стеклянные цилиндрические, оттянутые сверху и снизу узкие трубки (рис. 4 а). В верхней части пипетки имеется отметка, показывающая, до какого уровня нужно заполнить снизу пипетку, чтобы вылитая из нее жидкость имела объем, указанный на пипетке. Чаще всего пользуются пипеткой емкостью 10 или 20 мл. Существуют измерительные пипетки, имеющие вид узкой градуированной трубки (рис. 4 б).
Бюретки (рис. 5) предназначены для выливания из них строго определенных объемов жидкости. Они представляют собой длинные стеклянные трубки, на которые нанесена шкала c делениями. Чаще всего пользуются бюретками емкостью 50 мл, градуированными на десятые доли миллилитра. В нижней части бюретки имеется кран или зажим. Иногда в бюретках нет крана, тогда на конец ее надевают отрезок резиновой трубки со стеклянным шариком внутри и стеклянной оттянутой внизу трубкой. Оттягивая пальцами резиновую трубку от шарика, можно спускать жидкость из бюретки. Необходимо следить за тем, чтобы оттянутый конец трубки был нацело заполнен сливаемой жидкостью.
Мерные градуированные цилиндры (рис. 6) применяются для грубого отмеривания жидкостей и бывают различных емкостей: 5, 10, 25, 50, 100, 150, 250, 500, 1000 и 2000 мл.
Рис. 6. Мерные цилиндры
Правила работы с пипеткой.
Для наполнения нижний конец пипетки опускают в жидкость до дна сосуда. С помощью груши набирают жидкость, следя, чтобы кончик пипетки все время находился в жидкости. Жидкость набирают так, чтобы она поднялась на 2 - 3 см выше метки, затем быстро закрывают верхнее отверстие указательным пальцем, придерживая в то же время пипетку большим и средним пальцами. Затем ослабляют нажим указательного пальца, в результате чего жидкость медленно вытекает из пипетки; как только нижний мениск жидкости опустится до метки, палец снова прижимают. Если на конце пипетки остается капля, ее следует осторожно удалить. Введя пипетку в сосуд, в который нужно перенести жидкость, отнимают указательный палец и дают жидкости стечь по стенке сосуда. После того как жидкость стечет, пипетку держат еще несколько секунд прислоненной к стенке сосуда, слегка поворачивая ее. Выдувать жидкость из пипетки не следует, так как пипетка отградуирована с учетом оставшейся в ней капли.
Правила работы с бюреткой.
Бюретку заполняют жидкостью через воронку, при этом должен быть заполнен и стеклянный капилляр. Для вытекания жидкости резиновую трубку оттягивают от бусины. Если в капилляре остается пузырек воздуха, резиновую трубку изгибают так, чтобы кончик капилляра был направлен вверх, и вытесняют жидкостью весь воздух. Перед началом работы уровень жидкости в бюретке должен быть установлен на нулевом делении. Для этого наливают жидкость в бюретку на 2-3 см выше нулевого деления, а затем снимают воронку и сливают избыток жидкости.
Уровень прозрачных растворов устанавливают по нижнему краю мениска, непрозрачных - по верхнему. При отсчете по бюретке глаз наблюдателя должен находиться в одной плоскости с уровнем жидкости .
Фильтрование
Фильтрование - процесс механического разделения твердых и жидких компонентов смеси. Сущность фильтрования состоит в том, что жидкость с находящимися в ней частицами твердого вещества пропускают через фильтр, задерживающий твердую фазу. Наиболее распространенными являются бумажные фильтры. Когда целью фильтрования является выделение твердого осадка, фильтрование проводят через простой (гладкий) фильтр.
Рис. 7. Приготовление фильтра
Простой фильтр готовят из квадратного куска фильтровальной бумаги, перегибая его дважды: сначала по одной, а затем по другой пунктирной линии. Образовавшийся малый квадрат обрезают ножницами по дуге с таким расчетом, чтобы готовый фильтр был на 3-4 мм меньше воронки. Приготовленный фильтр развертывают в конус и помещают его в воронку так, чтобы он плотно прилегал к стенкам воронки. Затем воронку помещают в кольцо штатива, подставляют под нее стакан, наливают в воронку немного дистиллированной воды и дают ей стечь
При фильтровании, не взмучивая осадка, сливают жидкость по стеклянной палочке на фильтр. В стакан с осадком вливают небольшое количество чистого растворителя, перемешивают с осадком и снова осторожно сливают жидкость по палочке на фильтр. Такая операция называется декантацией. После нескольких декантаций последнюю порцию растворителя перемешивают с осадком и сливают по палочке на фильтр. Когда вся жидкость стечет, промывают осадок на фильтре 2-3 раза чистым растворителем.
Если целью фильтрования является получение жидкости, освобожденной от механических примесей, то применяют складчатый фильтр. Для его изготовления простой фильтр раскрывают и складывают по радиусу то в одну, то в другую сторону так, чтобы получилась гармоника, которую расправляют и вставляют в воронку.
При фильтровании сливают взмученную жидкость вместе с осадком по стеклянной палочке на фильтр.
Мытье посуды.
Химическая посуда перед проведением опыта должна быть тщательно вымыта. Вначале ее промывают водопроводной водой; если при этом загрязнения не удаляются, нужно применить специальную щетку-ёрш. Ни в коем случае не разрешается мыть посуду водой с песком, так как на стекле могут появиться царапины, вследствие чего оно теряет свою прочность.
Удалить загрязнения можно и химическим путем - промыванием посуды хромовой смесью. Это обеспечивает хорошую смачиваемость стекла. После промывания посуды хромовую смесь выливают обратно в склянку (но не в водопроводную раковину), посуду тщательно моют водопроводной водой, а затем 2-3 раза ополаскивают дистиллированной. Иногда для мытья посуды применяют спиртовой раствор щелочи.
Химическую посуду никогда не вытирают полотенцем изнутри, в случае надобности ее высушивание производят в сушильном шкафу (кроме мерной посуды, которую никогда не высушивают нагреванием).
Самостоятельная работа студента.
Вопросы для подготовки.
1. Предмет и задачи общей и неорганической химии. Роль химии в фармацевтическом образовании.
2. Классификация дисперсных систем. Растворы. Способы выражения концентрации растворов (массовая доля растворенного вещества, молярная концентрация, мольная доля и объемная доля растворенного вещества).
3. Номенклатура неорганических веществ.
Решить задачи.
1. В каком объеме воды следует растворить 10 г КОН для получения 1% раствора.
2. В каких соотношениях надо взять 50%-ный и 5%-ный раствор серной кислоты для приготовления 20%-ного раствора.
3. К 500 мл 30%-ного раствора NaOH (ρ = 1.328 г/см3) прибавлено 250 мл 14%-ного раствора NaOH (ρ = 1.153 г/см3). Определить процентную концентрацию полученного раствора и его плотность.
4. Какой объем 35% раствора H3PO4 (ρ = 1.216 г/см3) требуется для приготовления 10 л 1% раствора H3PO4.
5. Из 6%-ного раствора NaCl (ρ = 1.041 г/см3), приготовить 5 кг 0.86% раствора. Рассчитать молярную концентрацию приготовленного раствора.
6. Из 12% раствора CaCl2 (ρ = 1.066 г/см3), приготовить 2 кг 2.8% раствора. Рассчитать молярную концентрацию и моляльность приготовленного раствора.
7. Из 12% раствора CaCl2 (ρ = 1.066 г/см3), приготовить 500 г 1.5% раствора. Рассчитать нормальность приготовленного раствора (ρ = 1.02 г/см3).
8. Из 20% раствора аммиака (ρ = 0.923 г/см3), приготовить 500 г 2.5% раствора. Рассчитать молярную концентрацию приготовленного раствора.
Обучающие задачи.
Задача 1.
Приготовить 250 мл 8% раствора сульфата натрия ρ = 1.072 г/см3, исходя из кристаллогидрата Na2SO4·10H2O.
Решение:
Раствором называется гомогенная система, состоящая из двух и более компонентов, относительные количества которых могут изменяться. Чаще всего приходится иметь дело с жидкими растворами, в которых одним из компонентов является вода.
Между растворенным веществом и растворителем часто образуются химические соединения. В большинстве случаев эти соединения нестойкие, но существуют вещества, которые выделяются из водных растворов в виде кристаллов, содержащих кристаллизационную воду, причем на каждую молекулу растворенного вещества приходится определенное число молекул воды. Такие соединения называются кристаллогидратами.
Состав кристаллогидратов принято изображать формулами, показывающими, какое количество кристаллизационной воды содержит кристаллогидрат. В нашем случае, кристаллогидрат сульфата натрия, содержащий на один моль сульфата натрия десять молей воды выражается формулой Na2SO4·10 H2O.
Широкое распространение получили тривиальные названия веществ. В таблице 1 приведены наиболее часто встречающиеся формулы кристаллогидратов, их тривиальные названия и названия по систематической номенклатуре, рекомендованной ИЮПАК.
Таблица 1
Кристаллогидраты, их тривиальные названия и названия по систематической номенклатуре
|
Кристаллогидрат |
Тривиальное название |
Название по систематической номенклатуре |
|
2CaSO4·H2O |
Алебастр, жженый гипс |
Гидрат сульфата кальция |
|
MgSO4·7 H2O |
Английская соль, горькая соль |
Гептагидрат сульфата магния |
|
Na2B4O7·10H2O |
Бура |
Декагидрат тетрабората натрия |
|
ZnSO4·7 H2O |
Белый купорос, цинковый купорос |
Гептагидрат сульфата цинка |
|
Na2SO4·10 H2O |
Глауберова соль |
Декагидрат сульфата натрия |
|
FeSO4·7 H2O |
Железный купорос, зеленый купорос |
Гептагидрат сульфата железа (II) |
|
CuSO4·5 H2O |
Медный купорос, синий купорос, синий камень |
Пентагидрат сульфата меди (II) |
|
SiO2·n H2O |
Силикагель |
Полигидрат оксида кремния |
Чтобы приготовить раствор сульфата натрия вычисляем сколько граммов Na2SO4 содержится в 250 мл 8% раствора:
ω (Na2SO4) =
m р-ра = V р-ра· ρ, тогда
m (Na2SO4) = =
= 21.44 г
В задаче предложено приготовить раствор из навески кристаллогидрата, поэтому пересчитываем массу с учетом кристаллизационной воды:
М (Na2SO4) = 142 г/моль.
М (Na2SO4·10H2O) = 322 г/моль.
m(Na2SO4·10H2O) = =
= 48.62 г
Взвешиваем рассчитанную навеску на весах и количественно переносим ее в мерную колбу на 250 мл. Растворяем соль в небольшом количестве дистиллированной воды, затем доводим водой объем до метки и перемешиваем. Раствор готов.
Задача 2.
Рассчитать количество железа в 100 мл крови. Среднее содержанние железа в крови принять за 20 мкмоль/л.
Решение:
Количество моль вещества (n) в растворе определяется по формуле:
n = c·V,
где с - молярная концентрация раствора, моль/л;
V – объем раствора, л.
Для расчета количества железа сделаем перевод в соответствии с требованиями системы СИ (см. прил., табл. №1).
Международная система единиц — СИ (System internation) представляет собой единую универсальную систему единиц, внедренную во все отрасли науки и техники. Единицей количества вещества установлен моль. Кратные приставки:
м (милли) - 10-3
мк (микро) - 10-6
н (нано) - 10-9.
Результаты лабораторных исследований также выражаются в СИ. В качестве примера кратных приставок в табл.2 приведены результаты лабораторных исследований биохимических показателей крови.
Таблица 2
Биохимические показатели крови
|
Содержание вещества |
Старые единицы |
Единицы СИ |
|
Железо (Fe) |
80-180 мкг % |
мкмоль/л |
|
Калий (К) |
14-18 мг % |
ммоль/л |
|
Кальций (Са) |
9-11 мг % |
ммоль/л |
|
Медь (Сu) |
70-150 мкг % |
мкмоль/л |
|
Аммиак (NH3) |
30-80 мкг % |
мкмоль/л |
|
Мочевина (CN2H4O) |
15-50 мг % |
ммоль/л |
|
Глюкоза (C6H12O6) |
60-110 мг % |
ммоль/л |
|
Витамин А (М = 328 г/моль) |
21-47 мкг % |
мкмоль/л |
|
Витамин В12 (М = 1355 г/моль) |
28-55 нг % |
нмоль/л |
|
Витамин С (М = 176 г/моль) |
0.62-88 мг % |
ммоль/л |
c(Fe) = 20 мкмоль/л·10-6 = 2·10-5 моль/л.
Vр-ра = 100 мл·10-3 = 0.1 л, тогда
n(Fe) = 2·10-5 моль/л· 0.1 л = 2·10-6 моль.
Ответ: в 100 мл крови содержится 2·10-6 моль железа.
Задача 3.
В лаборатории имеются растворы с массовой долей гидроксида калия 20% и 30%. Какую массу каждого раствора надо взять для получения раствора с массовой долей соли 22% массой 500 г.
Решение:
В лабораторной практике часто возникает потребность в приготовлении растворов исходя из уже приготовленных путем смешивания или разбавления водой.
Эту задачу можно решить двумя способами.
I способ:
Вводим обозначения:
m = 500 г
ω1 (КОН) = 0.2 (20%)
ω2 (КОН) = 0.3 (30%)
ω (КОН) = 0.22 (22%)
Из определения массовой доли следует:
ω1 (КОН) = , 0.2 =
ω2 (КОН) = , 0.3 =
,
тогда m1 (КОН) = 0.2·m1, m2 (КОН) = 0.3·m2.
Масса КОН в растворе, который надо приготовить составляет:
m (КОН) = m1 (КОН) + m2 (КОН), тогда
m (КОН) = 0.2·m1 + 0.3·m2.
Для раствора с ω (КОН) = 22% записываем:
ω (КОН) = , 0.22 =
.
Отсюда следует:
0.22 · 500 = 0.2·m1 + 0.3·m2,
110 = 0.2·m1 + 0.3·m2, где
m1 и m2 – массы растворов с ω1 (КОН) и ω2 (КОН) соответственно, которые необходимо взять.
Находим массу раствора, который надо приготовить:
m = m1 + m2 = 500.
Решаем систему уравнений:
110 = 0.2·m1 + 0.3·m2
500 = m1 + m2
Находим: m1 = 400 г,
m2 = 100 г.
II способ: по правилу смешения.
Записываем друг под другом массовые доли исходных растворов, а правее между ними массовую долю раствора, который необходимо приготовить:
0.3 \
0.22
0.2 ⁄
Из большей массовой доли вычитаем заданную и записываем результат внизу; из заданной массовой доли вычитаем меньшую и записываем результат вверху:
0.3 \ ⁄ 0.02
0.22
0.2 ⁄ \ 0.08
Числа 0.02 и 0.08 показывают в каком массовом отношении надо взять растворы с ω2 (КОН) = 0.3 (30%) и ω1 (КОН) = 0.2 (20%) соответственно.
Таким образом, масса раствора с ω2 (КОН) = 0.3 составляет
m2 = =
= 100 г.
Определяем массу раствора с ω1 (КОН) = 0.2.
m1 = =
= 400 г.
Ответ: для приготовления раствора нужно взять 400 г 20%-ного раствора КОН и 100 г 30%-ного раствора КОН.
Литература.
Основная:
1. Глинка Н.Л. Общая химия. Учебное пособие. М.: Кнорус, 2016.- с.37-43
2. Общая химия. Биофизическая химия. Химия биогенных элементов/ Под ред. Ю.А. Ершова. М.: Высшая школа, 2007. – с. 42-49
Дополнительная:
1. Оганесян Э.Т. Неорганическая химия. М.: Высшая школа, 1984. с. 119-121.
2. Растворы: уч.пособие/Линева А.Н., Красильникова Е.В.- Новгород: ПИМУ, 2018.-100с.
Просмотр содержимого документа
«Предмет и задачи общей и неорганической химии. Растворы. Способы выражения концентрации растворов»
Предмет и задачи общей и неорганической химии. Растворы. Способы выражения концентрации растворов
Цели занятия:
- формирование представлений о месте химии в современной научной картине мира, важности изучения законов и теорий общей и неорганической химии, которые являются фундаментом для освоения других естественнонаучных, специальных и профессиональных дисциплин,
- сформировать представления о растворах, способах выражения концентрации растворов,
- ознакомление с медико-биологическим значением воды и биологических жидкостей, значение растворов для медицины и фармации,
- формирование навыков безопасной работы в химической лаборатории, формирование навыков работы с научной и справочной литературой, подготовки рефератов и выступления с сообщениями по ним,
- ведение дискуссий.
Знать:
- правила работы и технику безопасности в химической лаборатории,
- номенклатуру основных классов неорганических соединений,
- классификацию дисперсных систем,
- физико-химические свойства воды. Вода — важнейший растворитель,
- способы выражения концентрации веществ в растворах.
Уметь:
- производить расчеты, используя знания единиц концентрации в растворах,
- обращаться с химической посудой,
- рассчитывать концентрацию растворов (массовую долю, моляльность, молярную концентрацию раствора).
Содержание занятия.
1. Определение исходного уровня знаний студентов по химии.
2. Практическая часть. Содержание раздела.
Введение. Техника безопасности и правила работы в химической лаборатории. Номенклатура неорганических соединений: адаптированный и неадаптированный варианты номенклатуры ИЮПАК; фармакопейная номенклатура неорганических лекарственных веществ, международные непатентованные названия лекарственных веществ неорганической природы (МНН). Ознакомление с химической посудой.
Правила техники безопасности при работе в химической лаборатории.
Работа в химической лаборатории требует определенных правил поведения и соблюдения техники безопасности.
Работа с небольшими количествами химических веществ снижает возможность несчастных случаев до минимума, но не исключает их полностью. Поэтому каждому работающему в химической лаборатории нужно знать и строго соблюдать все правила техники безопасности.
1. При всех работах следует соблюдать осторожность, учитывая, что неаккуратность, невнимательность, недостаточное знакомство со свойствами веществ, с которыми ведется работа, могут повлечь за собой несчастный случай.
2. При работе с металлическим натрием, калием и литием нельзя допускать соприкосновения их с водой, так как образующийся водород воспламеняется и взрывается. При попадании щелочных металлов на кожный покров и слизистую оболочку образуются тяжелые ожоги.
Едкие щелочи и концентрированные кислоты, попадая на кожу, также вызывают ожоги. Особенно опасно поражение глаз.
3. Смыв концентрированных кислот и щелочей осуществляется под сильной струей воды. Разлитые концентрированные кислоты и щелочи необходимо засыпать песком, после чего производить уборку.
При попадании на кожу концентрированной кислоты или щелочи нужно сильной струей воды промыть место ожога, после чего обработать 0,5% раствором соды (при ожоге кислотой) и борной кислотой, разбавленным раствором уксусной или лимонной кислоты — при ожоге щелочью.
4. Растворять серную кислоту в воде следует, приливая кислоту к воде по каплям, постоянно перемешивая раствор, а не наоборот!
При мытье посуды хромовой смесью необходимо остерегаться попадания смеси на кожу, одежду, обувь.
5. Если при проведении опыта разбился термометр и разлилась ртуть, нужно собрать ее при помощи специальной ловушки или груши. Мельчайшие частицы ртути собираются кисточкой из белой жести. Поверхность стола или пола, на которой была ртуть, тщательно смачивают 20% раствором хлорида железа (III) или засыпают серой.
6. Нагревать жидкость в пробирке следует постепенно, направляя отверстие пробирки в сторону от себя и от работающих рядом товарищей, т.к. вследствие частичного перегрева может произойти выбрасывание жидкости.
7. Нельзя наклоняться над пробиркой, в которой кипит жидкость.
8. Нельзя вдыхать какие бы то ни было вещества в лаборатории, даже если количество вещества очень мало. Для того, чтобы понюхать вещество, следует движением руки направить к себе пары или газы.
9. Все опыты с дурно пахнущими, а также ядовитыми веществами (анилин, бром и др.) следует проводить в вытяжном шкафу.
10. Никаких веществ в лаборатории не пробовать на вкус.
11. При работе с газоотводной трубкой убирать горелку из-под пробирки с реакционной смесью можно лишь тогда, когда конец газоотводной трубки, опущенной в жидкость, удален из нее. Если убрать горелку до того, как газоотводная трубка удалена, жидкость засосет в раскаленную реакционную пробирку, и может произойти разбрызгивание реакционной смеси на лицо и руки.
12. Работу с легковоспламеняющимися жидкостями (эфир, бензол, ацетон, спирт и др.) проводить вдали от открытого огня. Нагрев их осуществляется на водяной или песчаной бане.
13. Отбор жидких веществ (растворы кислот, щелочей, солей тяжелых металлов, летучих веществ) производить специальной пипеткой (с грушей).
14. Перегонять и нагревать низкокипящие вещества (ацетон, бензол, эфиры, спирты и т.п.) следует в круглодонных колбах из тугоплавкого стекла на банях с соответствующим теплоносителем, в вытяжном шкафу, вдали от огня.
Правила поведения в химической лаборатории.
1. На лабораторные занятия студенты должны являться в халатах, медицинских шапочках и сменной обуви.
2. Все опыты следует проводить в чистой посуде. По окончании работы посуду вымыть и подготовить к следующему занятию.
3. Склянки с реактивами обязательно ставить на место и закрывать теми же пробками (пипетками), которыми они были закрыты. Запрещается переносить склянки с реактивами с одного стола на другой.
4. Книги и портфели, а также другие личные вещи студентов хранить в ящиках лабораторного стола.
5. В каждой группе поочередно выделяется ответственный дежурный на этом занятии. В его обязанности входит:
а) принести все необходимое для данного занятия из лаборантской;
б) следить за порядком в лаборатории;
в) в конце занятия у каждого студента принять рабочее место;
г) сдать лабораторию лаборанту.
Форма записи протокола лабораторной работы
1. Название темы лабораторной работы.
2. Краткое описание опытов.
3. Уравнения химических реакций.
4. Вычисления.
5. Выводы.
Ознакомление с химической посудой.
Для проведения различных опытов применяется специальная химическая посуда из тонкостенного или толстостенного лабораторного стекла. Посуда из тонкостенного стекла должна быть устойчива по отношению к химическому взаимодействию и к колебаниям температуры. Посуда, в которой проводятся реакции при нагревании, изготовляется из жаростойкого пирексного стекла и кварца.
Пирексное стекло содержит ~80% двуокиси кремния, ~5% щелочей и обладает низким коэффициентом расширения; посуда из него обладает высокой термической устойчивостью. Температура размягчения стекла около 620 °С.
Для проведения реакций при более высокой температуре химическая посуда изготовляется из кварцевого стекла. Кварцевое стекло содержит ~99,95% двуокиси кремния, отличается высокой термической стойкостью, инертностью по отношению к ряду химических реагентов (кроме плавиковой и фосфорной кислот).
Температура размягчения кварцевого стекла около 1650° С.
Стеклянная посуда.
Наиболее часто в химических лабораториях употребляется стеклянная посуда, изображённая на рис. 1.
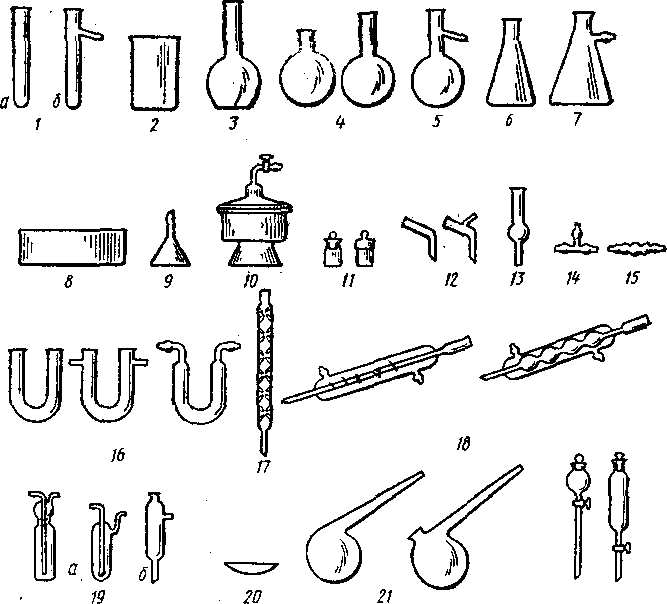
Рис. 1. Стеклянная посуда:
1а - пробирки, 1б - пробирки Вюрца, 2 - стаканы, 3 - колбы плоскодонные, 4 - колбы круглодонные, 5 - колбы Вюрца, 6- колбы конические, 7 - колба Бюнзена, 8 - кристаллизаторы, 9 - воронки, 10 - эксикаторы, 11 - бюксы, 12 - аллонжи, 13 - хлоркальциевые трубки, 14 - тройники, 15 - переходные трубки, 16 - U-образные трубки, 17 — дефлегматоры, 18 - холодильники, 19а - промывные склянки, 19б - осушительные колонки, 20 - часовые стёкла, 21 - реторты, 22 - капельные воронки
Фарфоровая посуда.
Кроме стеклянной посуды в лабораторной практике применяется фарфоровая посуда (рис. 2)

Рис. 2. Фарфоровая посуда:
1 — чашка, 2 — воронка Бюхнера, 3 — тигль с крышкой, 4 — ступка с пестиком, 5 - стакан, 6 — шпатель
Для работы с небольшими количествами веществ применяется химическая посуда малых размеров и емкостей, например, колбы ёмкостью 25, 10 мл; стаканы – 20, 10, 5 мл и т. д.
Мерная посуда.
В лабораторных работах по неорганической химии обычно используется следующая мерная посуда: колбы, пипетки, бюретки, мензурки.
Мерные колбы (рис. 3) служат для приготовления раствора точной концентрации и представляют собой плоскодонные колбы с длинным и узким горлом, на котором нанесена тонкая черта. Эта отметка показывает границу жидкости, которая при определенной температуре занимает указанный на колбе объем. Горло мерной колбы делают узким, поэтому сравнительно небольшое изменение объема жидкости в колбе заметно отражается на положении мениска. Мерные колбы имеют притёртые пробки. Обычно применяются колбы на 50, 100, 250, 500 и 1000 мл.
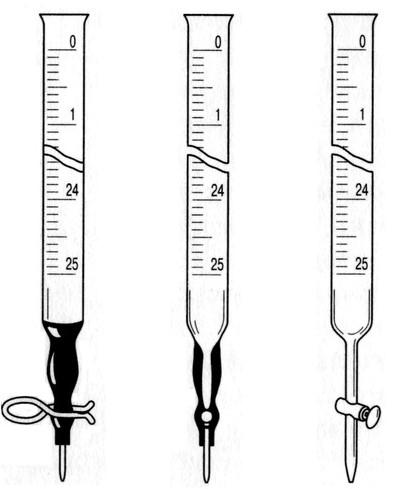

Рис. 3. Мерная колба Рис. 4. Пипетки Рис. 5. Бюретки
Пипетки служат для точного отмеривания определенного объема жидкости и представляют собой стеклянные цилиндрические, оттянутые сверху и снизу узкие трубки (рис. 4 а). В верхней части пипетки имеется отметка, показывающая, до какого уровня нужно заполнить снизу пипетку, чтобы вылитая из нее жидкость имела объем, указанный на пипетке. Чаще всего пользуются пипеткой емкостью 10 или 20 мл. Существуют измерительные пипетки, имеющие вид узкой градуированной трубки (рис. 4 б).
Бюретки (рис. 5) предназначены для выливания из них строго определенных объемов жидкости. Они представляют собой длинные стеклянные трубки, на которые нанесена шкала c делениями. Чаще всего пользуются бюретками емкостью 50 мл, градуированными на десятые доли миллилитра. В нижней части бюретки имеется кран или зажим. Иногда в бюретках нет крана, тогда на конец ее надевают отрезок резиновой трубки со стеклянным шариком внутри и стеклянной оттянутой внизу трубкой. Оттягивая пальцами резиновую трубку от шарика, можно спускать жидкость из бюретки. Необходимо следить за тем, чтобы оттянутый конец трубки был нацело заполнен сливаемой жидкостью.
Мерные градуированные цилиндры (рис. 6) применяются для грубого отмеривания жидкостей и бывают различных емкостей: 5, 10, 25, 50, 100, 150, 250, 500, 1000 и 2000 мл.
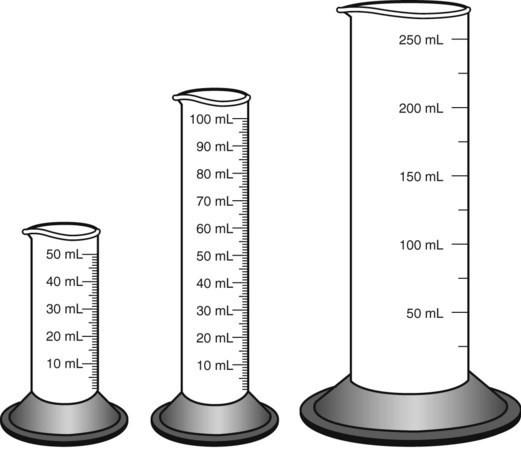
Рис. 6. Мерные цилиндры
Правила работы с пипеткой.
Для наполнения нижний конец пипетки опускают в жидкость до дна сосуда. С помощью груши набирают жидкость, следя, чтобы кончик пипетки все время находился в жидкости. Жидкость набирают так, чтобы она поднялась на 2 - 3 см выше метки, затем быстро закрывают верхнее отверстие указательным пальцем, придерживая в то же время пипетку большим и средним пальцами. Затем ослабляют нажим указательного пальца, в результате чего жидкость медленно вытекает из пипетки; как только нижний мениск жидкости опустится до метки, палец снова прижимают. Если на конце пипетки остается капля, ее следует осторожно удалить. Введя пипетку в сосуд, в который нужно перенести жидкость, отнимают указательный палец и дают жидкости стечь по стенке сосуда. После того как жидкость стечет, пипетку держат еще несколько секунд прислоненной к стенке сосуда, слегка поворачивая ее. Выдувать жидкость из пипетки не следует, так как пипетка отградуирована с учетом оставшейся в ней капли.
Правила работы с бюреткой.
Бюретку заполняют жидкостью через воронку, при этом должен быть заполнен и стеклянный капилляр. Для вытекания жидкости резиновую трубку оттягивают от бусины. Если в капилляре остается пузырек воздуха, резиновую трубку изгибают так, чтобы кончик капилляра был направлен вверх, и вытесняют жидкостью весь воздух. Перед началом работы уровень жидкости в бюретке должен быть установлен на нулевом делении. Для этого наливают жидкость в бюретку на 2-3 см выше нулевого деления, а затем снимают воронку и сливают избыток жидкости.
Уровень прозрачных растворов устанавливают по нижнему краю мениска, непрозрачных - по верхнему. При отсчете по бюретке глаз наблюдателя должен находиться в одной плоскости с уровнем жидкости .
Фильтрование
Фильтрование - процесс механического разделения твердых и жидких компонентов смеси. Сущность фильтрования состоит в том, что жидкость с находящимися в ней частицами твердого вещества пропускают через фильтр, задерживающий твердую фазу. Наиболее распространенными являются бумажные фильтры. Когда целью фильтрования является выделение твердого осадка, фильтрование проводят через простой (гладкий) фильтр.
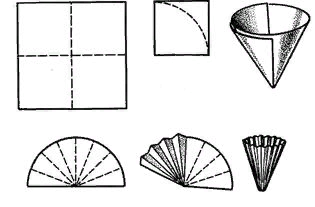
Рис. 7. Приготовление фильтра
Простой фильтр готовят из квадратного куска фильтровальной бумаги, перегибая его дважды: сначала по одной, а затем по другой пунктирной линии. Образовавшийся малый квадрат обрезают ножницами по дуге с таким расчетом, чтобы готовый фильтр был на 3-4 мм меньше воронки. Приготовленный фильтр развертывают в конус и помещают его в воронку так, чтобы он плотно прилегал к стенкам воронки. Затем воронку помещают в кольцо штатива, подставляют под нее стакан, наливают в воронку немного дистиллированной воды и дают ей стечь
При фильтровании, не взмучивая осадка, сливают жидкость по стеклянной палочке на фильтр. В стакан с осадком вливают небольшое количество чистого растворителя, перемешивают с осадком и снова осторожно сливают жидкость по палочке на фильтр. Такая операция называется декантацией. После нескольких декантаций последнюю порцию растворителя перемешивают с осадком и сливают по палочке на фильтр. Когда вся жидкость стечет, промывают осадок на фильтре 2-3 раза чистым растворителем.
Если целью фильтрования является получение жидкости, освобожденной от механических примесей, то применяют складчатый фильтр. Для его изготовления простой фильтр раскрывают и складывают по радиусу то в одну, то в другую сторону так, чтобы получилась гармоника, которую расправляют и вставляют в воронку.
При фильтровании сливают взмученную жидкость вместе с осадком по стеклянной палочке на фильтр.
Мытье посуды.
Химическая посуда перед проведением опыта должна быть тщательно вымыта. Вначале ее промывают водопроводной водой; если при этом загрязнения не удаляются, нужно применить специальную щетку-ёрш. Ни в коем случае не разрешается мыть посуду водой с песком, так как на стекле могут появиться царапины, вследствие чего оно теряет свою прочность.
Удалить загрязнения можно и химическим путем - промыванием посуды хромовой смесью. Это обеспечивает хорошую смачиваемость стекла. После промывания посуды хромовую смесь выливают обратно в склянку (но не в водопроводную раковину), посуду тщательно моют водопроводной водой, а затем 2-3 раза ополаскивают дистиллированной. Иногда для мытья посуды применяют спиртовой раствор щелочи.
Химическую посуду никогда не вытирают полотенцем изнутри, в случае надобности ее высушивание производят в сушильном шкафу (кроме мерной посуды, которую никогда не высушивают нагреванием).
Самостоятельная работа студента.
Вопросы для подготовки.
1. Предмет и задачи общей и неорганической химии. Роль химии в фармацевтическом образовании.
2. Классификация дисперсных систем. Растворы. Способы выражения концентрации растворов (массовая доля растворенного вещества, молярная концентрация, мольная доля и объемная доля растворенного вещества).
3. Номенклатура неорганических веществ.
Решить задачи.
1. В каком объеме воды следует растворить 10 г КОН для получения 1% раствора.
2. В каких соотношениях надо взять 50%-ный и 5%-ный раствор серной кислоты для приготовления 20%-ного раствора.
3. К 500 мл 30%-ного раствора NaOH (ρ = 1.328 г/см3) прибавлено 250 мл 14%-ного раствора NaOH (ρ = 1.153 г/см3). Определить процентную концентрацию полученного раствора и его плотность.
4. Какой объем 35% раствора H3PO4 (ρ = 1.216 г/см3) требуется для приготовления 10 л 1% раствора H3PO4.
5. Из 6%-ного раствора NaCl (ρ = 1.041 г/см3), приготовить 5 кг 0.86% раствора. Рассчитать молярную концентрацию приготовленного раствора.
6. Из 12% раствора CaCl2 (ρ = 1.066 г/см3), приготовить 2 кг 2.8% раствора. Рассчитать молярную концентрацию и моляльность приготовленного раствора.
7. Из 12% раствора CaCl2 (ρ = 1.066 г/см3), приготовить 500 г 1.5% раствора. Рассчитать нормальность приготовленного раствора (ρ = 1.02 г/см3).
8. Из 20% раствора аммиака (ρ = 0.923 г/см3), приготовить 500 г 2.5% раствора. Рассчитать молярную концентрацию приготовленного раствора.
Обучающие задачи.
Задача 1.
Приготовить 250 мл 8% раствора сульфата натрия ρ = 1.072 г/см3, исходя из кристаллогидрата Na2SO4·10H2O.
Решение:
Раствором называется гомогенная система, состоящая из двух и более компонентов, относительные количества которых могут изменяться. Чаще всего приходится иметь дело с жидкими растворами, в которых одним из компонентов является вода.
Между растворенным веществом и растворителем часто образуются химические соединения. В большинстве случаев эти соединения нестойкие, но существуют вещества, которые выделяются из водных растворов в виде кристаллов, содержащих кристаллизационную воду, причем на каждую молекулу растворенного вещества приходится определенное число молекул воды. Такие соединения называются кристаллогидратами.
Состав кристаллогидратов принято изображать формулами, показывающими, какое количество кристаллизационной воды содержит кристаллогидрат. В нашем случае, кристаллогидрат сульфата натрия, содержащий на один моль сульфата натрия десять молей воды выражается формулой Na2SO4·10 H2O.
Широкое распространение получили тривиальные названия веществ. В таблице 1 приведены наиболее часто встречающиеся формулы кристаллогидратов, их тривиальные названия и названия по систематической номенклатуре, рекомендованной ИЮПАК.
Таблица 1
Кристаллогидраты, их тривиальные названия и названия по систематической номенклатуре
| Кристаллогидрат | Тривиальное название | Название по систематической номенклатуре |
| 2CaSO4·H2O | Алебастр, жженый гипс | Гидрат сульфата кальция |
| MgSO4·7 H2O | Английская соль, горькая соль | Гептагидрат сульфата магния |
| Na2B4O7·10H2O | Бура | Декагидрат тетрабората натрия |
| ZnSO4·7 H2O | Белый купорос, цинковый купорос | Гептагидрат сульфата цинка |
| Na2SO4·10 H2O | Глауберова соль | Декагидрат сульфата натрия |
| FeSO4·7 H2O | Железный купорос, зеленый купорос | Гептагидрат сульфата железа (II) |
| CuSO4·5 H2O | Медный купорос, синий купорос, синий камень | Пентагидрат сульфата меди (II) |
| SiO2·n H2O | Силикагель | Полигидрат оксида кремния |
Чтобы приготовить раствор сульфата натрия вычисляем сколько граммов Na2SO4 содержится в 250 мл 8% раствора:
ω (Na2SO4) = ![]()
m р-ра = V р-ра· ρ, тогда
m (Na2SO4) = ![]() =
= ![]() = 21.44 г
= 21.44 г
В задаче предложено приготовить раствор из навески кристаллогидрата, поэтому пересчитываем массу с учетом кристаллизационной воды:
М (Na2SO4) = 142 г/моль.
М (Na2SO4·10H2O) = 322 г/моль.
m(Na2SO4·10H2O) = 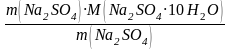 =
= ![]() = 48.62 г
= 48.62 г
Взвешиваем рассчитанную навеску на весах и количественно переносим ее в мерную колбу на 250 мл. Растворяем соль в небольшом количестве дистиллированной воды, затем доводим водой объем до метки и перемешиваем. Раствор готов.
Задача 2.
Рассчитать количество железа в 100 мл крови. Среднее содержанние железа в крови принять за 20 мкмоль/л.
Решение:
Количество моль вещества (n) в растворе определяется по формуле:
n = c·V,
где с - молярная концентрация раствора, моль/л;
V – объем раствора, л.
Для расчета количества железа сделаем перевод в соответствии с требованиями системы СИ (см. прил., табл. №1).
Международная система единиц — СИ (System internation) представляет собой единую универсальную систему единиц, внедренную во все отрасли науки и техники. Единицей количества вещества установлен моль. Кратные приставки:
м (милли) - 10-3
мк (микро) - 10-6
н (нано) - 10-9.
Результаты лабораторных исследований также выражаются в СИ. В качестве примера кратных приставок в табл.2 приведены результаты лабораторных исследований биохимических показателей крови.
Таблица 2
Биохимические показатели крови
| Содержание вещества | Старые единицы | Единицы СИ |
| Железо (Fe) | 80-180 мкг % | мкмоль/л |
| Калий (К) | 14-18 мг % | ммоль/л |
| Кальций (Са) | 9-11 мг % | ммоль/л |
| Медь (Сu) | 70-150 мкг % | мкмоль/л |
| Аммиак (NH3) | 30-80 мкг % | мкмоль/л |
| Мочевина (CN2H4O) | 15-50 мг % | ммоль/л |
| Глюкоза (C6H12O6) | 60-110 мг % | ммоль/л |
| Витамин А (М = 328 г/моль) | 21-47 мкг % | мкмоль/л |
| Витамин В12 (М = 1355 г/моль) | 28-55 нг % | нмоль/л |
| Витамин С (М = 176 г/моль) | 0.62-88 мг % | ммоль/л |
c(Fe) = 20 мкмоль/л·10-6 = 2·10-5 моль/л.
Vр-ра = 100 мл·10-3 = 0.1 л, тогда
n(Fe) = 2·10-5 моль/л· 0.1 л = 2·10-6 моль.
Ответ: в 100 мл крови содержится 2·10-6 моль железа.
Задача 3.
В лаборатории имеются растворы с массовой долей гидроксида калия 20% и 30%. Какую массу каждого раствора надо взять для получения раствора с массовой долей соли 22% массой 500 г.
Решение:
В лабораторной практике часто возникает потребность в приготовлении растворов исходя из уже приготовленных путем смешивания или разбавления водой.
Эту задачу можно решить двумя способами.
I способ:
Вводим обозначения:
m = 500 г
ω1 (КОН) = 0.2 (20%)
ω2 (КОН) = 0.3 (30%)
ω (КОН) = 0.22 (22%)
Из определения массовой доли следует:
ω1 (КОН) = ![]() , 0.2 =
, 0.2 = ![]()
ω2 (КОН) = ![]() , 0.3 =
, 0.3 = ![]() ,
,
тогда m1 (КОН) = 0.2·m1, m2 (КОН) = 0.3·m2.
Масса КОН в растворе, который надо приготовить составляет:
m (КОН) = m1 (КОН) + m2 (КОН), тогда
m (КОН) = 0.2·m1 + 0.3·m2.
Для раствора с ω (КОН) = 22% записываем:
ω (КОН) = ![]() , 0.22 =
, 0.22 = ![]() .
.
Отсюда следует:
0.22 · 500 = 0.2·m1 + 0.3·m2,
110 = 0.2·m1 + 0.3·m2, где
m1 и m2 – массы растворов с ω1 (КОН) и ω2 (КОН) соответственно, которые необходимо взять.
Находим массу раствора, который надо приготовить:
m = m1 + m2 = 500.
Решаем систему уравнений:
110 = 0.2·m1 + 0.3·m2
500 = m1 + m2
Находим: m1 = 400 г,
m2 = 100 г.
II способ: по правилу смешения.
Записываем друг под другом массовые доли исходных растворов, а правее между ними массовую долю раствора, который необходимо приготовить:
0.3 \
0.22
0.2 ⁄
Из большей массовой доли вычитаем заданную и записываем результат внизу; из заданной массовой доли вычитаем меньшую и записываем результат вверху:
0.3 \ ⁄ 0.02
0.22
0.2 ⁄ \ 0.08
Числа 0.02 и 0.08 показывают в каком массовом отношении надо взять растворы с ω2 (КОН) = 0.3 (30%) и ω1 (КОН) = 0.2 (20%) соответственно.
Таким образом, масса раствора с ω2 (КОН) = 0.3 составляет
m2 = ![]() =
= ![]() = 100 г.
= 100 г.
Определяем массу раствора с ω1 (КОН) = 0.2.
m1 = ![]() =
= ![]() = 400 г.
= 400 г.
Ответ: для приготовления раствора нужно взять 400 г 20%-ного раствора КОН и 100 г 30%-ного раствора КОН.
Литература.
Основная:
1. Глинка Н.Л. Общая химия. Учебное пособие. М.: Кнорус, 2016.- с.37-43
2. Общая химия. Биофизическая химия. Химия биогенных элементов/ Под ред. Ю.А. Ершова. М.: Высшая школа, 2007. – с. 42-49
Дополнительная:
1. Оганесян Э.Т. Неорганическая химия. М.: Высшая школа, 1984. с. 119-121.
2. Растворы: уч.пособие/Линева А.Н., Красильникова Е.В.- Новгород: ПИМУ, 2018.-100с.












