XII городская научно-исследовательская конференция
учащихся и студентов «Шаг в будущее»
Россия г. Новый Уренгой
Исследование природных индикаторов
секция: естественные науки и современный мир;
подсекция: химия и химические технологии
Автор: Натанюк Валерия Николаевна,
обучающаяся 9 г класса,
Муниципальное бюджетное
общеобразовательное учреждение
«средняя школа им. Д.И.Коротчаева»
города Новый Уренгой
Научный руководитель:
Смирнова Марина Юрьевна,
учитель биологии и химии,
Муниципальное бюджетное
общеобразовательное учреждение
«средняя школа им. Д.И.Коротчаева»
города Новый Уренгой
2017 г.
Исследование природных индикаторов
Натанюк Валерия
ЯНАО, г. Новый Уренгой, Муниципальное бюджетное общеобразовательное учреждение
«средняя школа им. Д.И.Коротчаева», 9 класс
Аннотация.
В быту мы постоянно контактируем с различными веществами, которые нас окружают. Мне стало интересно, а содержатся ли в привычных для нас веществах кислоты или щелочи. Чтобы это изучить, нужны вещества – индикаторы. На уроках химии я узнала, что соки ярко окрашенных ягод, плодов и цветков обладают свойствами кислотно-основных индикаторов, то есть изменяют свою окраску при изменении кислотности среды. Это я решила проверить, изготовив растворы индикаторов из природного сырья.
Объект исследования: растворы природных индикаторов.
Предмет исследования: изменение окраски растворов природных индикаторов в зависимости от Hp среды.
Гипотеза: если отвары растений имеют яркий цвет, то их можно использовать в качестве индикаторов.
Цель: приготовить растворы растительных индикаторов из природного сырья и сравнить их с синтетическими индикаторами.
Задачи:
-
изучение литературы по данной теме;
-
рассмотреть классификацию индикаторов;
-
изготовить растворы индикаторов из природного сырья;
-
провести исследование по определению самого точного индикатора;
-
сравнить действие природных и химических индикаторов;
-
поделиться информацией с учениками.
Заключение
Таким образом, в ходе исследования гипотеза полностью подтвердилась. Задачи исследования выполнены. Проведя научно-исследовательскую работу, пришли к следующим выводам:
Многие растительные пигменты меняют свой цвет в зависимости от кислотности среды и могут служить индикаторами. Чем ярче окраска, тем точнее определение рН. Экспериментальным путем было доказано, что точность определения рН индикатором из свеклы сходна с точностью универсального индикатора. Сырьем для изготовления растворов растительных индикаторов может быть - плоды, корнеплоды, лепестки цветов.
Содержание
1.Введение_________________________________________________ 4
2. Обзор научной литературы__________________________________ 5
2.1. История открытия____________________________________ 5
2.2. Классификация индикаторов ___________________________5
2.3. Описание индикаторов ________________________________6
2.4 Водородный показатель________________________________8
3. Практическая часть _________________________________________8
Эксперимент 1___________________________________________8
Эксперимент 2___________________________________________9
Эксперимент 3 __________________________________________10
4. Заключение________________________________________________10
5. Список использованной литературы __________________________ 11
Приложение _______________________________________________12
1. Введение
В быту мы постоянно контактируем с различными веществами, которые нас окружают. Мне стало интересно, а содержатся ли в привычных для нас веществах кислоты или щелочи. Чтобы это изучить, нужны вещества – индикаторы. На уроках химии я узнала, что соки ярко окрашенных ягод, плодов и цветков обладают свойствами кислотно-основных индикаторов, то есть изменяют свою окраску при изменении кислотности среды. Это я решила проверить, изготовив растворы индикаторов из природного сырья.
На уроках при изучении темы: «Важнейшие классы неорганических соединений» мы на практике использовала такие индикаторы как лакмус, фенолфталеин и метилоранж. Но на самом деле индикаторов намного больше, чем в обычной школьной лаборатории.
Индикаторы (от английского indicate с греческого “указывать”) - это вещества, которые изменяют свой цвет в зависимости от среды раствора. С помощью индикаторов можно определить среду любого раствора.
Я решила выяснить: можно ли в качестве индикаторов использовать те природные материалы, которые встречаются дома.
Объект исследования: растворы природных индикаторов.
Предмет исследования: изменение окраски растворов природных индикаторов в зависимости от Hp среды.
Гипотеза: если отвары растений имеют яркий цвет, то их можно использовать в качестве индикаторов.
Цель: приготовить растворы растительных индикаторов из природного сырья и сравнить их с синтетическими индикаторами.
Задачи:
-
изучение литературы по данной теме;
-
рассмотреть классификацию индикаторов;
-
изготовить растворы индикаторов из природного сырья;
-
провести исследование по определению самого точного индикатора;
-
сравнить действие природных и химических индикаторов;
-
поделиться информацией с учениками.
Используемые методы исследования:
1.Изучение научной литературы.
2.Качественный анализ.
3.Эмпирический (наблюдение).
4. Сравнительный анализ.
Практическая значимость работы состоит в том, что данные, полученные в результате исследования, могут быть использованы как в повседневной жизни, так и на уроках биологии и химии, занятиях биологического или химического кружка, факультативах, элективных курсах, внеклассных мероприятиях.
Актуальность: на основании проведенных исследований можно судить о пригодности использования отваров растительного сырья для примерной оценки величины рН, что актуально в случае отсутствия специального оборудования. По окраске растений и её
интенсивности, возможно, определить наличие избытка кислот или щелочей в атмосферном воздухе, почве и др.
2.Обзор научной литературы
2. 1. История открытия.
Впервые индикаторы обнаружил в 17 веке английский физик и химик Роберт Бойль. Бойль проводил различные опыты. Однажды, когда он проводил очередное исследование, зашел садовник. Он принес фиалки. Бойль любил цветы, но ему необходимо было проводить эксперимент. Бойль оставил цветы на столе. Когда ученый закончил свой опыт он случайно посмотрел на цветы, они дымились. Чтобы спасти цветы, он опустил их в стакан с водой. И – что за чудеса- фиалки, их темно- фиолетовые лепестки, стали красными. Бойль заинтересовался и проводил опыты с растворами, при этом каждый раз добавлял фиалки и наблюдал, что происходит с цветками. В некоторых стаканах цветы немедленно начали краснеть. Ученый понял, что цвет фиалок зависит от того, какой раствор находится в стакане, какие вещества содержатся в растворе. Лучшие результаты дали опыты с лакмусовым лишайником. Бойль опустил в настой лакмусового лишайника обыкновенные бумажные полоски. Дождался, когда они пропитаются настоем, а затем высушил их. Эти хитрые бумажки Роберт Бойль назвал индикаторами, что в переводе с латинского означает «указатель», так как они указывают на среду раствора. Именно индикаторы помогли ученому открыть новую кислоту - фосфорную, которую он получил при сжигании фосфора и растворении образовавшегося белого продукта в воде. В настоящее время на практике широко применяют следующие индикаторы: лакмус, фенолфталеин, метиловый оранжевый.
2.2. Классификация индикаторов
Одни из самых распространенных – кислотно-основные индикаторы, изменяющие цвет в зависимости от кислотности раствора. Происходит это потому, что в кислой и щелочной среде молекулы индикаторов имеют разное строение. Примером может служить общеизвестный индикатор фенолфталеин. В кислой среде это соединение находится в виде недиссоциированных молекул и раствор бесцветен, а в щелочной среде – в виде ионов и раствор имеет малиновый цвет.
Окислительно-восстановительные индикаторы изменяют свой цвет в зависимости от того, что присутствует в растворе окислитель или восстановитель. Такими индикаторами служат вещества, которые сами подвергаются окислению или восстановлению, причем окисленная и восстановленная формы имеют разные окраски. Например, окисленная форма дифениламина имеет фиолетовую окраску, а восстановленная – бесцветную.
Широкое распространение получили комплексонометрические индикаторы – вещества, образующие с ионами металлов окрашенные комплексные соединения.
Некоторые вещества, адсорбируются на поверхности осадка, изменяя его окраску; такиеиндикаторы называются адсорбционными. Адсорбционные индикаторы - вещества, способные адсорбироваться на поверхности осадка и менять при этом окраску или интенсивность люминесценции. Эти индикаторы, как правило, обратимы и используются в осадительном титровании. В первую очередь осадком адсорбируются ионы, идентичные тем, которые входят в состав самого осадка, после чего адсорбируются индикаторы. Большая группа индикаторов - красители, адсорбирующиеся поверхностью осадка с образованием солей с ионами, содержащимися в осадке.
При определении среды мутных или окрашенных растворов, в которых практически невозможно заметить изменение окраски обычных кислотно-основных индикаторов, используют флуоресцентные индикаторы. Они светятся (флуоресцируют) разным цветом в зависимости от рН раствора. При этом важно, что свечение индикатора не зависит от прозрачности и собственной окраски раствора. При отсутствии фабричных химических индикаторов для определения среды растворов можно успешно применять самодельные индикаторы из природного сырья.
2.3. Описание индикаторов
Синтетическими индикаторами являются: лакмус, фенолфталеин Метиловый оранжевый
Фенолфталеин (продается в аптеке под названием "пурген") - белый или белый со слегка желтоватым оттенком мелкокристаллический порошок. Растворим в 95 % спирте, практически нерастворим в воде. Бесцветный фенолфталеин в кислой и нейтральной среде бесцветен, а в щелочной среде окрасится в малиновый цвет. Поэтому фенолфталеин используется для определения щелочной среды.
Метиловый оранжевый - кристаллический порошок оранжевого цвета. Умеренно растворим в воде, легко растворим в горячей воде, практически нерастворим в органических растворителях. Переход окраски раствора от красной к желтой.
Лакмоид (лакмус) - порошок черного цвета. Растворим в воде, 95 % спирте, ацетоне, ледяной уксусной кислоте. Переход окраски раствора от красной к синей.
К универсальным индикаторам относятся и индикаторные бумажки.
Растительные индикаторы содержат окрашенные вещества, способные менять свой цвет в ответ на то или иное воздействие. Называются эти окрашенные вещества пигментами. Их окраска определяется избирательным поглощением света в видимой части солнечного спектра (см. таблица 1).
Таблица 1.
| Растительный пигмент | Окраска | Формула |
| Антоцианы. | Придают окраску в диапазоне от розовой, красной, сиреневой, до синей и тёмно-фиолетовой. | 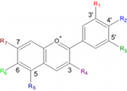
|
| Аротиноиды | Придаёт желтый, оранжевый или красный цвет | 
|
| Каротиноиды (каротин, ксантофилл). | Каротин - оранжево-красный цвет, жёлтую - ксантофилл. Содержатся в плодах томатов, апельсинов, мандаринов, в корне моркови. | 
|
| Меланин | Содержится в кожуре красных сортов винограда, лепестках некоторых цветков. | 
|
| Флавоны и флавонолы
| Содержится в плодах и цветах. Обеспечивает желтую цветовую гамму. | 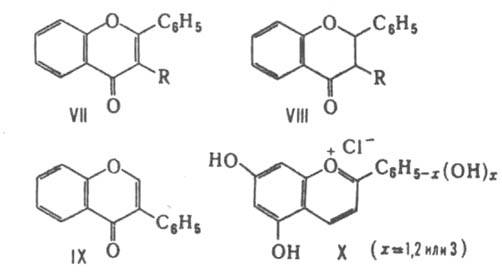
|
| Фитохром | Голубой растительный пигмент | 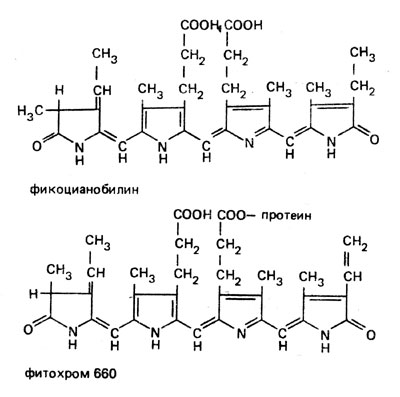
|
| Халконы | Краситель желтого цвета – близок к флавонам. Содержится в листьях и цветах кислицы, дымом, он покраснеет. | 
|
| Хлорофилл | Зелёный пигмент, обеспечивает окраску хлоропластов растений в зелёный цвет. | 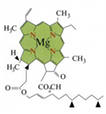
|
2.4. Окраска индикатора зависит от шкалы рН (водородного показателя).
Для определения характера среды используется рН-шкала. Термин рН образовался от датского слова potenz – степень и «Н» - символа водорода.
Численное значение водородного показателя (рН) в шкале от 0 до 14 (рис.1) характеризует концентрацию кислоты или щелочи в растворе. Значение 0 указывает на то, что раствор представляет собой сильную кислоту, среднее значение 7 соответствует нейтральному раствору, рН=14 имеют сильные основания, или щелочи. В нейтральном растворе при 25°С рН=7. В кислых растворах рН7, и тем больше, чем больше щёлочность раствора
рН
рН=7, среда считается нейтральной
рН7, чем больше показатель, тем сильнее основание
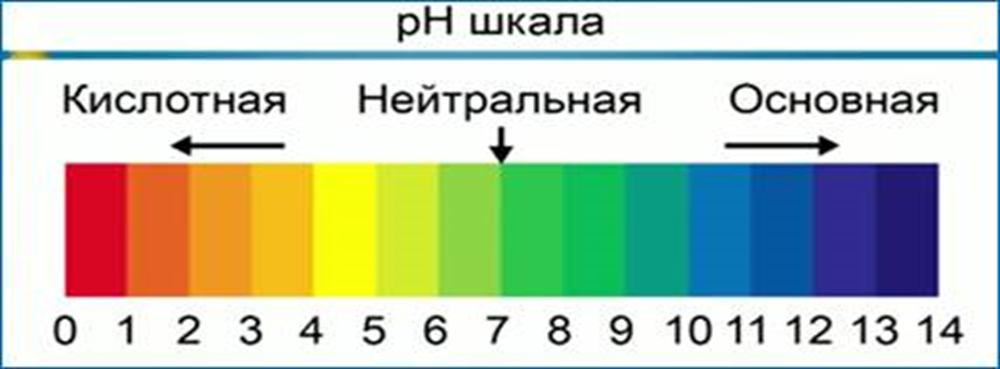
Рис.1. Численное значение водородного показателя (рН) по шкале от 1 до 14.
3. Практическая часть
3.1. Приготовление растворов индикаторов.
Для приготовления растительных индикаторов взяли по 10 г сырья, измельчили, залили 50 мл воды и прокипятили в течение 1-2 минут. Полученные отвары были охлаждены и профильтрованы. С целью предохранения от порчи, в полученный фильтрат добавили спирт в соотношении 2:1.
Получив, таким образом, растворы индикаторов, я определила, какую окраску они имеют (см. Приложение 1).
3.2. Эксперимент 1
Изучение изменения окраски природных индикаторов в кислотной и щелочной среде.
Для проверки индикаторных свойств полученных растворов приготовили 100г. 0,1 % раствора HCI и 100г. 0.1 % раствора КOH. рН данных растворов определяли по изменению цвета универсального индикатора. При добавлении нескольких капель полученных индикаторов в растворе HCI и КOH происходило изменение цвета природных индикаторов (см. Приложение 2). Результаты исследования занесены в таблицу (см. таблица 2)
Таблица 2.
Изучение изменения окраски природных индикаторов в кислотной и щелочной среде
| Природное сырье/индикаторы | кислотная среда | щелочная среда |
| свекла | ярко-красный | грязно-желтый |
| клюква | светло-красный | темно-зеленый |
|
|
|
|
| малина | бледно-розовый | бледно-коричневый |
|
|
|
|
| спатифиллиум | светло-болотный | бесцветный |
|
|
|
|
| морковь | бесцветный | желтого |
| лук | светло-желтый | грязно-коричневый |
| черника | ярко-бурый | темно-зеленый |
3.3. Эксперимент 2
Проведение опытов с природными и синтетическими индикаторами, кислотами и щелочами.
Для проверки индикаторных свойств растворов приготовили 100г. 0,1 % раствора HCI и 100г. 0.1 % раствора КOH. При добавлении нескольких капель полученных природных (отвар свеклы) и синтетических индикаторов в растворе HCI и КOH происходило изменение цвета индикаторов. Результаты исследования занесены в таблицу (см. таблица 3).
Таблица 3.
Сравнение изменения цвета природных и синтетических индикаторов в кислой и щелочной среде
| Среда/индикаторы | Химические индикаторы | Природные индикаторы | Универсальные индикаторы |
| Щелочная среда | синий | зеленый | фиолетовый |
| Кислотная среда | красный | красный | малиновый |
| Нейтральная | зеленый | Цвет раствора | болотный |
3.4. Эксперимент 3
Исследование различных бытовых вещества на наличие в их составе растворов щелочей или кислот.
Для опыта были взяты следующие бытовые вещества:
стиральный порошок «Tide»; средство для мытья посуды «AOS»; детский крем (гипоаллергенный); крем-мыло для рук «Весна»; мыло «Детское». При добавлении нескольких капель полученных природных и синтетических индикаторов в растворы бытовых средств происходило изменение цвета индикаторов (см. Приложение 3).
4. Заключение
Таким образом, в ходе исследования гипотеза полностью подтвердилась. Задачи исследования выполнены. Проведя научно-исследовательскую работу, пришли к следующим выводам:
Многие растительные пигменты меняют свой цвет в зависимости от кислотности среды и могут служить индикаторами. Чем ярче окраска, тем точнее определение рН. Экспериментальным путем было доказано, что точность определения рН индикатором из свеклы сходна с точностью универсального индикатора.
Результаты исследовательской работы можно использовать для определения рН (водородный показатель) различных растворов, например, молочных продуктов, сока, бульонов, лимонада и других, а также для определения кислотности почвы, для определения среды разных бытовых растворов: СМС, растворов мыла, зубной пасты, шампуня.
Проведя эту работу, наблюдается следующая закономерность – все данные природные объекты в кислотной среде преимущественно окрашиваются в красный цвет, а в щелочной среде – в зелено-желтый
Многие природные растения обладают свойствами кислотно-основных индикаторов, способных изменять свою окраску. Сырьем для изготовления растворов растительных индикаторов может быть - плоды, корнеплоды, лепестки цветов.
5. Список используемой литературы
1.А.А. Карцова. Химия без формул или знакомые незнакомцы.Авалон,Азбука-классика, СПб.-2005.
2.Байкова В.М. «Химия после уроков». 1976г. Стр. 90-95.
3. Ветчинский К.М. Растительный индикатор.М.: Просвещение, 2002
Информация с http://vesvnorme.net/zdorovoe-pitanie/antociany.html
Информация с http://festival. 1september.ru.
Приложение 1
Этапы приготовления растворов природных индикаторов:

1. Очистить и порезать на мелкие части свёклу.

2. Потолочь в ступе пока не выделится сок.

3. Залить свёклу 50 граммами воды.

4. Закепитить даннный раствор.

5.Пропустить данный раствор через фильтровальную бумагу и дать остыть.

6.Остывший раствор налить в пробирки.

7.Чтобы индикаторы не испортились надо добавить спирт в отношение 2:1

Растворы приготовленных природных индикаторов (слева на право индикаторы: морковь, лук, черника, спатифиллиум, малина, клюква, свёкла).
Приложение 2.
1.Изменение цвета природных индикаторов в кислой среде


(слева на право: растворы свеклы, клюквы, малины, спатифиллиума, морковь, лука желтого, черники).
2.Изменение цвета природных индикаторов в щелочной среде.


(слева на право: растворы свеклы, клюквы, малины, спатифиллиума, морковь, лука желтого, черники).
Приложение 3.
1.Материалы опыта с моющими средствами.
 (слева на право: используемые бытовые вещества: стиральный порошок «Tide», средство для мытья посуды «AOS» , детский крем (гипоаллергенный), крем-мыло для рук «Весна», мыло «Детское»)
(слева на право: используемые бытовые вещества: стиральный порошок «Tide», средство для мытья посуды «AOS» , детский крем (гипоаллергенный), крем-мыло для рук «Весна», мыло «Детское»)
2.Изменение цвета растворов после добавления индикатора - отвар свёклы.

(слева на право: стиральный порошок «Tide», средство для мытья посуды «AOS» , детский крем (гипоаллергенный), крем-мыло для рук «Весна», мыло «Детское»)
Исследование природных индикаторов
Натанюк Валерия
ЯНАО, г. Новый Уренгой, Муниципальное бюджетное общеобразовательное учреждение
«средняя школа им. Д.И.Коротчаева», 9 класс
Краткая аннотация
Многие растительные пигменты меняют свой цвет в зависимости от кислотности среды и могут служить индикаторами. Чем ярче окраска, тем точнее определение рН. В данной работе предпринята попытка приготовления и изучения природных индикаторов. Экспериментальным путем было доказано, что точность определения рН индикатором из свеклы сходна с точностью универсального индикатора. Сырьем для изготовления растворов растительных индикаторов могут быть ярко окрашенные - плоды, корнеплоды, лепестки цветов и другие части растений.
14




























 (слева на право: используемые бытовые вещества: стиральный порошок «Tide», средство для мытья посуды «AOS» , детский крем (гипоаллергенный), крем-мыло для рук «Весна», мыло «Детское»)
(слева на право: используемые бытовые вещества: стиральный порошок «Tide», средство для мытья посуды «AOS» , детский крем (гипоаллергенный), крем-мыло для рук «Весна», мыло «Детское»)



















