
Носители электрических зарядов. Элементарный заряд. Строение атома
8 класс

Проверка домашнего задания
- Что является источником электрического поля?
- Как можно экспериментально обнаружить электрическое поле?
- Какая физическая величина является характеристикой электрического поля?
- Каков её физический смысл?
- Какова единица напряжённости электрического поля?
- Как опытным путём определить направление напряжённости электрического поля?
- Найти напряженность электрического поля на расстоянии 1м от заряженного тела, если величина заряда равна 3,2 Кл.
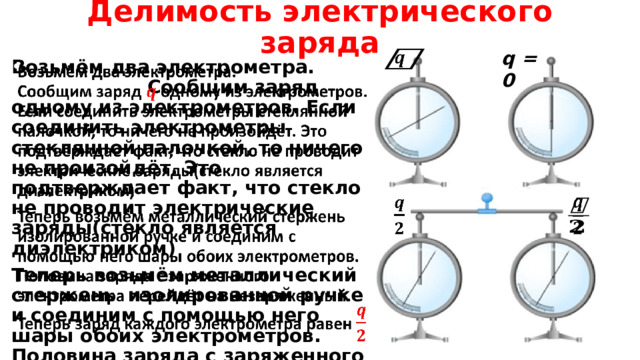
Делимость электрического заряда
q = 0
Возьмём два электрометра. Сообщим заряд одному из электрометров. Если соединить электрометры стеклянной палочкой, то ничего не произойдёт. Это подтверждает факт, что стекло не проводит электрические заряды(стекло является диэлектриком)
Теперь возьмём металлический стержень изолированной ручке и соединим с помощью него шары обоих электрометров. Половина заряда с заряженного электрометра перейдёт на незаряженный. Теперь заряд каждого электрометра равен
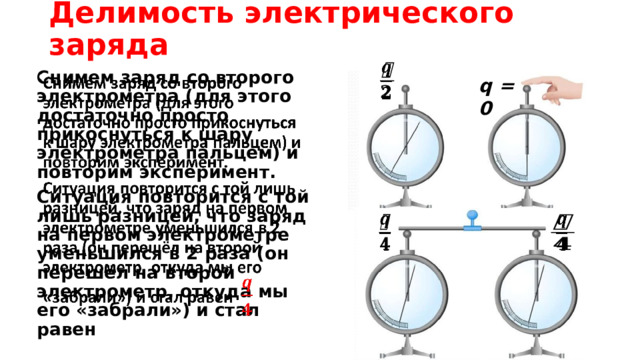
Делимость электрического заряда
Снимем заряд со второго электрометра (для этого достаточно просто прикоснуться к шару электрометра пальцем) и повторим эксперимент.
Ситуация повторится с той лишь разницей, что заряд на первом электрометре уменьшился в 2 раза (он перешёл на второй электрометр, откуда мы его «забрали») и стал равен
q = 0
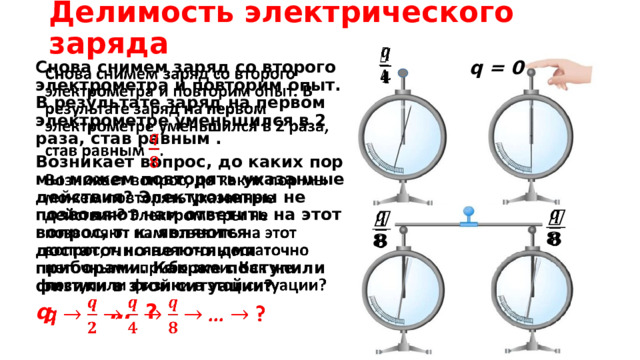
Делимость электрического заряда
q = 0
Cнова снимем заряд со второго электрометра и повторим опыт. В результате заряд на первом электрометре уменьшился в 2 раза, став равным .
Возникает вопрос, до каких пор мы можем повторять указанные действия? Электрометры не позволяют нам ответить на этот вопрос, т. к. являются достаточно неточными приборами. Как же поступили физики в этой ситуации?
q … ?

Р. Э. Милликен (1868 - 1953), США
А. Ф. Иоффе (1880 - 1960), Россия
Абрам Фёдорович Иоффе и Роберт Эндрюс Милликен независимо друг от друга сумели доказать, что существует предел деления заряда и определить величину этого минимального заряда в 1910 – 1911 г.
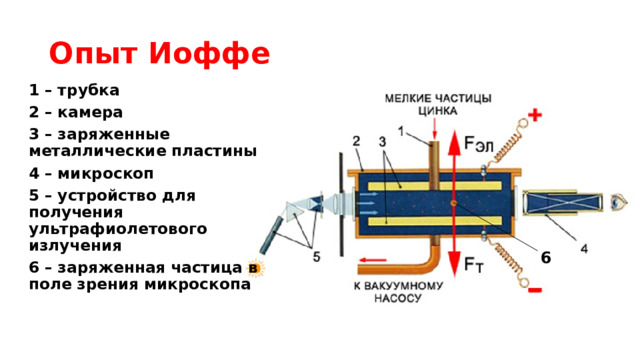
Опыт Иоффе
1 – трубка
2 – камера
3 – заряженные металлические пластины
4 – микроскоп
5 – устройство для получения ультрафиолетового излучения
6 – заряженная частица в поле зрения микроскопа
6
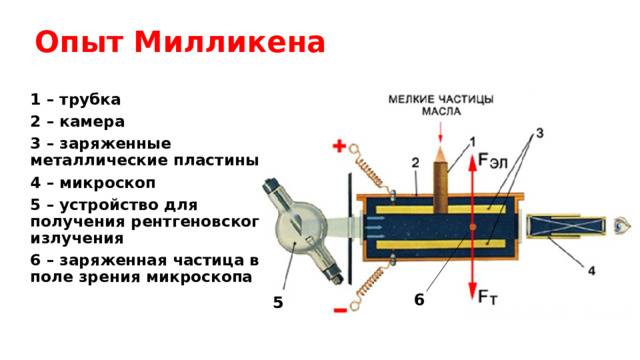
Опыт Милликена
1 – трубка
2 – камера
3 – заряженные металлические пластины
4 – микроскоп
5 – устройство для получения рентгеновского излучения
6 – заряженная частица в поле зрения микроскопа
6
5

Элементарный электрический заряд
В результате опытов Иоффе и Милликена стало известно, что в природе существует минимальный отрицательный электрический заряд.
Носитель наименьшего по модулю отрицательного заряда - электрон .
е = - 1,6 - заряд электрона.
Носитель наименьшего по модулю положительного заряда – протон .
е = 1,6 - заряд протона.
Самый маленький в природе электрический заряд - элементарный.
е = 1,6 – элементарный электрический заряд.

Джозеф Джон Томсон
Электрон открыл Дж. Дж. Томсон в 1896 г.
- е = - 1,6 - заряд электрона.
= 9,1 – масса электрона
Заряд электрона нельзя разделить или отнять.
Все остальные заряды кратны заряду электрона.
Например, заряд не может быть равен - 0,5е или -1,2е.
Джозеф Джон Томсон
(1856 — 1940гг.)
британский физик

Модель атома Томсона
В 1903г. - Дж. Дж. Томсон выдвинул гипотезу о том, что электрон находится внутри атома. Но атом в целом нейтральный, поэтому ученый предположил, что отрицательные электроны окружены в атоме положительно заряженным веществом.
Атом, по мысли Дж. Томсона, очень похож на «пудинг с изюмом», где «каша» - положительно заряженное вещество атома., а электроны – «изюм» в ней.

Эрнест Резерфорд
Протон открыл Эрнест Резерфорд в 1919 году.
е = 1,6 - заряд протона.
= 1,6726 · 10⁻²⁷ кг – масса протона.
Заряд протона нельзя разделить или отнять.
Эрнест Резерфорд (1871 – 1937гг.)
новозеландский физик
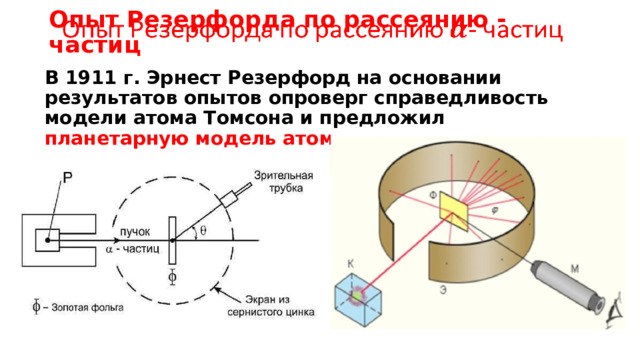
Опыт Резерфорда по рассеянию - частиц
В 1911 г. Эрнест Резерфорд на основании результатов опытов опроверг справедливость модели атома Томсона и предложил планетарную модель атома .

Модель атома Резерфорда
электрон
ядро
Атом состоит из положительно заряженного ядра и электронов.
Заряд ядра по модулю равен суммарному заряду электронов.
Заряд атома равен 0 (атом нейтрален).
= Ze - заряд ядра, где
е = 1,6 – элементарный заряд;
Z – порядковый номер химического элемента в таблице Менделеева = число электронов в атоме.

Число электронов на энергетических уровнях
Число электронов в атоме равно порядковому номеру химического элемента Z в таблице Менделеева. Максимальное число электронов на каждом энергетическом уровне определяется формулой:
= 2, где
— общее число электронов на энергетическом уровне, n — номер уровня.
На первом уровне может быть до 2 электронов, на втором уровне - до 8 электронов, на третьем - до 18 электронов, а на четвёртом - до 32 электронов.
3
2
1

Джеймс Чедвик
Элементарную частицу, не имеющую электрического заряда - нейтрон открыл английский физик Джеймс Чедвик в 1932 году.
- заряд нейтрона.
= 1,6749 · 10⁻²⁷ кг – масса нейтрона.
Джеймс Чедвик
(1891-1974)

Создатели протонно-нейтронной модели ядра
Советский физик Д. Д. Иваненко и немецкий ученый В. Гейзенберг в 1932 г. независимо друг от друга предложили протонно-нейтронную модель ядра. Она была подтверждена последующими исследованиями ядерных превращений и в настоящее время является общепризнанной.
В. Гейзенберг
Д. Д. Иваненко

Протонно-нейтронная модель ядра
Ядра состоят из элементарных частиц двух видов — протонов и нейтронов .
Z - число протонов в ядре (равно атомному номеру элемента в периодической системе элементов Д. И. Менделеева)
N – число нейтронов в ядре
A = Z + N – массовое число(равно числу протонов и нейтронов в ядре).
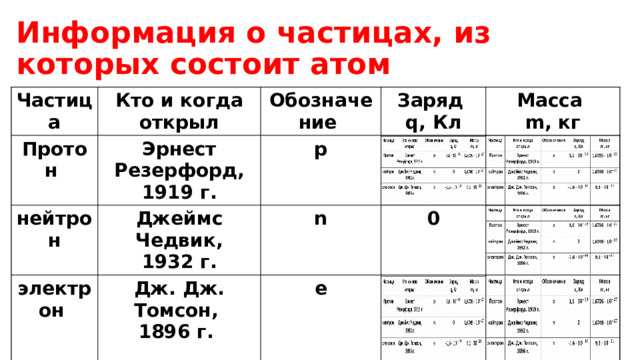
Информация о частицах, из которых состоит атом
Частица
Частица
Кто и когда открыл
Кто и когда открыл
Протон
Протон
Обозначение
нейтрон
Эрнест Резерфорд, 1919 г.
Эрнест Резерфорд, 1919 г.
Обозначение
нейтрон
Заряд
Джеймс Чедвик,
Джеймс Чедвик,
Заряд
электрон
p
p
электрон
q, Кл
q, Кл
1932 г.
1932 г.
n
n
1,6
Дж. Дж. Томсон,
Масса
Масса
Дж. Дж. Томсон,
0
1896 г.
m, кг
m, кг
0
1896 г.
e
e
1,6726
-1,6
1,6749
9,1

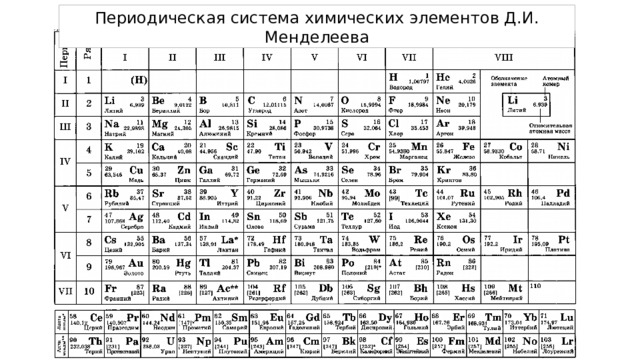
Определение количества протонов и электронов в атоме.
порядковый номер
!
Количество протонов и электронов в атоме всегда совпадает с порядковым номером химического элемента в таблице Менделеева.
Количество нейтронов в ядре атома может не совпадать с количеством протонов.
Такие разновидности атомов с одинаковым числом протонов, но с разным количеством нейтронов, называются изотопами
Cu
медь
29
63,546
относительная атомная масса
Периодическая система химических элементов Д.И. Менделеева
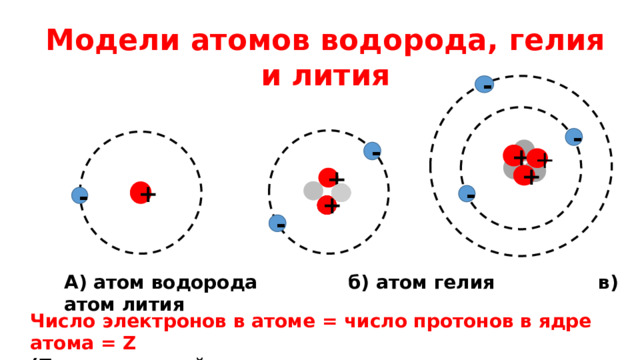
Модели атомов водорода, гелия и лития
-
-
-
+
+
+
+
+
-
+
-
-
А) атом водорода б) атом гелия в) атом лития
Число электронов в атоме = число протонов в ядре атома = Z
(Z - порядковый номер химического элемента в таблице Менделеева)
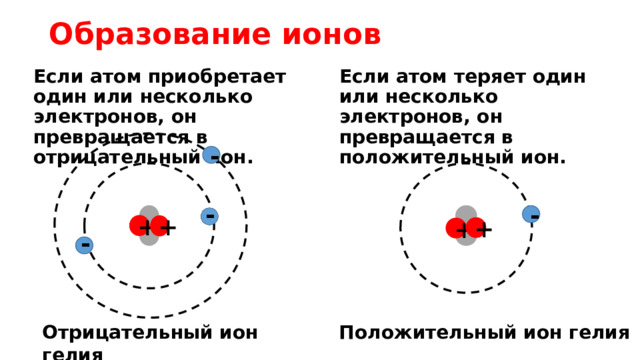
Образование ионов
Если атом теряет один или несколько электронов, он превращается в положительный ион.
Если атом приобретает один или несколько электронов, он превращается в отрицательный ион.
-
-
-
+
+
+
+
-
Отрицательный ион гелия
Положительный ион гелия

Задача 1.
Перед тобой один из элементов периодической системы элементов (таблицы Менделеева). Определи:
1. Название химического элемента.
2. Порядковый номер химического элемента
3. Относительную атомную массу химического элемента(округлить до целого числа)
35
79,904
Br
Бром

Задача 2
Перед тобой один из элементов периодической системы элементов (таблицы Менделеева). Ответь на вопросы:
- Какое число показывает, сколько электронов имеет атом данного вещества?
А) порядковый номер;
Б) разность относительной атомной массы и порядкового номера;
В) относительная атомная масса.
2. Сколько электронов имеет данный атом?
31
69,72
Ga
Галлий

Задача 3
Известно, что атом кислорода электрически нейтрален, а в его ядре находится 16 частиц. Сколько в атоме кислорода протонов, нейтронов и электронов?

Задача 3
Известно, что атом кислорода электрически нейтрален, а в его ядре находится 16 частиц. Сколько в атоме кислорода протонов, нейтронов и электронов?
Решение: В таблице Менделеева кислород имеет порядковый номер 8. Значит, в нём 8 протонов. Поскольку атом электрически нейтрален, в нём должно быть 8 электронов, чтобы уравновесить заряд ядра. Нам дано, что в ядре 16 частиц. Т.к. 8 из них являются протонами, оставшиеся 8 — это нейтроны. Значит, в атоме кислорода 8 нейтронов и 8 протонов, которые формируют ядро, а вокруг этого ядра вращаются 8 электронов.
Ответ:8 протонов, 8 нейтронов и 8 электронов

Задача 4
Как называется атом кальция, который потерял 2 электрона? Каков заряд этого атома?

Задача 4
Как называется атом кальция, который потерял 2 электрона? Каков заряд этого атома?
Решение:
Для ответа на этот вопрос нам не нужна таблица Менделеева. Т.к. атом изначально нейтрален, то при потере электронов, он становится положительным ионом. Сколько бы ни было протонов в ядре, заряд каждого из них уравновешивается отрицательным зарядом электрона, за исключением двух, поскольку в атоме не хватает двух электронов. Поэтому заряд данного иона будет равен суммарному заряду двух протонов.
Ответ: положительный ион кальция.

Задача 5
Атом содержит 6 нейтронов и электрически нейтрален. Можно ли найти число протонов и электронов?

Задача 5
Атом содержит 6 нейтронов и электрически нейтрален. Можно ли найти число протонов и электронов?
Ответ: нет, потому что число протонов не всегда совпадает с числом нейтронов. Можно лишь сказать, что число протонов в этом атоме равно числу электронов, поскольку в противном случае, это был бы ион. Шесть нейтронов содержится в нормальном атоме углерода, но, 6 нейтронов могут находиться в некоторой разновидности атома гелия. Такие разновидности называются изотопами и часто являются радиоактивными. Подобные явления будут изучены подробнее в старших классах.
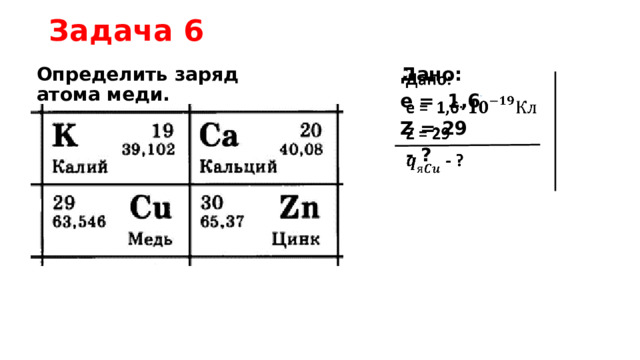
Задача 6
Определить заряд атома меди.
Дано:
е = 1,6
Z = 29
- ?
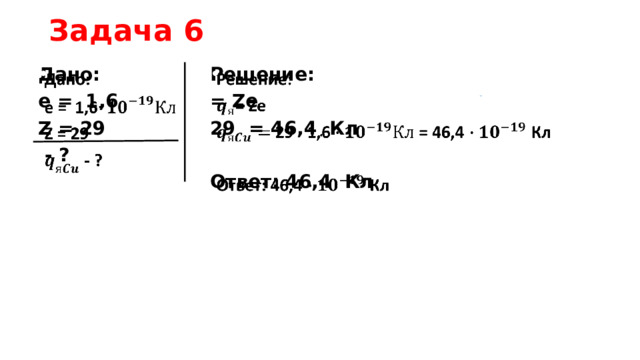
Задача 6
Дано:
Решение:
е = 1,6
= Ze
29 = 46,4 Кл
Z = 29
- ?
Ответ: 46,4 Кл
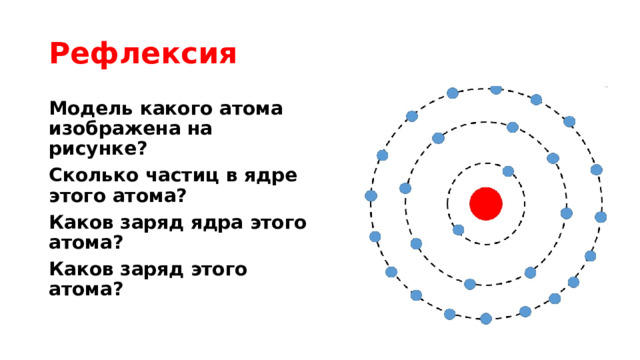
Рефлексия
Модель какого атома изображена на рисунке?
Сколько частиц в ядре этого атома?
Каков заряд ядра этого атома?
Каков заряд этого атома?

Домашнее задание
§ 30; 31 - прочитать, ответить на вопросы к параграфам;
Решить задачи:
1. В ядре атома углерода содержится 12 частиц. Вокруг ядра движутся 6 электронов. Сколько в ядре этого атома протонов и сколько нейтронов?
2. От атома гелия отделился один электрон. Как называется оставшаяся частица? Каков её заряд?
3. Существуют ли атомы с зарядом ядра меньшим, чем заряд протона?



























































