Тема: Объяснение происхождения линейчатых спектров. Цель урока:– познакомить учащихся со спектрами химических веществ и практическим применением спектрального анализа в астрофизике, химии и других отраслях.
Задачи урока:
Образовательные: сформировать понятия о видах спектров, спектральном анализе и его применении.
Развивающие: развивать представление о процессе научного познания, обеспечить развитие аналитических умений, применять знания в конкретных ситуациях.
Воспитательные: воспитание и формирование коммуникативных качеств, прививать культуру умственного труда, повышать познавательный интерес к предмету.
Тип урока: урок усвоения новых знаний.
Вид урока: урок дискуссия с элементами проблемного обучения.
Оборудование: оптическая доска, осветитель, рамка с щелью, линза, дифракционная решетка, полупрозрачный экран, ртутная лампа, растворы различных веществ, спектроскоп.
Демонстрации: наблюдение сплошного и линейчатых спектров при помощи аппарата ФОС и спектроскопа, получение их фотографий при помощи цифрового фотоаппарата и веб-камеры.
План урока
Ход урока
I. Организация класса. (1 мин)
Проверка наличия в классе учащихся. Готовность к уроку.
II. Актуализация опорных знаний (5 мин).
Вспомним предыдущие темы и ответим на вопросы.
Что такое свет? (поток электромагнитных волн с длиной волны 4*10-7–8*10-7м)
При каком условии электромагнитные волны излучаются? (Электромагнитные волны излучаются при ускоренном движении заряженных частиц)
Что необходимо сделать, чтобы атом излучал? (Для того чтобы атом начал излучал, ему необходимо передать определенную энергию)
Какие источники света вы знаете? (Естественные и искусственные, а они в свою очередь подразделяются на тепловые и люминесцирующие)
Охарактеризуйте тепловое излучение, электролюминесценцию, катодолюминесценцию, хемилюминесценцию, фотолюминесценцию.
Вспомните, что называют дисперсией? (Дисперсией называется зависимость показателя преломления среды от частоты световой волны)
Кто открыл явление дисперсии и какой опыт со светом поставил этот учёный? (Ньютон. Направил на призму световой пучок малого поперечного сечения. Падая на стеклянную призму, он преломлялся и давал на стене изображение с радужным чередованием цветов. Радужную полоску он назвал спектром.)
Выполняя лабораторную работу по определению длины световой волны, вы использовали замечательное устройство. Как оно называется? (дифракционная решётка). Что вы получали с помощью дифракционной решётки (радужную полоску-спектр)
III. Постановка учебной проблемы. Сообщение темы и цели урока. (3 мин).
Урок хотелось бы продолжить с сообщения об американском физике-экспериментаторе Роберте Вуде (сообщение учащегося).
Тема урока: «Спектры и спектральный анализ»
Цель урока:– познакомиться со спектрами химических веществ и практическим применением спектрального анализа в астрофизике, химии и других отраслях.
IV. Изучение нового материала. (18 мин)
1. Спектроскоп и спектрограф.
Для точного исследования спектров такие простые приспособления, как узкая щель, ограничивающая световой пучок, и призма, уже недостаточны. Необходимы приборы, дающие четкий спектр, т. е. приборы, хорошо разделяющие волны различной длины и не допускающие перекрытия отдельных участков спектра. Такие приборы называют спектральными аппаратами. Чаще всего основной частью спектрального аппарата является призма или дифракционная решетка.
Рассмотрим схему устройства призменного спектрального аппарата. Исследуемое излучение поступает вначале в часть прибора, называемую коллиматором (Слайд 4,5).
Коллиматор представляет собой трубу, на одном конце которой имеется ширма с узкой щелью, а на другом - собирающая линза. Щель находится на фокусном расстоянии от линзы. Поэтому расходящийся световой пучок, попадающий на линзу из щели, выходит из нее параллельным пучком и падает на призму.
Так как разным частотам соответствуют различные показатели преломления, то из призмы выходят параллельные пучки, не совпадающие по направлению. Они падают на линзу. На фокусном расстоянии этой линзы располагается экран -матовое стекло или фотопластинка. Линза фокусирует параллельные пучки лучей на экране, и вместо одного изображения щели получается целый ряд изображений. Каждой частоте (узкому спектральному интервалу) соответствует свое изображение. Все эти изображения вместе и образуют спектр.
Описанный прибор называется спектрографом. Если вместо второй линзы и экрана используется зрительная труба для визуального наблюдения спектров, то прибор называется спектроскопом. Призмы и другие детали спектральных аппаратов необязательно изготовляются из стекла. Вместо стекла применяются и такие прозрачные материалы, как кварц, каменная соль и др.
Спектральный состав излучения веществ весьма разнообразен. Но, несмотря на это, все спектры, как показывает опыт, можно разделить на три типа.
2. Виды спектров испускания (Слайд6).
Непрерывный (сплошной) спектры.
Эксперимент №1 по наблюдению спектра при помощи проекционного аппарата ФОС. (Слайд7)
Спектр можно получить, используя осветитель. Его световой поток пропускают через диафрагму с узкой щелью, объектив и дифракционную решётку или призму. Включим осветитель. Поместим за решёткой полупрозрачный экран. На экране наблюдается центральный дифракционный максимум. Он виден как белая полоса. Чуть дальше расположен максимум первого порядка. При использовании в осветителе лампы накаливания на экране наблюдается спектр. (Учащиеся наблюдают спектр).
Эксперимент №2 по наблюдению спектра при помощи спектроскопа
Направив узкую щель коллиматора на лампу накаливания, через зрительную трубу можно наблюдать спектр.
С помощью веб-камеры, компьютера и мультимедийного проектора спектр можно вывести на экран всему классу. Используя цифровой фотоаппарат, сфотографировать его.
Что же мы видим в наблюдаемых спектрах? Есть ли разрывы в данном спектре? (Слушаем ответы учащихся, а затем даём вместе понятие данного спектра).
В наблюдаемых спектрах мы видим все цвета радуги, то есть волны всех длин. В спектре нет разрывов и он представляет сплошную, непрерывную разноцветную полосу. Такие спектры называют непрерывными или сплошными.
Солнечный спектр или спектр дугового фонаря является непрерывным.
Непрерывные (или сплошные) спектры, как показывает опыт, дают тела, находящиеся в твердом или жидком состоянии, а также сильно сжатые газы. Для получения непрерывного спектра нужно нагреть тело до высокой температуры.
Характер непрерывного спектра и сам факт его существования определяются не только свойствами отдельных излучающих атомов, но и в сильной степени зависят от взаимодействия атомов друг с другом.
Непрерывный спектр дает также высокотемпературная плазма. Электромагнитные волны излучаются плазмой в основном при столкновении электронов с ионами.

Линейчатый спектр.
Эксперимент №1 по наблюдению линейчатого спектра при помощи проекционного аппарата ФОС.
Вместо лампы накаливания, воспользуемся осветителем, лампа которого излучает свет благодаря электрическому разряду в парах ртути. Наблюдается спектр в виде отдельных линий. Видны жёлтая, зелёная, синяя и фиолетовые линии спектра. (Слайд10) (Учащиеся наблюдают спектр).
Эксперимент №2 Внесем в бледное пламя газовой горелки кусочек асбеста, смоченного раствором обыкновенной поваренной соли. При наблюдении пламени в спектроскоп на фоне едва различимого непрерывного спектра пламени вспыхнет ярко желтая линия. Эту желтую линию дают пары натрия, которые образуются при расщеплении молекул поваренной соли в пламени. (Слайд11)
Эксперимент№3 Помещаем в генератор высоковольтный спектральные газоразрядные трубки с гелием, водородом, криптоном. Генератор подключаем к источнику питания. С помощью спектроскопа наблюдаем за спектрами. (Слайд12)
Что представляют спектры, которые вы наблюдали? (Слушаем ответы учащихся).
Каждый из спектров- это частокол цветных линий различной яркости, разделённых широкими тёмными полосами. Такие спектры называются линейчатыми. Наличие линейчатого спектра означает, что вещество излучает свет только вполне определенных длин волн (точнее, в определенных очень узких спектральных интервалах). Каждая из линий имеет конечную ширину.
Линейчатые спектры дают все вещества в газообразном атомарном (но не молекулярном) состоянии. В этом случае свет излучают атомы, которые практически не взаимодействуют друг с другом. Это самый фундаментальный, основной тип спектров.
Изолированные атомы данного химического элемента излучают строго определенные длины волн.
При увеличении плотности атомарного газа отдельные спектральные линии расширяются и, наконец при очень большой плотности газа, когда взаимодействие атомов становится существенным, эти линии перекрывают друг друга, образуя непрерывный спектр.
Линейчатые спектры представлены в учебнике рис.V,2,3,4 на цветной вклейке.
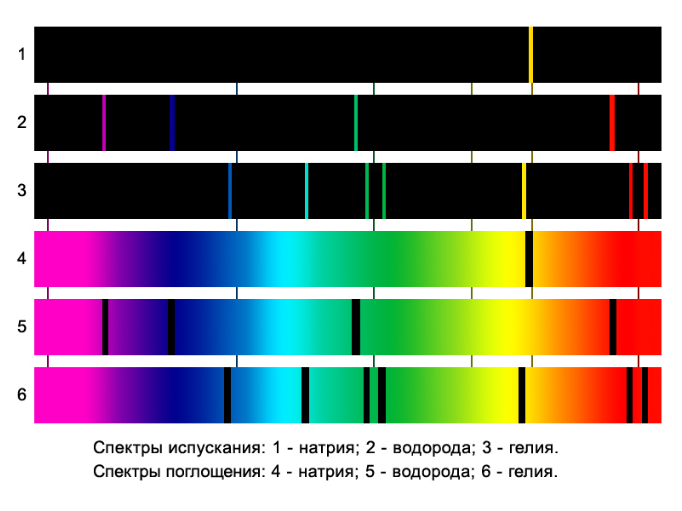
1-натрий; 2-водород; 3-гелий
Полосатые спектры.
Как вы думаете, чем отличаются спектры, которые излучаются атомами от молекулярных? (ответы учащихся) Для наблюдения молекулярных спектров так же, как и для наблюдения линейчатых спектров, обычно используют свечение паров в пламени или свечение газового разряда. (Слайд 14)
С помощью очень хорошего спектрального аппарата можно обнаружить, что каждая полоса представляет собой совокупность большого числа очень тесно расположенных линий, разделённых тёмными промежутками. Это полосатый спектр. В отличие от линейчатых спектров полосатые спектры создаются не атомами, а молекулами, не связанными или слабо связанными друг с другом.
3. Спектры поглощения. (Слайд 15)
Все вещества, атомы которых находятся в возбужденном состоянии, излучают световые волны, энергия которых определенным образом распределена по длинам волн. Поглощение света веществом также зависит от длины волны. Так, красное стекло пропускает волны, соответствующие красному свету и поглощает все остальные. Если пропускать белый свет сквозь холодный, неизлучающий газ, то на фоне непрерывного спектра источника появляются темные линии. Газ поглощает наиболее интенсивно свет как раз тех длин волн, которые он испускает в сильно нагретом состоянии. Темные линии на фоне непрерывного спектра - это линии поглощения, образующие в совокупности спектр поглощения.
Спектры поглощения представлены в учебнике рис.V,5-8 на цветной вклейке.


ФИЗМИНУТКА
4. Спектральный анализ
Линейчатые спектры играют особо важную роль, потому что их структура прямо связана со строением атома. Ведь эти спектры создаются атомами, не испытывающими внешних воздействий.
Главное свойство линейчатых спектров состоит в том, что длины волн (или частоты) линейчатого спектра какого-либо вещества зависят только от свойств атомов этого вещества, но совершенно не зависят от способа возбуждения свечения атомов. Атомы любого химического элемента дают спектр, не похожий на спектры всех других элементов: они способны излучать строго-определенный набор длин волн.
На этом основан спектральный анализ - метод определения химического состава вещества по его спектру. Подобно отпечаткам пальцев у людей линейчатые спектры имеют неповторимую индивидуальность. Неповторимость узоров на коже пальца помогает часто найти преступника. Точно так же благодаря индивидуальности спектров каждого атома химического элемента, имеется возможность определить химический состав тела. С помощью спектрального анализа можно обнаружить данный элемент в составе сложного вещества, если даже его масса не превышает 10-10г. Это очень чувствительный метод.
Количественное содержание элемента в исследуемом образце определяется путем сравнения интенсивности отдельных линий спектра этого элемента с интенсивностью линий другого химического элемента, количественное содержание которого в образце известно.
Количественный анализ состава вещества по его спектру затруднен, так как яркость спектральных линий зависит не только от массы вещества, но и от способа возбуждения свечения. Так, при низких температурах многие спектральные линии вообще не появляются. Однако при соблюдении стандартных условий возбуждения свечения можно проводить и количественный спектральный анализ.
В настоящее время определены спектры всех атомов и составлены таблицы спектров. С помощью спектрального анализа были открыты многие новые элементы: рубидий, цезий и др. Элементам часто давали названия в соответствии с цветом наиболее интенсивных линий спектра. Рубидий дает темно-красные, рубиновые линии. Слово цезий означает «небесно-голубой». Это цвет основных линий спектра цезия. (Слайд 17,18)
V. Закрепление первичных знаний (7 мин)
Вопросы по теме:
Какие виды спектров вы знаете?
Какой спектр называется спектром поглощения?
Что называют спектральным анализом?
Где применяется спектральный анализ?
Задания на экране. (выполнение заданий обучающего характера с последующей проверкой).
ФИЗМИНУТКА
VII. Итоги урока. Оценки. (3 минуты)
Сегодня мы с вами изучили тему «Спектры и спектральный анализ». Давайте возвратимся к началу урока и разгадаем загадку. Напомню вам её. Однажды Роберт Вуд заподозрил, что хозяйка пансиона добавляет объедки в свежие блюда для постояльцев. На следующий день изобличает хозяйку.
Как же это ему удалось? Как вы думаете, что использовал Роберт Вуд?
Ответ: Он всыпал в еду немного хлористого лития - безопасного для человеческого организма, а по виду и вкусу похожего на соль. На другой день спектральный анализ новой еды выдал красную линию, характерную для этого вещества. Подозрения Вуда подтвердились.
Молекулы и атомы излучают и поглощают свет определённых частот. Спектры эти можно наблюдать с помощью приборов невооруженным глазом, но существуют также невидимые лучи. На следующем занятии пойдёт речь об инфракрасном и ультрафиолетовом излучении.
Выставление оценок.
VIII. Домашнее задание (1 минута)
1. § 81-83 изучить параграфы, уметь отвечать на вопросы в конце параграфов
2. Подготовить сообщение:
а) применение спектрального анализа
б) история открытия спектрального анализа.




























