
Эпиграф урока :
«Мощь и сила науки во множестве фактов, цель – в обобщении этого множества». Д. И. Менделеев.
Девиз урока :
«Единственный путь, ведущий к знанию, - это деятельность» Б.Шоу.

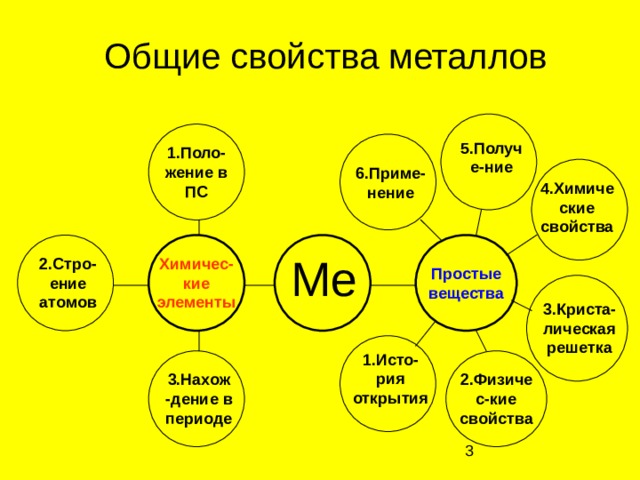
Общие свойства металлов
5.Получе-ние
1.Поло-жение в ПС
6.Приме-нение
4.Химические свойства
Me
Химичес-кие элементы
2.Стро-ение атомов
Простые вещества
3.Криста-лическая решетка
1.Исто-рия открытия
3.Нахож-дение в периоде
2.Физичес-кие свойства

Распространение металлов в земной коре
Другие металлы
2,1%
Mg
2,5%
K
2,6%
Na
3,4%
Ca
4,7%
Fe
8,8%
Al
 R (HeMe) Fr At 3. Ме° - n е Ме - ок-е О, +1, +2, +3 - низкие +4, +5, +6, +7, +8 - высокие 5.Изменение восстановительных свойств атомов Me в ПС В периоде причина: заряд ядра В главной n( е ) на внешнем слое подгруппе R а а + n 4. Ст. ок. Me причина R а а " width="640"
R (HeMe) Fr At 3. Ме° - n е Ме - ок-е О, +1, +2, +3 - низкие +4, +5, +6, +7, +8 - высокие 5.Изменение восстановительных свойств атомов Me в ПС В периоде причина: заряд ядра В главной n( е ) на внешнем слое подгруппе R а а + n 4. Ст. ок. Me причина R а а " width="640"
Характеристика химических элементов — металлов 1 . B 2. Me +? )…) от 1 до 3е
Исключение: Me главных
подгрупп IV-VII групп
R (Me)R (HeMe)
Fr At 3. Ме° - n е Ме - ок-е
О, +1, +2, +3 - низкие
+4, +5, +6, +7, +8 - высокие 5.Изменение восстановительных свойств атомов
Me в ПС
В периоде причина:
заряд ядра
В главной n( е ) на внешнем слое
подгруппе R
а
а
+ n
4. Ст. ок. Me
причина
R
а
а

Роль металлов
в организме человека

Химический состав организма человека
Рост – 170 см. Масса тела – 70 кг. Поверхность тела – 1,89 м2. Продолжительность жизни 70 лет.
Состав тела
Вещество
Масса, кг
Вода Белок Жир Углеводы Зола
% к массе тела
40–46 10 7 0,7 3,5
Химические элементы в клетках человека
Элемент
57–66 14 10 1 5
В % к сухой массе
Кислород Углерод Водород Азот Кальций Фосфор Калий Сера Натрий Хлор Магний Железо
Элемент
65 18 10 3 1,5 1 0,35 0,25 0,15 0,15 0,05 0,004
В % к сухой массе
Марганец Медь Йод Кобальт Цинк Молибден Никель Алюминий Барий Стронций Титан Литий
0,0003 0,0002 0,0004 Следы Следы Следы Следы Следы Следы Следы Следы Следы
Из данных таблицы видно, насколько разнообразны металлы, входящие в состав организма человека.

Химические элементы и их соединения, необходимые для нормальной жизнедеятельности организма в сравнительно больших количествах, называются макроэлементами , а элементы, требующиеся организмам в крайне малых количествах, – микроэлементами .
Макроэлементы, к которым относятся кальций, магний, натрий, калий, фосфор, сера и хлор , требуются организму в относительно больших количествах (порядка нескольких граммов в сутки). Часто они выполняют более чем одну функцию. Более непосредственное отношение к действию ферментов имеют незаменимые микроэлементы, суточная потребность в которых не превышает нескольких миллиграммов, т.е. сопоставима с потребностью в витаминах.

Значение железа для организма человека, как и в целом для живой природы, трудно переоценить.
Общая масса железа у взрослого мужчины составляет около 4,5 г,
у женщины — около 3 – 4 г.
Основная масса (около 75%) железа, составляющая 2,25 – 3 г, сосредоточена в гемоглобине.
Вне гемоглобина в эритроцитах содержится ничтожное количество железа
При нормальном содержании гемоглобина, составляющем 15 г/%, в 100 мл крови содержится 53,4 мг железа.
Вся масса крови содержит около 3 г железа. Остальную часть железа составляет железо миоглобина (мышечного гемоглобина) — от 300 до 600 мг и железо дыхательных ферментов — всего около 1 г.

Железо, депонированное в органах, главным образом в печени, составляет около 0,5 г. Суточная потребность взрослого человека в железе определяется масштабами физиологических процессов кроветворения и кроверазрушения. Распространенность дефицита железа свидетельствует о том, что количества железа, абсорбированного из пищи, часто недостаточно для покрытия потребности в нем практически здорового населения.
Очевидно, что металлы необходимы клеткам тела человека для нормальной жизнедеятельности.

Ионы кальция передают возбуждение на мышечное волокно, вызывая его сокращение, увеличивают силу сердечных сокращений, повышают фагоцитарную функцию лейкоцитов, активируют систему защитных белков крови, участвуют в её свёртывании.
Всасывание кальция происходит в переднем отделе тонкого кишечника. Усвоение кальция ухудшается при снижении кислотности в кишечнике и зависит от соотношения кальция, фосфора и жира в пище.
Оптимальные соотношения кальций/фосфор — в коровьем молоке (около 1,3).
В картофеле — 0,15, в бобах — 0,13, в мясе —0,016.
Оптимальные соотношения кальций/жир в пище человека — 0,04 – 0,08 г кальция на 1 г жира.
При избытке в пище фосфора и щавелевой кислоты всасывание кальция ухудшается. Желчные кислоты ускоряют его всасывание.
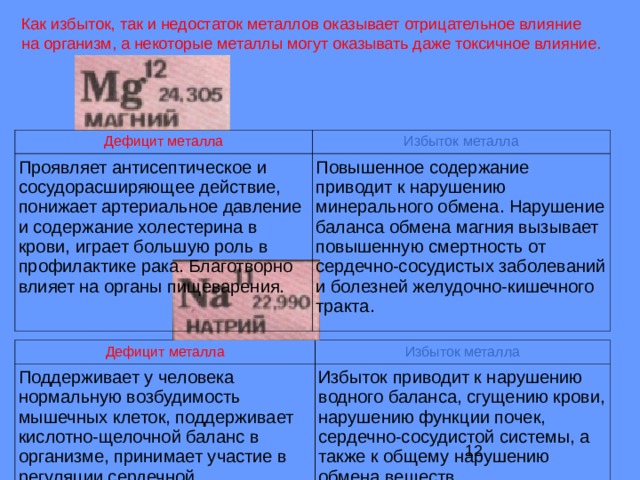
Как избыток, так и недостаток металлов оказывает отрицательное влияние на организм, а некоторые металлы могут оказывать даже токсичное влияние.
Дефицит металла
Избыток металла
Проявляет антисептическое и сосудорасширяющее действие, понижает артериальное давление и содержание холестерина в крови, играет большую роль в профилактике рака. Благотворно влияет на органы пищеварения.
Повышенное содержание приводит к нарушению минерального обмена. Нарушение баланса обмена магния вызывает повышенную смертность от сердечно-сосудистых заболеваний и болезней желудочно-кишечного тракта.
Дефицит металла
Поддерживает у человека нормальную возбудимость мышечных клеток, поддерживает кислотно-щелочной баланс в организме, принимает участие в регуляции сердечной деятельности (успокаивает), удерживает воду в организме.
Избыток металла
Избыток приводит к нарушению водного баланса, сгущению крови, нарушению функции почек, сердечно-сосудистой системы, а также к общему нарушению обмена веществ.

Дефицит металла
Регулирует белковый и углеводный обмен, влияют на процессы фотосинтеза и рост растений. Необходим для нормального функционирования всех мышц, особенно сердечной, способствует выделению избыточного натрия, избавляя организм от лишней воды и устраняя отеки.
Избыток металла
При избытке происходит усиление двигательной активности, нарушение сердечного ритма, нарушение углеводного, жирового и белкового обмена.

Дефицит металла
Избыток металла
Необходим для процессов кроветворения, обмена веществ, для уменьшения проницаемости сосудов, нормального роста скелета, благотворно влияет на состояние нервной системы, оказывает противовоспалительное действие.
При избытке кальция возникает цистит. Если кальций попадает в организм в виде цементной пыли, то страдают органы дыхания, у детей снижается возбудимость нервной системы и обонятельного анализатора.
Дефицит металла
Влияет на процесс образования костей.
Избыток металла
При избытке стронция поражаются костная ткань, печень, кровь; наблюдается повышенная ломкость костей, выпадение волос.
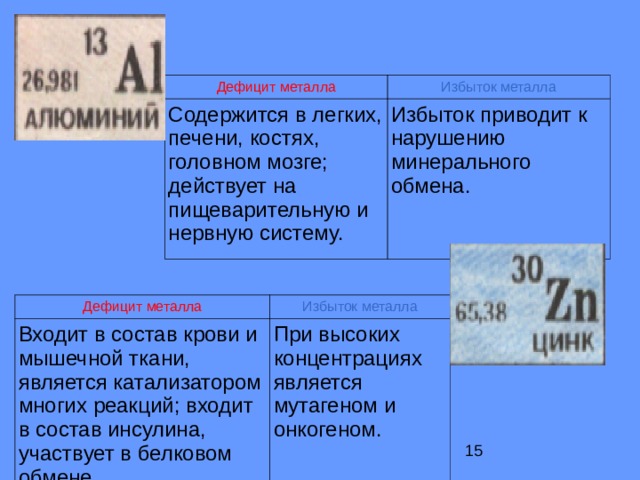
Дефицит металла
Избыток металла
Содержится в легких, печени, костях, головном мозге; действует на пищеварительную и нервную систему.
Избыток приводит к нарушению минерального обмена.
Дефицит металла
Входит в состав крови и мышечной ткани, является катализатором многих реакций; входит в состав инсулина, участвует в белковом обмене.
Избыток металла
При высоких концентрациях является мутагеном и онкогеном.

Избыток металла
При избытке поражает центральную нервную систему, сосредоточивается в почках, нарушает их деятельность; накапливается в клетках мозга и оболочке рта.
Избыток металла
При избытке поражает костную ткань, костный мозг и печень, нервную систему, приводит к хрупкости костей за счет вытеснения кальция.

Избыток металла
Избыток вызывает анемию, почечную недостаточность, заболевания мозга. Способен заменять кальций в костях.
Избыток металла
Избыток приводит к развитию болезни Вильсона, нарушению деятельности печени.
В таблице написано, что свинец даже в небольших количествах вызывает анемию, почечную недостаточность, заболевания мозга. Кроме того, свинец способен заменять кальций в костях. Ионы свинца могут проникать в организм человека.

Особо вредное воздействие на организм человека тяжелых металлов.
Одним из «поставщиков» тяжелых металлов, таких как свинец, медь, хром, является автомобильный транспорт, точнее его выхлопные газы.
«Транспорт в городе»

Установлено, что содержание ионов свинца особенно высоко на прилегающих к дорогам участках.
Количество автомашин (за 15 мин)
100 штук
Количество вредных (газообразных) выбросов
около 3 л
Наличие ионов свинца: – у самой дороги; – в 10 м от дороги; – в 50 м от дороги; – в 100 м от дороги.
черный осадок с раствором NaS; черный осадок; помутнение; не обнаруживается
Запыленность: – лето – зима
В парке – умеренная; на перекрестке – очень сильная; В парке – умеренная; на перекрестке – сильная
Как видно из данных таблицы наибольшее количество ионов свинца обнаруживается у самой дороги, наименьшее – на расстоянии около 100 м.
Такая картина типична для всех крупных городов
Металлы - простые вещества
Au
Солнце
Cu
Венера
Ag
Луна
Fe
Марс
Sn
Юпитер
Pb
Сатурн
Hg
Меркурий

Характеристика простых веществ — металлов
1.
2. Изменение физических свойств в ПС Твердость, t , t
В периоде причина:
n ( e ) на внешнем слое
В группе причина:
R
Метал-лическая связь
Металлическая решетка
Твердое состояние, металлический блеск, электро- и теплопроводность
пл
кип
а
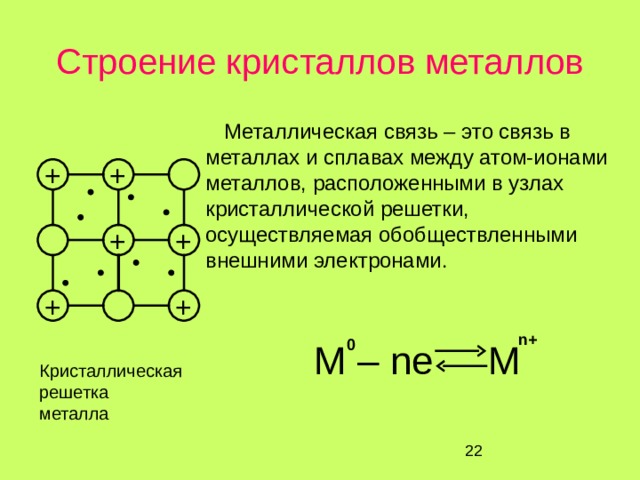
Строение кристаллов металлов
Металлическая связь – это связь в металлах и сплавах между атом-ионами металлов, расположенными в узлах кристаллической решетки, осуществляемая обобществленными внешними электронами.
M – ne M
+
+
+
+
+
+
n+
0
Кристаллическая решетка металла

Физические свойства металлов
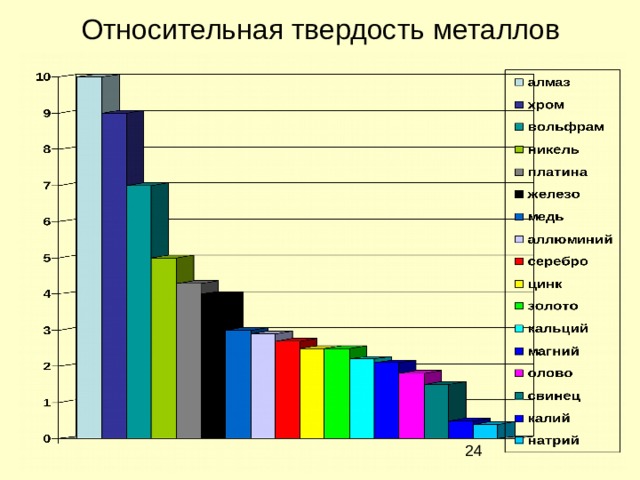
Относительная твердость металлов
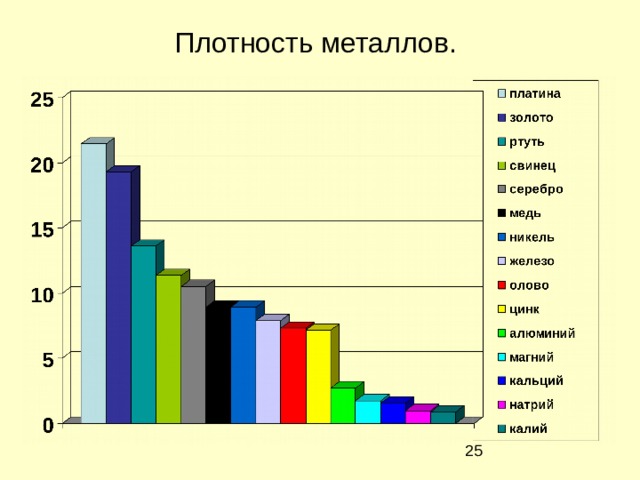
Плотность металлов.
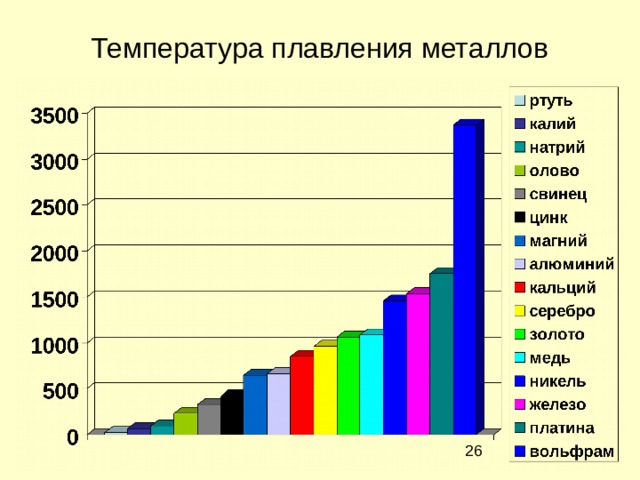
Температура плавления металлов
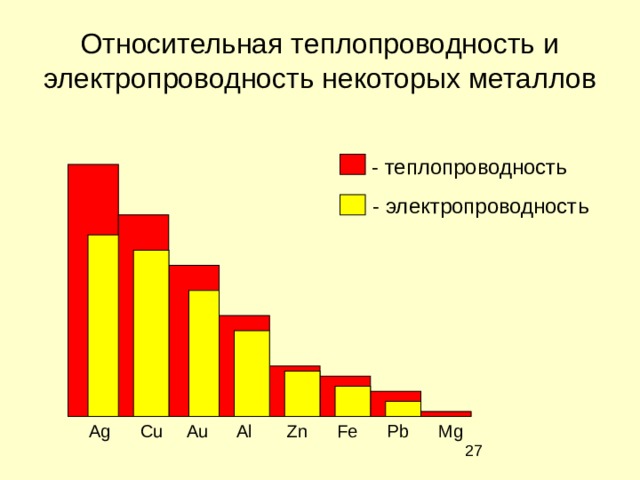
Относительная теплопроводность и электропроводность некоторых металлов
- теплопроводность
- электропроводность
Ag Cu Au Al Zn Fe Pb Mg
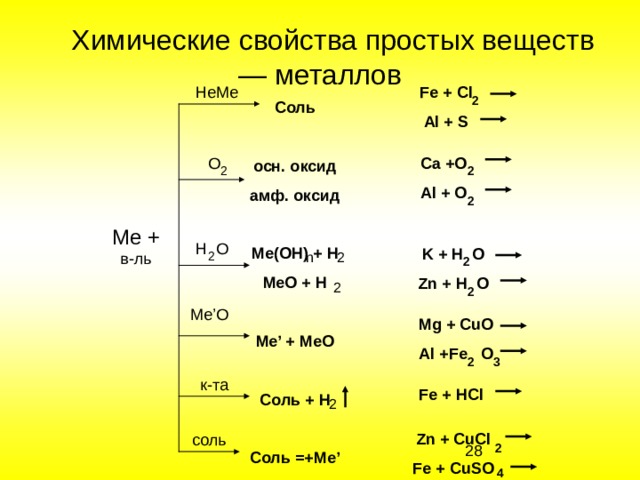
Fe + Cl
Al + S
HeMe
2
Соль
осн. оксид
амф. оксид
Ме (OH) + H
MeO + H
Me’ + MeO
Соль + H
Соль =+ Me’
Ca +O
Al + O
O
2
2
2
Me +
H O
K + H O
Zn + H O
2
2
n
2
2
2
Me’O
Mg + CuO
Al +Fe O
3
2
Fe + HCl
2
Zn + CuCl
Fe + CuSO
2
4

Соединения металлов
Ме О МеОН
МеО Ме(ОН)
основные основания
оксиды
Ме О Ме(ОН)
амфотерные амфотерные
оксиды гидроксиды
МеО , Ме О H МеО , НМеО ,
и др. и др.
кислотные кислоты
оксиды
+1 , +2
2
2
+3
3
2
3
Ст. ок.
2
2
5
+4
2
3
3
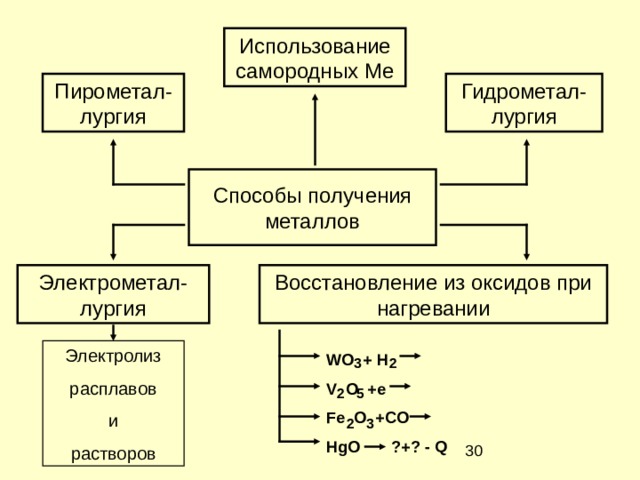
Использование самородных Ме
Пирометал-лургия
Гидрометал-лургия
Способы получения металлов
Электрометал-лургия
Восстановление из оксидов при нагревании
Электролиз
расплавов
и
растворов
WO + H
V O +e
Fe O +CO
HgO ?+? - Q
2
3
2
5
3
2










 R (HeMe) Fr At 3. Ме° - n е Ме - ок-е О, +1, +2, +3 - низкие +4, +5, +6, +7, +8 - высокие 5.Изменение восстановительных свойств атомов Me в ПС В периоде причина: заряд ядра В главной n( е ) на внешнем слое подгруппе R а а + n 4. Ст. ок. Me причина R а а " width="640"
R (HeMe) Fr At 3. Ме° - n е Ме - ок-е О, +1, +2, +3 - низкие +4, +5, +6, +7, +8 - высокие 5.Изменение восстановительных свойств атомов Me в ПС В периоде причина: заряд ядра В главной n( е ) на внешнем слое подгруппе R а а + n 4. Ст. ок. Me причина R а а " width="640"



































