

Учитель сош № 21: Сукнева Л.Е .
- При подготовке к ЕГЭ по химии задания уровня С выходят далеко за рамки двухчасовой школьной программы, например составление уравнений окислительно-восстановительных реакций или уравнений реакций по разрушению комплексных солей. Найти ответы на некоторые вопросы порой не удается ни в одном учебнике или пособии .
- Одно из заданий высокого уровня сложности ( уровня С) проверяет знания об амфотерных свойствах веществ. Для успешного выполнения этого задания нужно знать в том числе и способы разрушения комплексных солей. В учебной литературе этому вопросу уделяется мало внимания. Амфотерные свойства имеют оксиды и гидроксиды многих металлов. Они не растворяются в воде, но растворяются в кислотах и щелочах.При подготовке к ЕГЭ нужно усвоить материал о свойствах соединений алюминия, цинка, бериллия, железа и хрома.
- Одно из заданий высокого уровня сложности ( уровня С) проверяет знания об амфотерных свойствах веществ. Для успешного выполнения этого задания нужно знать в том числе и способы разрушения комплексных солей. В учебной литературе этому вопросу уделяется мало внимания. Амфотерные свойства имеют оксиды и гидроксиды многих металлов. Они не растворяются в воде, но растворяются в кислотах и щелочах.При подготовке к ЕГЭ нужно усвоить материал о свойствах соединений алюминия, цинка, бериллия, железа и хрома.
- Амфотерные свойства имеют оксиды и гидроксиды многих металлов. Они не растворяются в воде, но растворяются в кислотах и щелочах.При подготовке к ЕГЭ нужно усвоить материал о свойствах соединений алюминия, цинка, бериллия, железа и хрома.

Например:
Zn O + 2 HCI= Zn CI 2 + H 2 O ,
Zn(OH) 2 + 2 HCI = ZnCI 2 + 2 H 2 O ,
AI 2 O 3 +6HCI = 2 AICI 3 + 3H 2 o ,
AI (OH) 3 + 3HCI =AICI 3 + 3H 2 O
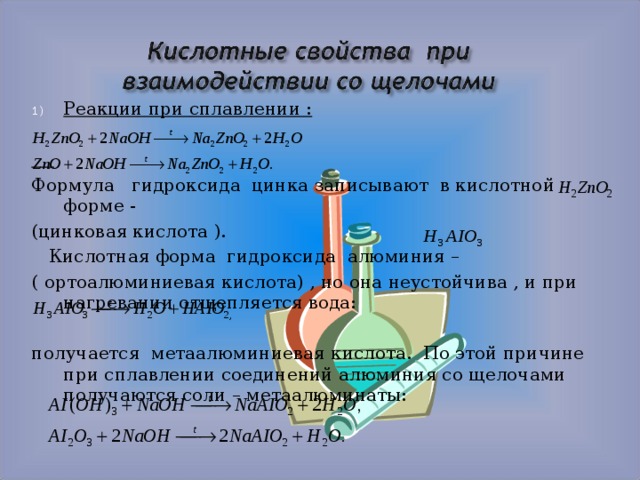
Формула гидроксида цинка записывают в кислотной форме -
(цинковая кислота ).
Кислотная форма гидроксида алюминия –
( ортоалюминиевая кислота) , но она неустойчива , и при нагревании отщепляется вода:
получается метаалюминиевая кислота. По этой причине при сплавлении соединений алюминия со щелочами получаются соли – метаалюминаты:

Следует отметить , что при взаимодействии соединений алюминия со щелочами ( рН = 14) в растворе получаются разные формы комплексных солей ( к.ч.(А I ) =6)
т.е. гексагидроксоалюминат натрия
и тетрагидроксодиакваалюминат натрия.

Соединения бериллия ( ВеО и Ве(ОН) 2 ) взаимодействуют со щелочами аналогично соединениям цинка, соединения хрома ( III) и железа ( III) ( Cr 2 O 3 , Cr(OH) 3 , Fe 2 O 3 , Fe(OH) 3 ) - аналогично соединениям алюминия, но оксиды этих металлов взаимодействуют только при сплавлении.
Cr 2 O 3 + 2Na OH = 2NaCrO 2 +H 2 O
метахромит натрия ( хромат( III) натрия)
Fe 2 O 3 +2NaOH =2NaFeO 2 +H 2 O .
феррит натрия (ферр а т ( III) натрия)
При взаимодействии гидроксидов этих металлов со щелочами в растворе образуются комплексные соли с координационным числом 6.
Гидроксид хрома ( III) легко растворяется в щелочах:
Гидроксид железа ( III) имеет очень слабые амфотерные свойства взаимодействует только с горячими концентрированными растворами щелочей:

Железо и хром с растворами щелочей не реагируют , образование солей возможно только при сплавлении с твердыми щелочами.

1) При действии избытка сильной кислоты получаются две средних соли и вода:
2) При действии сильной кислоты ( в недостатке ) получаются средняя соль активного металла , амфотерный гидроксид и вода:

3) При действии слабой кислоты получается кислая соль активного металла , амфотерный гидроксид и вода:
4) При действии углекислого или сернистого газа получается кислая соль активного металла и амфотерный гидроксид:

5)При действии солей , образованных сильными кислотами и катионами , происходит взаимное усиление гидролиза получаются два амфотерных гидроксида и соль активного металла:
6)При нагревании гидроксокомплексов щелочных металлов выделяется вода:

1)Составьте уравнения четырех возможных реакций между растворами следующих соединений: гексагидроксохромат (III) калия, хлорид алюминия , сероводород , соляная кислота.
Пример решения

3) Напишите уравнения четырех возможных реакций между растворами гексагидроксоалюмината калия, карбоната калия, угольной кислоты, хлорида хрома( III) .


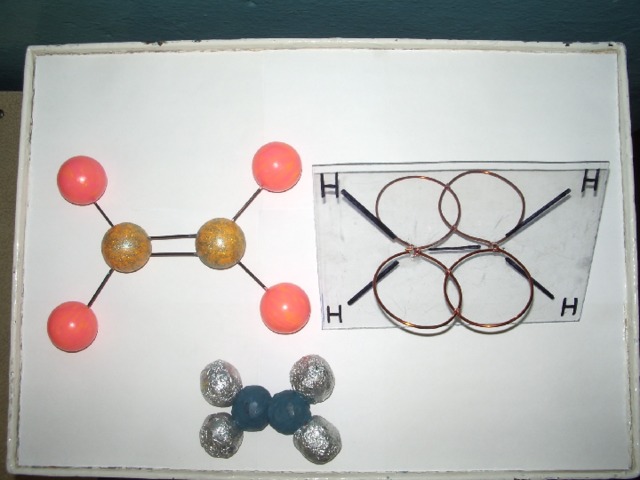
Применение таблиц-схем и моделей на уроках химии
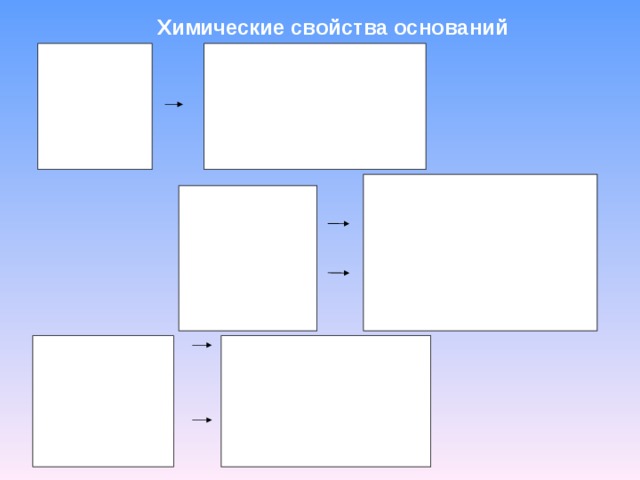
Химические свойства оснований
щелочи
+ кислота
c оль + H 2 O
NaOH + HCl = NaCl + H 2 O
2 NaOH + H 2 SiO 3 = Na 2 SiO 3 + 2H 2 O
+ кислота
c оль + H 2 o
Cu(OH) 2 + H 2 SO 4 = CuSO 4 + 2 H 2 O
разлагаются при t = оксид + вода
t
Fe ( OH ) 2 = FeO + H 2 O
Нерастворимые
в воде
амфотерные
+ кислота = соль + H 2 O
Al(OH) 3 + 3HCl = AlCl 3 + 3H 2 O
= щелочь = соль + H 2 O
HAlO 2 + NaOH = NaAlO 2 + H 2 O
![Образования гидроксокомплексов Al(OH) 3 + KOH = K[Al(OH) 4 ] Zn(OH) 2 + 2KOH = K 2 [Zn(OH) 4 ] Be(OH) 2 + 2NaOH = Na 2 [Be(OH) 4 ] Sn(OH) 2 + 2KOH = K 2 [Sn(OH) 4 ] В сильнощелочных растворах ( pH приб14 ) возможно образования и более сложных комплексов. Al(OH) 3 + 3NaOH = Na 3 [Al(OH) 6 ] Fe(OH) 3 + 3KOH = K 3 [Fe(OH) 6 ] Cr(OH) 3 + 3NaOH = Na 3 [Cr(OH) 6 ]](https://fsd.multiurok.ru/html/2018/02/13/s_5a82401803f86/img16.jpg)
Образования гидроксокомплексов
Al(OH) 3 + KOH = K[Al(OH) 4 ]
Zn(OH) 2 + 2KOH = K 2 [Zn(OH) 4 ]
Be(OH) 2 + 2NaOH = Na 2 [Be(OH) 4 ]
Sn(OH) 2 + 2KOH = K 2 [Sn(OH) 4 ]
В сильнощелочных растворах ( pH приб14 ) возможно образования и более сложных комплексов.
Al(OH) 3 + 3NaOH = Na 3 [Al(OH) 6 ]
Fe(OH) 3 + 3KOH = K 3 [Fe(OH) 6 ]
Cr(OH) 3 + 3NaOH = Na 3 [Cr(OH) 6 ]
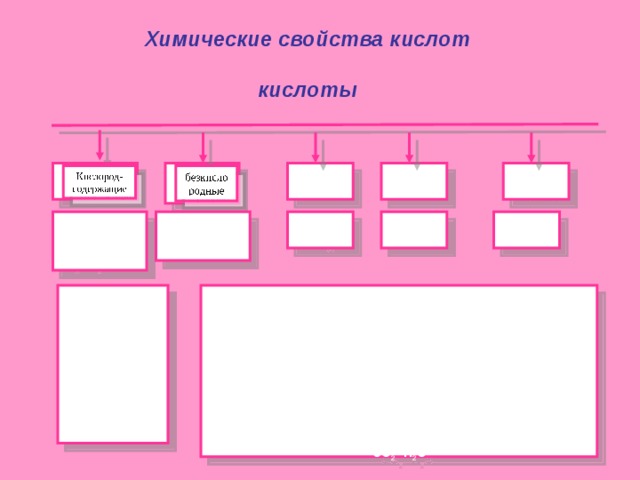
Химические свойства кислот
кислоты
двух
трехос-
новные
одно
HNO 3
HCl
H 2 SO 4
H 3 PO 4
H 2 SO 4 , HNO 3 , H 2 CO 3, H 2 SO 3
H 3 PO 4
HCl, HJ, HBr,
H 2 S, HF
P-p
кислоты
+ Me→ соль + H 2 (3)
Mg+2HCl→MgCl 2 +H 2 ↑
+ основной (амфотерный) оксид → соль + H 2 O ( O )
CaO + H 2 SO 4 → CaSO 4 +H 2 O
+ основная → соль + H 2 O ( O , H )
2NaOH + H 2 SO 4 → Na 2 SO 4 + 2H 2 O
+ соль слабой кислоты → соль + кислота (о)
K 2 CO 3 + 2HNO 3 → 2KNO 3 +H 2 CO 3 (O)
↓ ↓
CO 2 H 2 O
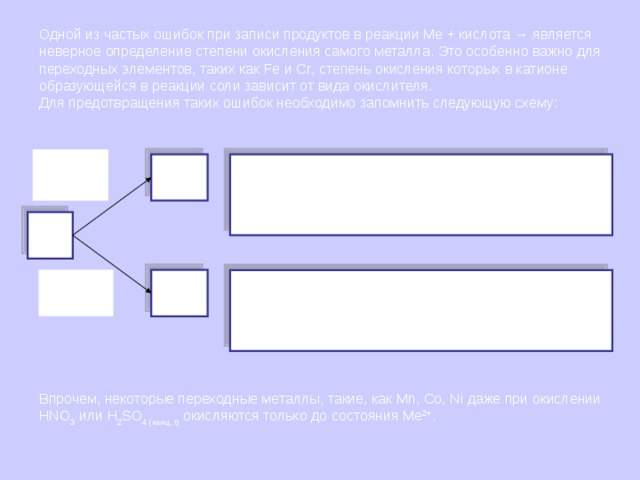
Одной из частых ошибок при записи продуктов в реакции Me + кислота → является неверное определение степени окисления самого металла. Это особенно важно для переходных элементов, таких как Fe и Cr , степень окисления которых в катионе образующейся в реакции соли зависит от вида окислителя.
Для предотвращения таких ошибок необходимо запомнить следующую схему:
Слабые
окислители
Fe +2
(Cr +2 )
Fe + 2H С l = FeCl 2 + Н 2 ↑
Cr +H 2 SO 4( разб ) = CrSO 4 + H 2 ↑
Fe + S → FeS
и т.п.
Fe
(Cr)
Сильные
окислители
Fe +3
(Cr +3 )
2Fe + 3Cl 2 = 2FeCl 3
4Cr + 3O 2 = 2Cr 2 O 3
2Fe +6H 2 SO 4 ( конц ) = Fe 2 (SO 4 ) 3 + 3SO 2 +6H 2 O
Cr + 4HNO 3( разб ) =Cr(NO 3 ) 3 + 2H 2 O +NO
Впрочем, некоторые переходные металлы, такие, как Mn , Co , Ni даже при окислении HNO 3 или H 2 SO 4 (конц, t ) окисляются только до состояния Me 2+ .

Взаимодействие концентрированной H 2 SO 4 c Me
Менее
активные
Me : Cu , Hg , Ag
Me средней активности от H 2 - Mn
SO 2
Me - активные
S
(при ком. t )
SO 2
(при t )
H 2 S
Не реагирует с
Al , Cr , Fe , Ni
Разбавленная
HNO 3
Концентрированная
С тяжелыми металлами
С щелочно-
земельными металлами, а также с Zn и Fe
С другими тяжелыми металлами
На Fe, Cr, Al, Au, Pt, Jr, Ta не действует
С щелочными и щелочноземельными металлами
NO 2
N 2 O
NO
NH 3 (NH 4 NO 3 )

Взаимодействие HNO 3 с Me
HNO 3
концентр.
Менее активные Me : Cu , Hg , Ag
и слабые восстановители
HNO 3
разбав.
c редней активности
от H 2 - Mn
NO 2
NO
Сильные
восстановители и
активные Me
от Li - Al
NO 2
HNO 3
NO
N 2
N 2 O
NH 4 NO 3
не реагирует с
Cr , Al , Fe , Ni , Jr , Ta
NH 4 NO 3
( ком . t) Fe(NO 3 ) 2
Fe
t Fe(NO 3 ) 3
NH 4 NO 3

Термическое разложение некоторых солей.
2KClO 3 → 2KCl +3O 2 ↑
2KMnO 4 → K 2 MnO 4 +MnO 2 + O 2 ↑
4KClO 3 → 3KClO 4 +KCl
4Na 2 SO 3 → Na 2 S + Na 2 SO 4
Оксиды.
(не разлагаются все оксиды, кроме)
2HgO → 2Hg +O 2
2PbO 2 → 2Pb +O 2
Кислоты.
(не разлагаются все кислоты, кроме)
H 2 CO 3 → H 2 O↑ + CO 2 ↑
H 2 SiO 3 → SiO 2 + H 2 O↑
H 2 SO 3 → H 2 O↑ + SO 2 ↑
2HNO 2 → NO↑ + NO 2 ↑ + H 2 O↑
4HNO 3 → 4NO 2 ↑ + O 2 ↑ + 2H 2 O
HCOOH→ CO↑ + H 2 O↑
H 2 C 2 O 4 → HCOOH + CO 2 ↑

Термическое разложение
левее Mg Me(NO 2 ) n + O 2 ↑
Me(NO 3 ) n Mg – Cu Me 2 O n + NO 2 ↑ + O 2 ↑
правее Me + NO 2 ↑ + O 2 ↑
Все соли аммония по схеме
NH 4 Cl → NH 3 ↑ + HCl ↑
(NH 4 ) 2 CO 3 → 2NH 3 ↑ + CO 2 ↑ +H 2 O
(NH 4 ) 2 SO 4 → 2NH 3 ↑ + H 2 SO 4
(NH 4 ) 3 PO 4 → 3NH 3 ↑ + H 3 PO 4
NH 4 NO 2 → N 2 ↑ + 2H 2 O↑
NH 4 NO 3 → N 2 O↑ + 2H 2 O↑
(NH 4 ) 2 Cr 2 O 7 → Cr 2 O 3 + N 2 ↑ + 4H 2 O↑
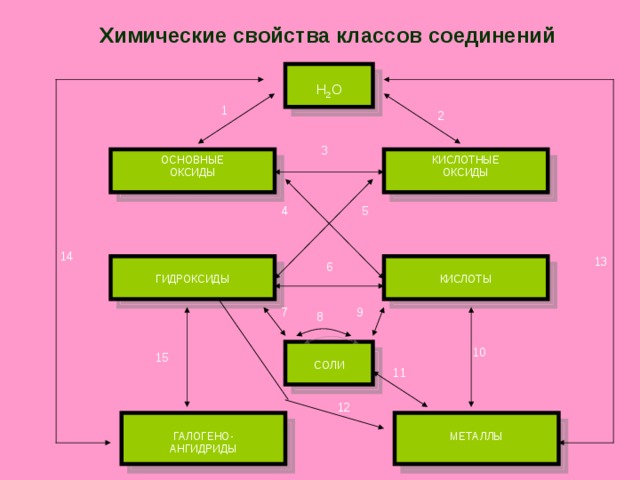
Химические свойства классов соединений
H 2 O
1
2
3
КИСЛОТНЫЕ
ОКСИДЫ
ОСНОВНЫЕ
ОКСИДЫ
4
5
1 4
1 3
6
ГИДРОКСИДЫ
КИСЛОТЫ
9
7
8
10
СОЛИ
15
11
12
ГАЛОГЕНО-
АНГИДРИДЫ
МЕТАЛЛЫ
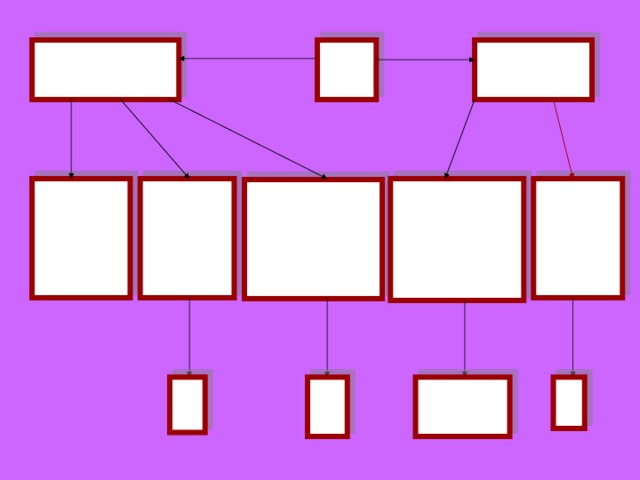
№
Продукты реакции
1
Условия протекания
Гидроксид
2
Только для восьми оксидов: Li 2 O , Na 2 O , K 2 O , Rb 2 O , Cs 2 O , CaO , SrO , BaO
Кислота
3
4
Соль
Кислота, растворимая в воде
Соль + H 2 O
5
Ограничений нет (проблемы с растворимостью нет)
1)кислота, растворимая в воде
2)желательно, чтобы соль была растворима в воде
Соль + H 2 O
6
7
1) Гидроксид растворим в воде
Соль + H 2 O
8
Новая соль + новый гидроксид
1)Хотя бы одно из исходных веществ, растворима в воде
9
соль + соль
1)оба исходных соединений растворимы в воде
2)образуется газ, осадок, H 2 O ,принцип Ле - Шателье
10
1) Также как и 7
Новая соль + новая кислота
11
1)Исходная кислота растворима в воде (искл. H 2 SiO 3 )
2)Как правило, более сильная кислота вытесняет более слабую
3) принцип Ле - Шателье
Соль + H 2
12
1)кислота растворима в воде
2) Me активнее H 2
3)факт ограничения: Me ( Fe ) → +2 ; HNO 3 ; H 2 SO 4(к) → H 2 не выделяется
Соль + Me
13
1)Обе соли растворимы в воде
2)более акт. Ме вытесняет менее акт. Ме
3)примечания 8 Me (5 щ. Me и 3щ. з. Me не брать, одновременно идет 13
Соль амфотерного гидроксида (гидроксокомплекс) и H 2
14
1)Только для амфотерных металлов ( Al , Cr , Zn , Be , Pb , Sn )
гидроксид + H 2
15
1)8 Me , т.е 5щ. и 3щ.з. Ме
Смесь двух кислот + H 2 O
SO 2 Cl 2 + H 2 O → 2 HCl + H 2 SO 4 без ограничений
сульфорил хлорид
Две соли
SO 2 Cl 2 + 4KOH → K 2 SO 4 + 2KCl + 2H 2 O

Галогеноангриды
( 5 класс неорганических соединений , т.е производные кислот, которые
образуются при замене OH группы на галогены.)
H 2 SO 4 HSO 3 Х - галогенсульфоновые кислоты
SO 2 X 2 - сульфил
H 2 SO 3 SOX 2 – тионил ( галогенид )
HNO 2 NOX - нитрозил
H 3 PO 4 POX 3 – фосфорил
HPO 2 X 2
H 2 PO 3 X
H 2 CO 3 COX 2 - карбонил
( COCl 2 - фосген )
H 2 CrO 4 CrO 2 X 2 – хромил
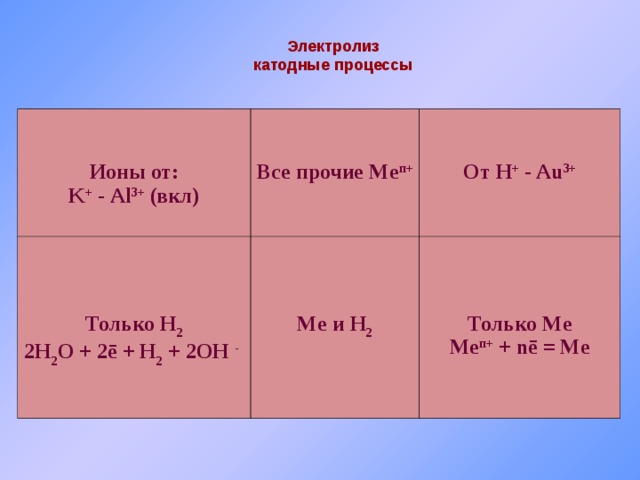
Электролиз
катодные процессы
Ионы от:
K + - Al 3+ (вкл)
Все прочие Me п+
Только H 2
2H 2 O + 2 ē + H 2 + 2OH -
От H + - Au 3+
Me и H 2
Только Me
Me п + + nē = Me

Анодные процессы
S 2- , J - , Br - , Cl - , Se 2- , Te 2- , As 3-
OH - , F - , CO 3 2- , SO 4 2- , NO 3 - …
X m- - mē = X
4 OH - - 4ē → O 2 ↑ + 2 H 2 O
или точнее:
2 H 2 O + 4ē = O 2 ↑ + 4 H +

Направление химических реакций
OH - H + ( кислая среда )
K 2 MnO 4 ← → Mn +2
(темно-зеленый) +1ē (фиолет) +5ē (бесцветный)
KMnO 4
+3ē ↓ + H 2 O
MnO 2 ↓
1) H 2 S + 2KMnO 4 + 2KOH → 2K 2 MnO 4 + S + 2H 2 O
- 1) H 2 S + 2KMnO 4 + 2KOH → 2K 2 MnO 4 + S + 2H 2 O
2) 2KMnO 4 + 5H 2 S + 3H 2 SO 4 → 5S + 2MnSO 4 + K 2 SO 4 + 8H 2 O
- 2) 2KMnO 4 + 5H 2 S + 3H 2 SO 4 → 5S + 2MnSO 4 + K 2 SO 4 + 8H 2 O

KMnO 4 в среде H 2 SO 4 реагирует с различными восстановителями.
окислитель
Продукты, разные для каждой реакции
K 2 SO 4
S
N 2
J 2
Fe 2 (SO 4 ) 3
CO 2
CO 2
Продукты, общие
для всех реакций
K 2 SO 4
+ +
MnSO 4
+
H 2 O
К 2 SO 3
H 2 S
NH 3
KJ
FeSO 4
C 6 H 12 O 6
C 2 H 2 O 4
KMnO 4 + H 2 SO 4

OH - H +
H 2 O ← H 2 O -1 2 → H 2 O + O 2
+2e -2 ē
3H 2 O 2 + K 2 Cr 2 O 7 + 4H 2 SO 4 → K 2 SO 4 +Cr 2 (SO 4 ) 3 + 3O 2 +7H 2 O
PH 3 + 4H 2 O 2 +3KOH → K 3 PO 4 + 7H 2 O
![Хроматное равновесие Cr 2 O 2- 7 + H 2 O 2 CrO 2- 4 + 2 H + (Бихромат анион ( Cr 2 O 2- 7 ) в кислой среде → Cr 3+ ) (В щелочной среде Cr 2 O 2- 7 → в Cr +3 , т.е ( K 3 [ Cr ( OH ) 6 ])](https://fsd.multiurok.ru/html/2018/02/13/s_5a82401803f86/img32.jpg)
Хроматное равновесие
Cr 2 O 2- 7 + H 2 O 2 CrO 2- 4 + 2 H +
(Бихромат анион ( Cr 2 O 2- 7 ) в кислой среде → Cr 3+ )
(В щелочной среде Cr 2 O 2- 7 → в Cr +3 , т.е ( K 3 [ Cr ( OH ) 6 ])
![Cr 2 O 2- 7 + H 2 O = 2CrO 2- 4 + 2H + K 2 CrO 4 ↔ K 2 Cr 2 O 7 (OH - ) (H + ) Хромат калия существует в щелочной воде Бихромат калия существует только в кислой среде ( оранж . K 2 Cr 2 O 7 + капли щелочи → желтый ( хромат )) 3PH 3 +4K 2 Cr 2 O 7 + 16H 2 SO 4 → 3H 3 PO 4 + 4Cr 2 (SO 4 ) 3 + 4K 2 SO 4 + 16H 2 O 3PH 3 +4K 2 Cr 2 O 7 + 16H 2 SO 4 → 3H 3 PO 4 + 4Cr 2 (SO 4 ) 3 + 4K 2 SO 4 + 16H 2 O 2) 3PH 3 + 8 K 2 Cr O 4 + 17KOH + 11H 2 O → 3K 3 PO 4 +8K 3 [Cr(OH) 6 ] 2) 3PH 3 + 8 K 2 Cr O 4 + 17KOH + 11H 2 O → 3K 3 PO 4 +8K 3 [Cr(OH) 6 ]](https://fsd.multiurok.ru/html/2018/02/13/s_5a82401803f86/img33.jpg)
Cr 2 O 2- 7 + H 2 O = 2CrO 2- 4 + 2H +
K 2 CrO 4 ↔ K 2 Cr 2 O 7
(OH - ) (H + )
Хромат калия существует в щелочной воде
Бихромат калия существует только в кислой среде
( оранж . K 2 Cr 2 O 7 + капли щелочи → желтый ( хромат ))
- 3PH 3 +4K 2 Cr 2 O 7 + 16H 2 SO 4 → 3H 3 PO 4 + 4Cr 2 (SO 4 ) 3 + 4K 2 SO 4 + 16H 2 O
- 3PH 3 +4K 2 Cr 2 O 7 + 16H 2 SO 4 → 3H 3 PO 4 + 4Cr 2 (SO 4 ) 3 + 4K 2 SO 4 + 16H 2 O
2) 3PH 3 + 8 K 2 Cr O 4 + 17KOH + 11H 2 O → 3K 3 PO 4 +8K 3 [Cr(OH) 6 ]
- 2) 3PH 3 + 8 K 2 Cr O 4 + 17KOH + 11H 2 O → 3K 3 PO 4 +8K 3 [Cr(OH) 6 ]

Реакции дихромата калия в кислой среде
Продукты, разные для каждой реакции
KNO 3
K 2 SO 4
S
N 2
J 2
Fe 2 (SO 4 ) 3
CO 2
Продукты, общие для всех реакций
K 2 SO 4
+
Cr 2 (SO 4 ) 3 +
+
H 2 O
KNO 2
K 2 SO 3
H 2 S
NH 3
KJ
FeSO 4
C 6 H 12 O 6
K 2 Cr 2 O 7 + H 2 SO 4 +
























![Образования гидроксокомплексов Al(OH) 3 + KOH = K[Al(OH) 4 ] Zn(OH) 2 + 2KOH = K 2 [Zn(OH) 4 ] Be(OH) 2 + 2NaOH = Na 2 [Be(OH) 4 ] Sn(OH) 2 + 2KOH = K 2 [Sn(OH) 4 ] В сильнощелочных растворах ( pH приб14 ) возможно образования и более сложных комплексов. Al(OH) 3 + 3NaOH = Na 3 [Al(OH) 6 ] Fe(OH) 3 + 3KOH = K 3 [Fe(OH) 6 ] Cr(OH) 3 + 3NaOH = Na 3 [Cr(OH) 6 ]](https://fsd.multiurok.ru/html/2018/02/13/s_5a82401803f86/img16.jpg)














![Хроматное равновесие Cr 2 O 2- 7 + H 2 O 2 CrO 2- 4 + 2 H + (Бихромат анион ( Cr 2 O 2- 7 ) в кислой среде → Cr 3+ ) (В щелочной среде Cr 2 O 2- 7 → в Cr +3 , т.е ( K 3 [ Cr ( OH ) 6 ])](https://fsd.multiurok.ru/html/2018/02/13/s_5a82401803f86/img32.jpg)
![Cr 2 O 2- 7 + H 2 O = 2CrO 2- 4 + 2H + K 2 CrO 4 ↔ K 2 Cr 2 O 7 (OH - ) (H + ) Хромат калия существует в щелочной воде Бихромат калия существует только в кислой среде ( оранж . K 2 Cr 2 O 7 + капли щелочи → желтый ( хромат )) 3PH 3 +4K 2 Cr 2 O 7 + 16H 2 SO 4 → 3H 3 PO 4 + 4Cr 2 (SO 4 ) 3 + 4K 2 SO 4 + 16H 2 O 3PH 3 +4K 2 Cr 2 O 7 + 16H 2 SO 4 → 3H 3 PO 4 + 4Cr 2 (SO 4 ) 3 + 4K 2 SO 4 + 16H 2 O 2) 3PH 3 + 8 K 2 Cr O 4 + 17KOH + 11H 2 O → 3K 3 PO 4 +8K 3 [Cr(OH) 6 ] 2) 3PH 3 + 8 K 2 Cr O 4 + 17KOH + 11H 2 O → 3K 3 PO 4 +8K 3 [Cr(OH) 6 ]](https://fsd.multiurok.ru/html/2018/02/13/s_5a82401803f86/img33.jpg)
























