

СДЕЛАЙТЕ СВОИ УРОКИ ЕЩЁ ЭФФЕКТИВНЕЕ, А ЖИЗНЬ СВОБОДНЕЕ
Благодаря готовым учебным материалам для работы в классе и дистанционно
Скидки до 50 % на комплекты
только до
Готовые ключевые этапы урока всегда будут у вас под рукой
Организационный момент
Проверка знаний
Объяснение материала
Закрепление изученного
Итоги урока

Окислительно-восстановительные реакции
Просмотр содержимого документа
«Окислительно-восстановительные реакции»
Учебно-методическое пособие по курсу Неорганическая химия
Абакан 2021
ВВЕДЕНИЕ
Окислительно-восстановительные реакции играют большую роль в при- роде и технике. Процессы, лежащие в основе метаболизма любого живого ор- ганизма - дыхание и фотосинтез - включают стадии окисления и восстановле- ния. Окислительно-восстановительные процессы происходят при сгорании топлива и коррозии металлов, при электролизе, при работе гальванических элементов и аккумуляторов, а также лежат в основе многих технологических процессов. Процессы сжигания обеспечивают основную часть энергопотреб- ления человечества и работу транспорта. Химическая энергетика, металлур- гия, разнообразные процессы химической промышленности, включая элек- тролиз, – вот неполный перечень тех областей, где окислительно- восстановительные реакции играют ключевую роль.
В настоящее время широко применяются графические способы представ- ления основных окислительно-восстановительных состояний для каждого элемента в виде диаграмм. В данном пособии представлены основные спосо- бы построения диаграмм Латимера, Фроста и Пурбе, приведены примеры их использования.
Данное учебно-методическое пособие призвано помочь студентам в ос- воении основных понятий и законов протекания окислительно- восстановительных процессов, в приобретении навыков предсказания про- дуктов окислительно-восстановительных реакций, составления электронного и электронно-ионного баланса, описания электродных процессов при элек- тролизе и работе гальванических элементов.
- Расширенная программа
Окисление и восстановление. Важнейшие окислители и восстановители, соединения с окислительно-восстановительной двойственностью. Основные типы окислительно-восстановительных реакций (ОВР): межмолекулярного и внутримолекулярного окисления-восстановления, самоокисления- восстановления (диспропорционирование, конпропорционирование). Состав- ление уравнений окислительно-восстановительных реакций. Расстановка ко- эффициентов методом электронного баланса и методом полуреакций. Расчет эквивалентных масс окислителей и восстановителей.
Окислительно-восстановительные (электродные) потенциалы как количе- ственная характеристика окислительно-восстановительных систем. Природа скачка потенциала на границе раздела фаз. Водородный электрод: как элек- трод сравнения и индикаторный электрод. Стандартные электродные потен- циалы и способы их определения. Зависимость между величинами окисли- тельно-восстановительных потенциалов систем и изменением энергии Гиб- бса. Использование стандартных потенциалов для оценки возможности про- текания окислительно-восстановительных реакций. Определение направления протекания ОВР. Электродные потенциалы металлов. Стандартные электрод- ные потенциалы и электрохимический ряд напряжений металлов. Положение металлов в ряду напряжений и возможность их взаимодействия с водой, вод- ными растворами кислот и щелочей, солями других металлов. Активность металлов в зависимости от их положения в ряду напряжений и в периодиче- ской системе. Окислительно-восстановительные свойства воды. Устойчи- вость окислительно-восстановительных систем в водных растворах. Подбор окислителей и восстановителей с учетом стандартных окислительно- восстановительных потенциалов. Диаграммы Латимера и Фроста: способы и условия построения; определение форм, склонных к диспропорционирова- нию. Диаграммы Пурбе.
Уравнение Нернста. Зависимость величины электродного потенциала от концентрации ионов в растворе, рН, температуры, комплексообразования, ПР.
Понятие о гальванических элементах. Электродвижущая сила (ЭДС).
Окислительно-восстановительные процессы с участием электрического тока. Электрический ток как сильный окисляющий и восстанавливающий агент. Схемы процессов на электродах (инертных и активных) при электроли- зе расплавов солей и водных растворов солей, кислот и оснований. Выделе- ние на катоде водорода, металлов. Окисление на аноде простых и сложных анионов.
- Степень окисления. Процессы окисления и восстановления.
Окислительно-восстановительные реакции (ОВР) – реакции, которые идут с изменением степеней окисления элементов, входящих в состав реаги- рующих веществ.
Степень окисления (OS) элемента в химическом соединении – это услов- ный заряд, который приписывается его атому в предположении, что вещество состоит из ионов (положительным считается заряд менее электроотрицатель- ного элемента).
Окисление – это процесс отдачи электронов восстановителем. При этом степень окисления восстановителя возрастает.
Восстановление - это процесс принятия электронов окислителем. При этом степень окисления окислителя падает.
Элементы в высшей степени окисления проявляют только окислительные свойства, элементы в низшей степени окисления – только восстановительные свойства. Элементы в промежуточной степени окисления могут выступать как в роли окислителя, так и в роли восстановителя, то есть обладают окисли- тельно-восстановительной двойственностью.
Степень окисления атомов в простых веществах равна 0 (OS = 0).
В соединениях некоторые элементы могут проявляют только одну сте- пень окисления (таблица 1).
Таблица 1. Постоянные степени окисления элементов
| элемент | F | Iа группа ПС | IIа группа ПС, Zn, Cd | Al, Ga |
| OS | -1 | +1 | +2 | +3 |
Водород проявляет степень окисления +1, за исключением гидридов (OS
=-1); кислород - (OS = -2), за исключением фторидов (OF2, O2F2) и соединений со связью -О-О- : пероксидов (H2O2), надпероксидов (NaO2), озонидов (KO3).
В случае соединений с полярными связями значение степени окисления рассчитывается на основании принципа электронейтральности (суммарный заряд всех ионов, составляющих молекулу, равен 0). Например, в соединении Na2S4O6 для серы можно считать OS =+5/2.
Однако следует помнить, что понятие степень окисления является услов- ным и обозначает состояние частицы, которая потеряла или приобрела неко- торое количество электронов. Возникающий на ней эффективный (реальный) заряд отличается от рассчитанного количества отданных или принятых элек- тронов: например, степень окисления марганца в KMnO4 равна +7, а реальный заряд на атоме марганца +0.7.
- Важнейшие окислители и восстановители
- Важнейшие окислители
Рассмотрим важнейшие окислители и продукты их восстановления:
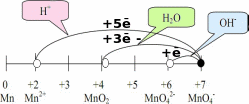
Соединения марганца (IV, VI, VII).
Примеры: MnO2, K2MnO4, KMnO4.
В зависимости от условий среды марганец может восстанавливаться до
Mn+2 при pH до Mn+4 (MnO2) при pH =7, до Mn+6 (MnO42-) при pH 7.
Подкисленный водный раствор перманганата калия KMnO4 при стоянии разлагается по уравнению:
4MnO4- +4H+ = 4MnO2↓ + 3O2↑ + 2H2O
Реакция ускоряется при действии света, поэтому растворы перманганата калия хранят в посуде из стекла темного цвета.
В щелочной среде перманганат переходит в манганат-ион с выделением кислорода:
4КMnO4 + 4КОH = 4K2MnO4 + O2↑ + 2H2O
Манганат калия гораздо менее устойчив по сравнению с перманганатом, и в разбавленном водном растворе очень быстро происходит реакция:
3K2MnO4 + 2H2O = 2КMnO4 + MnO2↓ + 4КОH
Соединения хрома (VI).
Примеры: K2СrO4, K2Сr2O7.
Восстановление хрома Сr+6 обычно проходит до Сr+3.
Бихромат-ион устойчив в кислой среде, а в щелочной – переходит в хро- мат по уравнению: Сr2O72- + 2ОH- = 2СrO42- + 2H2O
Соответственно, хромат-ион устойчив в щелочной среде, а в кислой – пе- реходит в бихромат-ион по уравнению: 2СrO42- + 2H+ = Сr2O72- + H2O
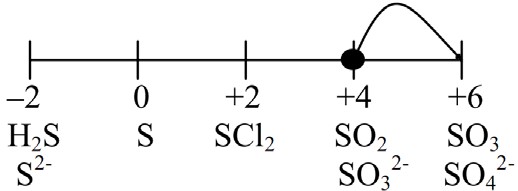
Серная кислота H2SO4.
Продукты восстановления серной кислоты сильно зависят от концентра- ции раствора и от силы восстановителя.
Разбавленная серная кислота является окислителем за счет наличия в мо- лекуле ионов водорода: 2H+ + 2 ē = H2↑. Так как вытеснить водород могут только элементы, стоящие в ряду напряжений левее водорода, то реакция идет только с соответствующими активными металлами.
В концентрированной серной кислоте окисляющим агентом является не ион водорода, а сера в степени окисления +6. Продуктами восстановления бу- дут H2S или S в случае сильных восстановителей (в том числе активных ме- таллов) и SO2 для слабых восстановителей (в том числе неактивных метал- лов).
Азотная кислота HNO3.
4
В растворах азотной кислоты любой концентрации окислителем является азот(+5). Сильные восстановители переводят N+5 концентрированного рас- твора кислоты в N2O или N2, другие – до NO2. В разбавленном растворе азот- ной кислоты происходит более глубокое восстановление азота до N-3 (NH3 или NH +) сильными восстановителями и до NO – более слабыми восстановите- лями.Кислород и озон.
Кислород О2 и озон О3 восстанавливаются до O-2, причем в случае озона продуктом реакции будет кислород. Реже восстановление заканчивается об- разованием пероксидных (Na2O2), надпероксидных (КO2) соединений, озони- дов (KO3).
Галогены.
Как правило, галогены Hal2 восстанавливаются до галогенид-ионов: Hal2 + 2 ē → 2Hal-
Пероксид водорода. H2O2 + 2H++ 2 ē → 2H2O
Соединения металлов.
Сu+2 + 2 ē → Cu0 Ag+ + ē → Ag0
Hg+2 + 2 ē → Hg0 Fe+3 + ē → Fe+2
Sn+4 + 2 ē → Sn+2 Pb+4 + 2 ē → Pb+2
- Важнейшие восстановители
Продукты окисления важнейших восстановителей приведены ниже: М0 - nē → Мn+ Н20 - 2 ē → 2H+ C0 - 4 ē → C4+
C2+ - 2 ē → C4+ 2N-3 - 6 ē → N2 (в отсутствии катализатора) 2Hal- - 2 ē → Hal2 N-3 - 5 ē → NО (в присутствии катализатора) S-2 - 2 ē →S0 S-2 - 6 ē → S4+(SO2) S0 - 4 ē → S4+ Fe+2 - ē → Fe+3 Sn+2-2 ē → Sn+4 H2O2 – 2ē → O2 + 2H+
- Соединения с окислительно-восстановительной двойственностью
В окислительно-восстановительных реакциях принимают участие соеди- нения, которые могут как окисляться, так и восстанавливаться, в зависимости от величины потенциалов реагирующих с ними веществ. Примеры таких со- единений, а также продукты их окисления и восстановления представлены в таблице 2.
Таблица 2. Продукты окисления и восстановления соединений с окисли- тельно-восстановительной двойственностью
| Соединение, (ион) | Полуреакция восстановления | Полуреакция окисления |
| NaNO2 | - + NO2 + 2H + ē → NO + H2O | - - + NO2 + H2O – 2 ē →NO3 + 2H |
| H2O2 | H2O2 + 2H++ 2 ē → 2H2O | H2O2 – 2 ē → O2 + 2H+ |
| Na2SO3 | 2- + 2- SO3 + 6H + 6 ē → S + 3H2O | 2- 2- + SO3 + H2O – 2 ē → SO4 + 2H |
| I2 | I2 + 2 ē → 2I- | - + I2 + 6H2O – 10 ē → 2IO3 + 12H |
| Fe2+ | Fe2+ + 2 ē → Fe0 | Fe2+ – ē → Fe3+ |
| Sn2+ | Sn2+ + 2 ē → Sn0 | Sn2+ – 2 ē → Sn4+ |
- Типы окислительно-восстановительных реакций
Различают несколько типов ОВР:
Межмолекулярные ОВР – ОВР, в которой атомы или ионы окислителя и восстановителя находятся в молекулах разных веществ.
Пример: KMnO4 + HCl = MnCl2 + Cl2 + KCl
Окислитель - KMnO4 (Mn+7), восстановитель – HCl (Cl-).
Внутримолекулярные ОВР – ОВР, в ходе которой степень окисления меняется у разных атомов, входящих в состав одной молекулы.
Пример: KClO3 = KCl + O2
Окислитель - KClO3 (Cl+5), восстановитель - KClO3 (O-2)
Cамоокисление-самовосстановление.
А) Диспропорционирование - ОВР, в ходе которой один элемент высту- пает одновременно в роли и окислителя, и восстановителя. В результате ОВР образуются соединения этого элемента с разными устойчивыми степенями окисления.
Пример: S + KOH = K2S + K2SO3 + H2O
Окислитель – S (S0), восстановитель - S (S0).
А) Конпропорционирование – ОВР, в ходе которой атомы одного и того же элемента с неустойчивыми степенями окисления в разных молекулах (при совместном присутствии) превращаются в одно соединение этого элемента с устойчивой степенью окисления.
Пример: S + H2SO4 = SO2 + H2O
Окислитель – H2SO4 (S+6), восстановитель - S (S0).
- Составление уравнений окислительно-восстановительных реакций
В основу метода положено определение степеней окисления атомов в ис- ходных веществах и продуктах реакции с последующим нахождением и урав- ниванием числа электронов, отданных восстановителем и присоединенных окислителем. Метод подбора коэффициентов с помощью электронного ба- ланса складывается из следующих этапов:
записывают формулы исходных веществ и продуктов реакции;
определяют степени окисления атомов элементов в исходных вещест- вах и продуктах реакции;
находят элементы, которые повышают и понижают степени окисления, выписывают их отдельно с указанием степени их окисления. В случае, если в молекуле содержится более одного иона окислителя/восстановителя, нужно выписывать элемент с соответствующим индексом;
проводят материальный баланс – уравнивание числа элементов в пра- вой и левой частях полуреакций;
определяют число электронов, отданных восстановителем и принятых окислителем, и находят наименьшее общее кратное (НОК) этих чисел;
находят коэффициенты для окислителя и восстановителя, поделив НОК на соответствующее число электронов, и составляют электронный ба- ланс, выставляя за вертикальной чертой полученные коэффициенты. Число электронов, отданных восстановителем, должно быть равно числу электро- нов, принятых окислителем (с учетом умножения числа электронов на коэф- фициенты);
проставляют стехиометрические коэффициенты перед окислителем и восстановителем реакции в правой части молекулярного уравнения (в про- дуктах), за исключением реакций конпропорционирования;
уравнивают числа атомов тех элементов, которые не изменяют своей степени окисления в такой последовательности: катионы щелочных или ще- лочно-земельных металлов; анионы кислотных остатков; атомы водорода. Проверка правильности расстановки коэффициентов оценивается по равенст- ву суммарного числа атомов в левой и правой части уравнения ОВР для эле- мента, не участвующего в процессах окисления/восстановления.
Разберем несколько примеров подбора коэффициентов в ОВР методом электронного баланса.
Пример 1 : Cr2O3 + NaNO3 + Na2CO3 → K2CrO4 + NaNO2 + CO2
 Определяем степени окисления атомов хрома и азота в реагентах, про- дуктах реакции и выписываем эти элементы с указанием степени их окисле- ния. Затем составляем электронный баланс для процессов восстановления и окисления, соблюдая законы сохранения числа атомов и заряда для каждой полуреакции: за вертикальной чертой напротив каждого уравнения выписы- ваем число электронов, участвующих в окислении\восстановлении, находим НОК и соответствующие коэффициенты:
Определяем степени окисления атомов хрома и азота в реагентах, про- дуктах реакции и выписываем эти элементы с указанием степени их окисле- ния. Затем составляем электронный баланс для процессов восстановления и окисления, соблюдая законы сохранения числа атомов и заряда для каждой полуреакции: за вертикальной чертой напротив каждого уравнения выписы- ваем число электронов, участвующих в окислении\восстановлении, находим НОК и соответствующие коэффициенты:


2
Сr +3 − 6ē → 2Cr+6 6 16
N+5 + 2ē → N+3 2 3
Расставляем найденные стехиометрические коэффициенты в ОВР: Cr2O3+ 3NaNO3+ 2Na2CO3→2Na 2CrO4+3NaNO2+2CO2
Рассмотрим особенности подбора коэффициентов в окислительно- восстановительных реакциях, имеющих два окислителя или два восстанови- теля. Число электронов, отданное двумя восстановителями (или принятое двумя окислителями) в таких уравнениях суммируется и именно суммарное число используется для нахождения НОК и соответствующих коэффициен- тов.
Пример 2: FeS2+ O2 → SO2+Fe2O3
Отличительной особенностью при составлении баланса электронов для этого уравнения реакции является необходимость сохранения на всех этапах уравнивания такого соотношения атомов Fe к атомам S, которое задано в формуле исходного вещества FeS2, т.е. 1:2. Это всегда будет приводить к то- му, что при необходимости удвоения атомов железа при составлении баланса, атомы серы должны также удваиваться:


 2Fe+2 − 2ē → Fe2+3
2Fe+2 − 2ē → Fe2+3
восстановители 22 ē 2
2
2S -1 − 20ē → 4S+4
2
окислитель O 0 + 4ē → 2O-2 4 11Подставляем найденные коэффициенты и получаем готовое уравнение: 4FeS2 + 11O2 → 8SO2 + 2Fe2O3
Пример 3: Fe(CrO2)2 + KNO3 + Na2CO3→Fe2O3 + Na2CrO4+ KNO2 + CO2



2
2Fe+2 − 2ē → Fe +3восстановители 14 ē 1
4Cr+3 − 12 ē → 4Cr+6
окислитель N+5 + 2ē → N+3 2 7
Подставляем найденные коэффициенты и получаем готовое уравнение: 2Fe(CrO2)2+ 7KNO3+ 4Na2CO3 → Fe2O3+ 4Na2CrO4+ 7KNO2+ 4CO2
Пример 4: P4 + I2 + H2O → PH4I + H3PO3


4
восстановитель P 0 − 12ē → 4P+3 12 ē 4
4
окислители P 0 + 12ē → 4P-3
2
2I 0 + 4ē → 4I-1 16 ē 3Подставляем найденные коэффициенты и получаем готовое уравнение: 7P4 + 6I2 + 48 H2O → 12PH4I + 16 H3PO3
5.2. Метод электронно-ионного баланса (метод полуреакций)
2
ОВР, протекающие в водных растворах, расплавах и других ионизирую- щих растворителях, удобно уравнивать методом электронно-ионного баланса. При составлении полуреакций используются ионы и (или) молекулы, присут- ствующие в растворе. Если вещество нерастворимо – оно записывается в не- диссоциированном виде. Если атомы, у которых изменяются степени окисле- ния, входят в состав сразу нескольких частиц, то используются те частицы, концентрация которых преобладает. Например, в водном растворе слабой ки- слоты H S присутствуют анионы HS− и S2−, но их содержание пренебрежимомало. Поэтому, из всех частиц, содержащих серу, для уравнивания использу- ем H2S. Таким образом, в виде молекул или формульных единиц записывают- ся слабые электролиты, газы и осадки. Главное преимущество этого метода – использование ионных частиц, реально существующих в водном растворе (не требуется расчетов OS). При составлении схем полуреакций важно уметь оп- ределять среду, в которой протекает полуреакция.
Если в полуреакции идет уменьшение числа атомов кислорода, то она протекает в кислой среде:
а) NO - → NO -
3 2
NO - + 2Н+ + 2ē → NO - + Н О
3 2 2
б) MnO − → MnО
4 2
4
MnO − + 4H+ + 3ē → MnО2+ 2H2O.
Если в схеме полуреакции идет увеличение числа атомов кислорода, то она протекает в нейтральной или щелочной среде:
а) NO - → NO - (нейтральная среда):
2 3
NO - + Н О - 2 ē → NO - + 2Н+
2 2 3
б) NO - → NO - (щелочная среда):
2 3
NO - + 2ОН- - 2ē → NO - + Н О
2 3 2
Разберем несколько примеров подбора коэффициентов в ОВР методом электронно-ионного баланса.
Пример 1: KMnO4+ K2SO3+ H2SO4 →
4
4
в перманганат-ионе MnO - марганец (OS=+7) проявляет только окис- лительные свойства. В зависимости от кислотности среды для иона MnO - ха-
4
4
4
2
рактерны следующие продукты восстановления:
В кислой среде ионы MnO - восстанавливаются до солей Mn(II). В схеме полуреакции MnO - → Mn2+ необходимо а) уравнять число атомов Mn (число атомов, меняющих OS), б) уравнять число атомов О добавлением молекул Н2О справа: MnO - → Mn2+ + 4H O,
4 2
в) уравнять число атомов Н добавлением катионов Н+ слева: MnO - + 8H+ → Mn2+ + 4H O,г) уравнять число зарядов частиц добавлением или вычитанием необходимо- го числа электронов слева:
MnO - + 8H+ + 5ē → Mn2+ + 4H O
4 2
3
 Сульфит-ион SO 2- может проявлять восстановительные и окислитель- ные свойства (атом S имеет промежуточную OS= +4).
Сульфит-ион SO 2- может проявлять восстановительные и окислитель- ные свойства (атом S имеет промежуточную OS= +4).
- 3ē
В присутствии окислителя (MnO -) SO 2- является восстановителем. Ионы
4 3
SO 2- будут окисляться до S(VI) в виде SO 2-.
3 4
В схеме полуреакции SO 2- → SO 2- необходимо: а) уравнять число атомов S
3 4
(число атомов, меняющих OS), б) уравнять число атомов О добавлением мо- лекулы Н2О слева:
SO 2- + H O → SO 2-,
3 2 4
в) уравнять число атомов Н добавлением катионов Н+ справа: SO32- + H2O → SO42- + 2H+,
г) уравнять число зарядов частиц добавлением или вычитанием необходимого числа электронов:
3 2 4
SO 2- + H O - 2 ē → SO 2- + 2H+,Составив полуреакции для процессов окисления и восстановления, нужно уравнять число отданных и принятых электронов. Для этого находим коэффициенты, на которые следует умножить каждую из полуреакций:
MnO - + 8H+ + 5 ē → Mn2+ + 4H О | 2
4 2
SO 2- + H O - 2ē → SO 2- + 2H+ | 5
3 2 4
Суммируем обе полуреакции и в полученном ионно-молекулярном уравнении сокращаем одинаковые молекулы или ионы:
2MnO - + 16H++ 5SO 2-+ 5H O → 2Mn2++ 8H О + 5SO 2-+ 10H+


4 3 2 2 4
После сокращения ионов Н+ и молекул Н2О уравнение приобретет следую- щий вид:
2MnO - + 5SO 2- + 6H+→ 2Mn2++ 5SO 2- + 3H О
4 3 4 2
4
Дописываем противоионы K+ и SO 2-, и получаем готовое уравнение: 2KMnO4 + 5K2SO3 + 3H2SO4 → 2MnSO4 + 6K2SO4 + 3H2ОПример 3: KMnO4+ K2SO3+ KOH →
4
В щелочной среде ионы MnO - восстанавливаются до манганат-ионовMnO 2-: MnO - + 1 ē → MnO 2-
4 4 4
В щелочной среде ионы SO 2- окисляются до S(VI) – в форме SO 2-. В схеме
3 4
полуреакции SO 2- → SO 2- необходимо уравнять: а) число атомов S (число
3 4
атомов, меняющих OS ), б) число атомов О добавлением гидроксид-ионов ОН- слева (их должно быть в 2 раза больше, чем необходимо атомов О):
3 4
SO 2- + 2OH- → SO 2-в) число атомов Н добавлением молекул Н2О справа
SO 2- + 2OH- → SO 2- + H О,
3 4 2
г) число зарядов частиц электронами:
3 4 2
SO 2- + 2OH- - 2 ē → SO 2- + H ОСоставив схемы полуреакций, уравниваем число отданных и принятых электронов, находим коэффициенты, на которые следует умножить число частиц первой и второй полуреакций:
MnO - + 1 ē → MnO 2- | 2
4 4
SO 2- + 2OH- - 2ē → SO 2- + H О | 1
3 4 2
Суммируем обе полуреакции:
2MnO4- + SO32- + 2ОН- → 2MnО42- + SO42- + H2О
Дописываем противоионы K+ и получаем готовое уравнение: 2КMnO4 + К2SO3 + 2КОН → 2К2MnО4 + К2SO4 + H2О
- Расчет эквивалентных масс окислителей и восстановителей
Эквивалентная масса окислителя равна отношению молярной массы окислителя к числу электронов, принятых 1 молекулой окислителя.
Эквивалентная масса восстановителя равна отношению молярной массы восстановителя к числу электронов, отданных 1 молекулой восстановителя.
В качестве примера рассчитаем эквивалентные массы окислителя и вос- становителя в следующих химических реакциях:
K2Cr2O7 + FeCl2 + HCl → FeCl3 + CrCl3 + KCl + H2O
Эок-ля = М(K2Cr2O7)/6=294/6 = 49 г/моль Эвос-ля = М(FeCl2)/1=127 г/моль
KIO3 + KI + H2SO4 → I2 + K2SO4 + H2O
Эок-ля = М(KIO3)/5=214/5=42,8 г/моль Эвос-ля = М(KI)/1=166 г/моль
NaIO3 + H2O2 → NaI + O2 + H2O Эок-ля = М(NaIO3)/1= 198 г/моль Эвос-ля = М(H2O2)/2=34/2=17 г/моль.
- Двойной электрический слой. Электродные потенциалы
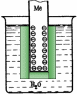 Поместим в раствор соли меди (например, медного купороса) медную пластинку. В этом случае из пластины в прилегающий к
Поместим в раствор соли меди (например, медного купороса) медную пластинку. В этом случае из пластины в прилегающий к
ней раствор уйдут ионы меди, на поверхности пластины ос- танутся электроны и она зарядится отрицательно:
Cuo(тв.) - 2 ē Cu2+(р.)
Возникшие электростатические силы препятствуют дальнейшему течению этого процесса, и в системе устано- вится равновесие. Переходу ионов в раствор способствует увеличение энтропии (энтропия ионов в растворе больше,
чем энтропия металлической пластинки) и образование гидратов ([Cu(H2O)n]2+), а препятствуют процессы ионизации (энергия ионизации дос- таточно высока) и разрушения кристаллической решетки.
Рассмотренные процессы приводят к возникновению двойного электри- ческого слоя и скачка потенциала (или Е) на границе раздела фаз между отрицательно заряженной пластинкой и слоем положительно заряженных ио- нов в растворе. Толщина двойного электрического слоя в разбавленных рас- творах составляет сотни ангстрем, а в концентрированных уменьшается до нескольких ангстрем. Измерить абсолютную величину нельзя. Величина
зависит от природы металла, температуры и концентрации ионов металла
в растворе.
Окислительно-восстановительную систему, состоящую из металла, опу- щенного в раствор его соли, называют электродом или полуэлементом. В том случае, когда концентрация электролита соответствует 1 М раствору, Т=298К, Р=101.3 кПа, электрод называют стандартным, а возникающий на нем потенциал называют стандартным потенциалом и обозначают 0 (Е0). Отрицательно заряженный электрод выступает в роли анода, а положительно заряженный – в роли катода.
- Водородный электрод
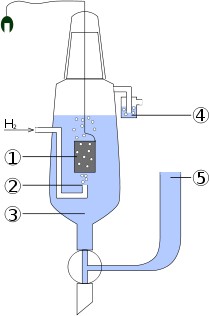 Водородный электрод представляет собой пла- тиновую пластинку, электролитически покрытую платиновой чернью (губчатой платиной, имеющей большую площадь поверхности), погружённую в раствор кислоты с определённой концентрацией ио- нов водорода Н+ и омываемой током газообразного водорода. Между газообразным водородом, адсор- бированным платиновой чернью, и ионами водоро- да в растворе устанавливается равновесие. Потен- циал водородного электрода возникает за счёт обра- тимо протекающей реакции
Водородный электрод представляет собой пла- тиновую пластинку, электролитически покрытую платиновой чернью (губчатой платиной, имеющей большую площадь поверхности), погружённую в раствор кислоты с определённой концентрацией ио- нов водорода Н+ и омываемой током газообразного водорода. Между газообразным водородом, адсор- бированным платиновой чернью, и ионами водоро- да в растворе устанавливается равновесие. Потен- циал водородного электрода возникает за счёт обра- тимо протекающей реакции
H2 - 2 ē 4 2H+
На приведенной схеме водородного электрода: 1 – платиновая пластинка, покрытая платиновой чернью; 2 - подводимый газообразный водород; 3 - рас- твор кислоты; 4 - водяной затвор, препятствующий попаданию кислорода воздуха; 5 – солевой мост.
Водородный электрод, в котором концентрация ионов водорода равна 1 моль/л и давление водорода Р(Н2)=1 атм. называется стандартным. Потен- циал стандартного водородного электрода принят равным 0.
- Гальванический элемент. ЭДС
Если окислительно-восстановительную реакцию осуществить так, чтобы процессы окисления и восстановления были пространственно разделены, и создать возможность перехода электронов от восстановителя к окислителю по проводнику, то в цепи возникнет электрический ток, то есть направленное движение электронов. Такие устройства, в которых химическая энергия пере- ходит в электрическую, называются гальваническими элементами или ак- кумуляторами. Гальванический элемент образован двумя электродами (полу-
элементами): катодом и анодом. На катоде происходит процесс восстановле- ния, на аноде – окисления. В гальванических элементах электроны движутся от анода к катоду. Металлические пластины электродов соединяют между со- бой проводником 1 рода (металлической проволокой), а растворы – U- образ- ной трубкой с раствором электролита (солевым мостиком, состоящим из кон- центрированного раствора хлорида калия). Возникающая электродвижущая сила (ЭДС) обусловлена разностью потенциалов образующих гальванический элемент электродов: ЭДС=φ(катод) – φ(анод). Из определения следует, что ЭДС не может принимать отрицательные значения (ЭДС0).
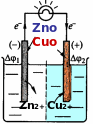 В качестве примера рассмотрим гальванический элемент, состоящий из стандартных цинкового и медного электродов, погруженных в 1 М растворы соответст-
В качестве примера рассмотрим гальванический элемент, состоящий из стандартных цинкового и медного электродов, погруженных в 1 М растворы соответст-
вующих электролитов (ZnSO , CuSO ). Для того чтобы
4 4
определить, какой металл будет выступать в роли катода, а какой в роли анода, необходимо сравнить величины по- тенциалов стандартных цинкового и медного электрода (справочные данные). Электрод с большим потенциалом будет катодом, а с меньшим – анодом. Сравнивая
0(Zn2+/ Zn0) и 0(Сu2+/Cu 0), получим, что медный электрод выступает в роли катода, а цинковый – в роли анода:
Zn2+ + 2ē → Zn0 0 = -0.76 В Сu2+ + 2 ē → Cu0 0 = 0.34 В
Расcчитаем ЭДС рассмотренного гальванического элемента: ЭДС=
0(Сu2+/Cu 0) - 0(Zn2+/ Zn0) = 0.34+0.76=1.1 В.
При схематическом изображении гальванического элемента граница раз- дела между металлом и раствором обозначается вертикальной чертой, грани- ца между растворами электролитов – двойной вертикальной чертой. Таким образом, описанный выше гальванический элемент изображается схематиче- ски:
Zn│ZnSO4║CuSO4│Cu
- Стандартные электродные потенциалы. Электрохимический ряд напряжений металлов
В отличие от потенциалов электродов, величину ЭДС измерить можно. Зная ЭДС и потенциал одного из электродов, легко вычислить потенциал дру- гого неизвестного электрода. Таким образом, используя в качестве электрода стандартный водородный электрод, были определены потенциалы стандарт- ных электродов ряда металлов. В соответствии с ростом величины стандарт-
ного потенциала окислительно-восстановительной пары, металлы выстроены в электрохимический ряд напряжений:
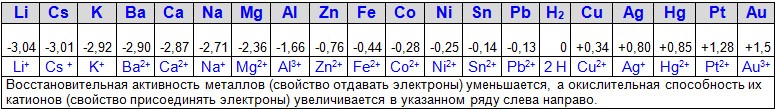
Чем активнее металл, тем левее относительно водорода в ряду напряже- ний он находится (0 таллы стоят правее водорода (00). Чем ниже величина стандартного потен- циала, тем в большей степени выражены восстановительные свойства (спо- собность отдавать электроны металлов и переходить в катионы). Чем выше величина стандартного потенциала, тем в большей степени выражены окис- лительные свойства (способность принимать электроны ионами металлов и переходить в свободное состояние).
В зависимости от положения в ряду напряжений металлы делят на три
условные группы.
Активные Li – Mg (реагируют с водой);
Средней активности Al – (H2) (пассивируются: Al, Ti, Cr, Fe, Co, Ni, Zn, Sn, Pb);
Малоактивные H2 – Au (не реагируют с водой).
Более активные металлы (стоящие левее в ряду напряжений) вытесняют менее активные (стоящие правее в ряду напряжений) из растворов их солей.
- Направление и глубина протекания ОВР
Термодинамическая возможность протекания любой химической реакции определяется величиной изменения энергии Гиббса (изобарно- изотермического потенциала) ∆G. Если в данной ОВР ∆G реакция идет в прямом направлении (слева направо); если ∆G0, то - в обрат- ном (справа налево).
Ox1 + Red2 → Ox2 + Red1 ∆G1
Ox2 + Red1 → Ox1 + Red2 ∆G2
Изменение стандартной энергии Гиббса зависит от разности потенциалов стандартных полуэлементов или окислительно-восстановительных пар эле- ментов данной ОВР:
1
Ox1 + nē → Red1 φ0
2
Ox2 + mē → Red2 φ0
1
φ
2
0 - φ0= ∆φ0
∆G0 =− nF·∆φ0 , где n – число электронов.
Таким образом, условием протекания ОВР в прямом направлении являет- ся положительная величина разности стандартных потенциалов окислитель- но-восстановительных систем (∆φ00). Окислительно-восстановительная сис- тема с большим значением потенциала (φ0) будет выступать в роли окислите- ля, с меньшим значения потенциала (φ0) - в роли восстановителя. Чем больше разность ∆φ0, тем глубже протекает ОВР. Сопоставляя значения стандартных потенциалов Red/Ox пар, можно подбирать окислители или восстановители для определенных соединений при стандартных условиях.
В качестве примера определим направление протекания следующей ОВР в стандартных условиях:
I2 + NO + H2O 4 HI + HNO2 .
Выпишем из справочника значения стандартных потенциалов соответст- вующих Red/Ox пар:
2
φ0 (I2/2I-) = 0.54B, φ0 (NO -/NO) = 0.90B.Как видно, значение φ0 (NO -/NO) φ0 (I /2I-). Значит, нитрит-ион является
2 2
более сильным окислителем, чем йод. Величина ∆φ00 для прямой реакции, а
∆G00. Поэтому данная ОВР идет в обратном направлении (справа налево).
- Уравнение Нернста
Потенциал любой окислительно-восстановительной системы можно рас- считать по уравнению Нернста (В. Нернст (1864-1941), нем. ученый, лауреат Нобелевской премии по химии 1920 г.).
Так, для системы Mn+/M0, состоящей из металла (металлической пластин- ки) в нулевой степени окисления и иона этого же металла в растворе электро- лита, реальный потенциал рассчитывается исходя из уравнения:
φ = φ0 + ((RT)/(nF))•ln [Mn+], где R – универсальная газовая постоянная (8.413 Дж/(моль•К)), T – температура (К), n – число электронов, участвующих в данной полуреакции, F - число Фарадея (96500 Кл/моль).
Если в растворе одновременно присутствуют Ох окисленная и восстанов- ленная форма Red формы, то уравнение Нернста записывается следующим образом: φ = φ0 + ((RT)/(nF))•ln [Ox]/[Red], где [Ox] и [Red] – равновесная концентрация окисленной и восстановленной форм соответственно.
Если в окислительно-восстановительной системы участвуют ионы водо- рода (или гидроксид-ионы), то потенциал системы рассчитывается с учетом рН среды: Ox +mH+ + nē → Red:
φ= φ0 + ((RT)/(nF))•ln ([Ox][H+]m)/[Red].Для стандартных условий (Т=298К, Р=101.3 кПа): φ= φ0 + (0,059/n)•lg([Ox][H+]m)/[Red].
Таким образом, значения электродных потенциалов зависят от ряда фак- торов:
природы веществ - участников электродного процесса;
соотношения концентраций окисленной и восстановленной форм;
рН среды;
температуры.
Пример: Запишем уравнения Нернста для некоторых полуреакций:
Zn2+ + 2 ē → Zn0 (концентрацию веществ, находящихся в твердой фазе не учитываем) φ= -0,76 + (0,059/2)•lg[Zn2+]
7
2
Cr2O 2- + 14H+ + 6 ē → 2Cr3+ + 7H O (концентрацию воды не учитыва-
7
ем) φ= 1,33 + (0,059/6)•lg([Cr2O 2-][H+]14)/[Cr3+](водородный электрод, Р(Н2)=1 атм)
φ= φ0 + (0,059/2)•lg[H+]2)/ Р(Н2) = 0.059 •lg[H+]= - 0.059pH
Соотношение концентраций окисленной и восстановленной форм Red/Ox системы может существенно измениться вследствие связывания одной из форм в малодиссоциирующее соединение (например, комплекс или плохорас- творимое вещество). Таким образом, процессы выпадения осадков и комплек- сообразования в окислительно-восстановительных системах могут сильно из- менить величину потенциала.
- Влияние комплексообразования на величину потенциала окис- лительно-восстановительной системы
Введение лиганда в раствор приводит к комплексообразованию, что практически всегда уменьшает значение электродного потенциала Red/Ox системы. Это связано с тем, что комплекс на основе окисленной формы (с бо- лее высокой степенью окисления комплексообразователя) всегда более ус- тойчив по сравнению с восстановленной формой комплексообразователя (комплексного соединения с более низкой степенью окисления центрального атома). В результате наблюдается уменьшение активности (концентрации) свободных (незакомплексованных) ионов окисленной формы по сравнению со свободными ионами восстановленной формы и, в соответствии с уравне- нием Нернста, электродный потенциал системы снижается по сравнению с системой в отсутствии комплексообразования.
В качестве примера рассмотрим, насколько существенно изменится вели- чина стандартного потенциала системы Fe3+/Fe2+ (Fe3+ + e → Fe2+ , φ0 = 0.77 В) при добавлении к 1 л этого раствора цианид-ионов в количестве 1 моль (С=1М). Введенные ионы лиганда будут связывать как окисленную, так и восстановленную форму железа. При этом образуются комплексы с соответ-
ствующими константами нестойкости: Кн([Fe(СN)6]3-)=1•10-31 и Кн([Fe(СN)6]4-)
=1•10-24 . Комплекс с окисленной формой железа(III) - [Fe(СN)6]3- - на 7 по- рядков прочнее комплекса [Fe(СN)6]4-, поэтому равновесная концентрация [Fe3+] в растворе будет существенно ниже равновесной концентрации [Fe2+]:
[Fe3+]=(Kнест•[Fe(СN)6]3-)[CN-]6= Kнест=1•10-31 [Fe2+]=(Kнест•[Fe(СN)6]4-)[CN-]6= Kнест=1•10-24
Рассчитаем, потенциал системы Fe3+/Fe2+ в 1 М растворе цианид-ионов: φ= φ0 + 0.059•lg10-31/10-24= 0.77 +0.059•(-7)= 0.357 В.
Таким образом:
[Fe(СN)6]3- + ē → [Fe(СN)6]4- φ0 = 0.357 В.
- Влияние на величину Red/Ox потенциала системы образования малорастворимого соединения
Присутствие в окислительно-восстановительной системе осадка малорас- творимого электролита также оказывает сильное влияние на величину элек- тродного потенциала Red/Ox системы. Изменение потенциала в этом случае будет определяться величиной произведения растворимости ПР малораство- римого соединения. Из состава малорастворимого соединения могут перехо- дить в раствор как окисленная, так и восстановленная формы Red/Ox систе- мы, а также и окисленная и восстановленная формы одновременно.
В качестве примера рассмотрим, как изменится окислительно- восстановительный потенциал системы Fe3+/Fe2+ в 1 М водном растворе ще- лочи. В таких условиях можно ожидать образование двух видов осадков - Fe(OH)2 (ПР1= 1.0•10-15) и Fe(OH)3 (ПР2=3.8•10-38). Выразим равновесные кон- центрации окисленной и восстановленной форм через величины ПР, учиты- вая, что [OH-]=1 M:
[Fe2+]=ПР1 /[OH-]2= ПР1=1.0•10-15
[Fe3+]=ПР2 /[OH-]3= ПР2=3.8•10-38.
Рассчитаем величину потенциала Fe3+/Fe2+ системы в присутствии осад- ков Fe(OH)2 и Fe(OH)3 по уравнению Нернста:
φ= φ0 + 0.059•lg(3.8•10-38/1.0•10-15)= 0.77 + 0.059•(-23) +0.059•058= -0.553 В.
Таким образом, в сильнощелочной среде потенциал полуреакции Fe3+ + ē
→ Fe2+ меняется с положительной величины (φ0 = 0.77 В) на отрицательную (φ0 = -0.553 В), то есть система Fe3+/Fe2+ при рН=14 способна проявлять силь- ные восстановительные свойства.
- Окислительно-восстановительные свойства воды
В водном растворе не могут существовать те вещества, которые вызыва- ют восстановление или окисление воды. Термодинамическая устойчивость вещества с данной OS в водном растворе может быть обусловлена:
способностью в кислой среде ([Н+] = 1 моль/л, рН = 0) восстанавливать катионы водорода:
2Н+ + 2ē → Н2 φo = 0.000 B
способностью в щелочной среде ([Н+]=10-14 моль/л, [OH-]= 1 моль/л, рН=14) восстанавливать водород воды:
2Н2О + 2ē → Н2 + 2ОН- φo = -0.828 B
Способностью в кислой среде окислять кислород (О-2) воды: 2Н2О - 4ē → О2 + 4Н+ φo = 1.229 B
способностью в щелочной среде окислять кислород (О-2) гидроксид- ионов: 4ОН- - 4 ē → О2 + 2Н2О φo = 0.401 B
Таким образом, в щелочной среде сосуществование окисленной и вос- становленной формы Red/Ox системы возможно только в интервале потен- циалов от -0.828 В до +0.401 В. При φ-0.828 В вода будет восстанавливаться восстановленной формой системы до Н2 : 2Н2О + 2ē → Н2 + 2ОН- ;
А при φ0.401 В вода будет окисляться окисленной формой системы до О2: 4ОН- - 4 ē → О2 + 2Н2О.
В кислой среде окисленные и восстановленные (Red/Ox) формы систем будут сосуществовать в интервале потенциалов от 0.0 В до +1.229 В. При φ≤0.000 В вода будет восстанавливаться до Н2 (восстановленная форма сис- темы окисляется ионами Н+); при φ1.229 В вода будет окисляться окислен- ной формой системы до О2.
4
Например, в кислой среде в присутствии восстановителя перманганат- ионы переходят в ионы марганца(II). Потенциал перехода φo (MnO - /Mn+2)=1.500 В выше φo (Н+ /Н2)= 1.229 В
MnO - + 8H+ + 5ē = Mn+2 + 4H O φo = 1.500 В
4 2
2Н2О - 4ē → О2 + 4Н+ φo = 1.229 B ,
поэтому вода выступает в роли восстановителя, и водные растворы перманга- ната разлагаются при стоянии:
рН 4MnO4- +4H+ = 4MnO2↓ + 3O2↑ + 2H2O
- Электролиз
- Электролиз расплавов и растворов электролитов
Электролизом называется совокупность процессов, протекающих при прохождении постоянного электрического тока через систему, состоящую из двух электродов в растворе или расплаве электролита.
В отличие от гальванического элемента, где ток вырабатывался химиче- ской реакцией (∆G бы ОВР прошла (∆G0).
Как и в случае гальванических элементов, на катоде происходит процесс восстановления, а аноде - окисления. Однако заряд электродов в аккумулято- рах и электролитических ячейках противоположен: катод заряжен отрица- тельно, а анод – положительно при электролизе. Поэтому в процессе электро- лиза электроны движутся от катода к аноду (в гальванических элементах на- оборот). На катоде в первую очередь восстанавливаются ионы, имеющие наибольшее значение электродного потенциала. На аноде в первую очередь окисляются ионы, имеющие наименьшее значение электродного потенциала.
Электрод (анод), материал которого может окисляться в процессе элек- тролиза, называется активным (растворимым) электродом.
Не окисляющийся в процессе электролиза и служащий только для подво- да электрического тока электрод называется инертным.
Рассмотрим процессы, которые происходят на электродах при электроли- зе расплавов и растворов солей.
Расплавы.
А) Катод: Mn+ +nē →M0
На катоде восстанавливаются все ионы металлов независимо от их актив- ности.
Б) Анод
В случае инертных электродов на аноде бескислородные анионы окисля- ются до простых веществ, а в случае кислородсодержащих ионов - выделять- ся O2.
2Hal- - 2ē → Hal2 S2- - 2ē → S0
4
2SO 2- - 4 ē → 2SO3+ O2
4OH- - 4ē → 2H2O + O2
Если проводится электролиз с активным электродом (растворимым ано- дом), то на нем протекает процесс окисления материала анода.
Растворы.
При электролизе водных растворов нужно иметь в виду, что, кроме ионов электролита, электрохимическому окислению/восстановлению могут подвер- гаться молекулы воды. Какие процессы будут протекать у электродов будут зависеть от относительных значений электродных потенциалов систем. В первую очередь будут протекать те процессы, которые требуют минимальной затраты энергии: на катоде будут восстанавливаться окисленные формы элек- трохимических систем, имеющих наибольший электродный потенциал; а на аноде будут окисляться восстановленные формы систем с наименьшим элек- тродным потенциалом.
А) Катод: процессы, протекающие на катоде определяются только вели- чиной потенциала Mn+/M0, а значит, и положением металла в ряду стандарт- ных электродных потенциалов.
Для систем Mn+/M0 при электролизе водных растворов нужно учитывать величину потенциала процессов восстановления ионов водорода. Для ней- тральных растворов (рН=7) φ=-0.059•7=-0.41 В. Поэтому, если катионом элек- тролита является металл, потенциал которого выше, чем -0.41 В, то на катоде будет выделяться металл M0. Если потенциал φ (Mn+/M0) восстанавливаться не будет, а будут восстанавливаться ионы водорода воды и на катоде будет выделяться Н2. Если потенциал φ (Mn+/M0) близок к величине
-0.41 В, то в зависимости от концентраций раствора и условий проведения электролиза буду восстанавливаться как металл, так и вода.
Таким образом, ионы активных металлов (в ряду напряжений от Li до Al включительно), на катоде не восстанавливаются, а протекает восстановление Н2О: 2Н2О + 2ē → Н2 + 2ОН-
В случае металлов средней активности, стоящих в ряду напряжений от Mn до Н2 происходят два параллельных процесса: восстановление металла и водорода воды.
Mn+ +nē →M0
2Н2О + 2ē → Н2 + 2ОН- (В суммарном уравнении электролиза обычно учитывают только восстановление металла).
В случае неактивных металлов с высокими значениями потенциалов, (в ряду напряжений после Н2), наблюдается только восстановление металла:
Mn+ +nē →M0
Б) Анод: процесс, протекающий на аноде, определяется составом аниона. В зависимости от того, из какого материала изготовлен анод, он может быть инертным (материал – графит, платина, золото) и растворимым (материал – медь, никель, олово, железо и т.п.).
Б1) Рассмотрим процессы, протекающие на инертных анодах.
Стандартный потенциал окисления воды на инертном аноде равен 1.229 В. Поэтому при наличии в водном растворе анионов с φ очередь на аноде будут окисляться частицы с наименьшей величиной потен- циала. Если потенциал аниона электролита выше 1.229 В, то на аноде будет окисляться вода до О2.
4 3 4 4
Кислородсодержащие ионы с элементами в высшей степени окисления (SO 2-, NO -, PO 3-, ClO -), а также фторид-ионы не окисляются – на аноде происходит окисление воды:2Н2О - 4ē → О2 + 4Н+.
Бескислородные анионы (кроме F-) окисляются на аноде до простых ве- ществ:
2Hal- - 2ē → Hal2 S2- - 4ē → S0
Фтор нельзя получить электролизом водных растворов, так как он реаги- рует с водой: 2F2 + 2Н2O = 4НF + О2.
3 2
В случае кислородсодержащих ионов с элементами в степени окисления, отличной от высшей (SO 2-, NO - и т.п.), происходит окисление до более окис- ленной формы:SO 2- + Н О − 2ē → SO 2- + 2Н+
3 2 4
NO - + Н О − 2ē = NO - + 2Н+
2 2 3
ClO - + H O − 2ē = ClO - + 2H+
3 2 4
IO - + 4ОН- − 2ē = H IO 3- + H O
3 2 6 2
2RCOO- - 2 ē → 2 CO2 + R-R
Б2) В случае растворимого анода все вышеперечисленные ионы не окис- ляются, а происходит процесс растворения самого анода.
Анод: M0 - nē → Mn+
Этот процесс широко используется в электротехнике для получения ме- таллов высокой степени чистоты и нанесения гальванических покрытий.
Пример: рассмотрим процессы, протекающие при электролизе водных рас- творов СuCl2, КCl, NiSO4, Na2SO3 c инертными электродами; а также электро- лиз раствора хлорида олова(II) на оловянном аноде.
а) В растворе СuCl2 существует в виде ионов Cu2+и Cl- . Медь находится в ряду напряжений после Н2, поэтому на катоде наблюдается восстановление только металла:
катод: Cu2+ + 2 ē = Cu0,
а на аноде окисляются хлорид-ионы и выделяется хлор: анод: 2Cl- -2 ē = Cl2.
Суммарное уравнение реакции: СuCl2 → Сu0 (катод) + Cl2 (анод).
б) В растворе КCl существует в виде ионов К+ и Cl- . Калий находится в ряду напряжений до Al поэтому, ионы металла не восстанавливаются на ка- тоде, а протекает восстановление Н2О:
катод: 2Н2О + 2 ē → Н2 + 2ОН- ,
а на аноде окисляются хлорид-ионы и выделяется хлор: анод: 2Cl- -2 ē = Cl2
Суммарное уравнение реакции:
2КCl + 2Н2О → Н2 (катод) + Cl2 (анод) + 2КОН
4
в) В растворе NiSO4 существует в виде ионов Ni2+ и SO 2-. Никель - ме- талл средней активности (в ряду напряжений находиться между Mn и Н2), по- этому на катоде происходят два параллельных процесса: восстановление ме- талла и водорода воды.катод: Ni2+ +2ē →Ni0
2Н2О + 2е → Н2 + 2ОН-
На аноде сульфат-ионы не окисляются – происходит окисление воды: анод: 2Н2О - 2ē → О2 + 4Н+
Суммарное уравнение реакции:
2NiSO4 + 2Н2О → 2Ni (катод) + О2 (анод) + 2Н2SO4
3
г) В растворе Na2SO3 существует в виде ионов Nа+ и SO 2-. Калий нахо- дится в ряду напряжений до Al поэтому, ионы металла не восстанавливаются на катоде, а протекает восстановление Н2О:катод: 2Н2О + 2 ē → Н2 + 2ОН- ,
А на аноде окисляются сульфит-ионы:
анод: SO32- + Н2О - 2 ē → SO42- + 2Н+
Суммарное уравнение реакции:
Na2SO3 + Н2О → Н2 (катод) + Na2SO4 (анод)
д) В растворе SnCl2 существует в виде ионов Sn+2 и Cl-. Олово находится в ряду напряжений между Mn и Н2, поэтому на катоде происходят два парал- лельных процесса: восстановление металла (основной процесс) и водорода воды (идет в незначительной степени):
катод: Sn2+ + 2 ē →Sn0
2Н2О + 2ē → Н2 + 2ОН-
Анод активный, изготовлен из того же металла, соль которого находится в растворе. Поэтому никакие ионы из раствора у анода не разряжаются, а происходит окисление материала самого анода (т.е. сам анод постепенно рас- творяется):
анод: Sn0 -2 ē → Sn2+
Суммарное уравнение реакции: Sn (анод) → Sn (катод)
Количество соли SnCl2 в растворе остается неизменным.
Таким образом, при осуществлении процесса электролиза с растворимы- ми электродами имеет место перенос материала электрода (в нашем случае олова) с анода на катод.
- Количественные соотношения при электролизе
Количественные расчеты процессов электролиза осуществляются на ос- новании законов М. Фарадея.
Первый закон Фарадея.Масса вещества, выделяющегося на электроде при электролизе, пропор- циональна количеству прошедшего через раствор электричества: m = k · Q,
где m – масса восстановленного или окисленного вещества (г); k – коэф- фициент пропорциональности (электрохимический эквивалент) (г/Кл); Q – количество электричества, прошедшего через электролит (Кл).
Кулон (Кл) – количество электричества, проходящее по проводнику при силе тока 1 ампер (А) за время 1 с.
Количество электричества Q рассчитывается как произведение силы тока
I в амперах на время t в секундах.
Q = I · t.
Электрохимический эквивалент (k) представляет собой массу вещества, которая восстанавливается на катоде или окисляется на аноде при прохожде- нии через раствор 1 Кл электричества. Величину электрохимического эквива- лента можно рассчитать по формуле:
k экв .
F
экв . ,
96500
где Mэкв. – молярная эквивалентая масса вещества (г/моль); F – постоян- ная Фарадея (F = 96500 Кл/моль).
Второй закон Фарадея.Массы окисляющихся и восстанавливающихся на электродах веществ, при пропускании через раствор одного и того же количества электричества, пропорциональны молярным массам их эквивалентов.
m1 M экв.1
m2 M экв.2
const.
Используя вышеприведенные формулы, можно производить ряд расче- тов, связанных с процессом электролиза, например:
вычислять количества веществ, выделяемых или разлагаемых опреде- ленным количеством электричества;
находить силу тока по количеству выделившегося вещества и времени, затраченному на его выделение;
устанавливать, сколько времени потребуется для выделения определен- ного количества вещества при заданной силе тока.
- Практическое применение электролиза
Электрохимические процессы широко применяются в различных облас- тях современных технических и технологических процессах. Например, в промышленных масштабах электролитически получают хлор и фтор, щелочи, хлораты и перхлораты, химически чистые водород и кислород.
В цветной металлургии электролиз используется для получения металлов из руд. Электролизом расплавленных сред получают алюминий, магний, ти- тан, цирконий, уран, бериллий и другие металлы. Для очистки металлов ис- пользуют электрохимическое рафинирование. Для этого из металла изготав- ливают активные электроды и помещают их в электролизер. Металл, подле- жащий очистке, при пропускании электрического тока подвергается анодно- му растворению и переходит в раствор в виде катионов, которые осаждаются на катоде в виде чистого металла. Примеси, находящиеся в аноде, остаются нерастворимыми (анодный шлам) или переходят в раствор электролита.
Гальванотехника – область прикладной электрохимии, занимающаяся процессами нанесения металлических покрытий на поверхность металличе- ских и неметаллических изделий при прохождении постоянного электриче- ского тока через растворы их солей. Гальванотехника подразделяется на галь- ваностегию и гальванопластику.
Гальваностегия (от греч. покрывать) – это электроосаждение на поверх- ность металла другого металла, который прочно связывается с покрываемым металлом (или специально обработанным неметаллическим предметом), слу- жащим катодом электролизера. Покрытие изделий цинком, кадмием, нике- лем, хромом, золотом и другими металлами придает изделиям не только кра- сивый внешний вид, но и предохраняет металл от коррозионного разрушения. Гальванопластика – получение путем электролиза точных, легко отде- ляемых металлических копий (матриц) с различных рельефных предметов. С
помощью гальванопластики изготовляют бюсты, статуи и т. д.
Большую роль гальванотехника играет в высоких технологиях таких, как микроструктурная техника, электроника и другие.
Кроме того, с помощью электролиза:
получают защитные и декоративные оксидные пленки на поверхности металлов (анодирование);
осуществляют электрохимическую размерную обработку металла
(электрохимическое фрезерование);
проводят обработку поверхности металлического изделия (электрохи-
мическое полирование);
осуществляют электрохимическое окрашивание металлов, проводят электрохимическую заточку режущих инструментов (например, хирургиче- ских ножей, бритв и т. д.);
наносят металлические покрытия на изношенные металлические по- крытия для ремонтных целей;
наносят эмалевые покрытия порошково-электростатическим методом.
- Коррозия металлов
Коррозия - это самопроизвольный процесс (ΔGo лов и сплавов в результате окислительно-восстановительного (химического или электрохимического) взаимодействия их с окружающей средой. Корро- зия, являясь нежелательным процессом, приводит к образованию из металлов оксидов, карбонатов, сульфидов, и др., которые термодинамически более ус- тойчивы, чем чистые металлы. Энергия, затраченная на получение металлов из руд :
Меn+ + nē → Ме0 (ΔG O, металлургия),
накапливается в них в виде свободной энергии и делает их активными, тер- модинамически неустойчивыми, т.е. металл стремится перейти в то естест- венное состояние, в котором он существует в природе:
Ме0 – nē → Ме n+(ΔG O, коррозия).
Причем, этот процесс чаще всего протекает самопроизвольно, то есть с уменьшением энергии Гиббса.
Химическая коррозия - это самопроизвольное разрушение металлов под действием газов или жидких окислителей-неэлектролитов, обычно газов и ор- ганических жидкостей, не проводящих электрический ток.
Газовая коррозия – это разрушение металла при контакте с сухими газами при высоких температурах. Она имеет место при работе двигателей внутрен- него сгорания, при химической обработке металлов, горячей прокатке, ковке, в энергетических установках и др. При газовой коррозии происходит химиче- ское взаимодействие металла с активными средами (CO2; H2S; O2; SO2; гало- генами).
Продуктами коррозии могут быть оксиды, хлориды, сульфиды, напри- мер: 4Fe + 3O2 → 2Fe2O3;
2Al + 3Cl2 → 2AlCl3;
4Ag + O2 + H2S → 2Ag2S + 2H2O.
Электрохимическая коррозия возникает при соприкосновении металла с электропроводящей средой (водой, водными растворами солей, кислот, ще- лочей; расплавами солей и щелочей.
Раньше электрохимическую коррозию называли гальванической корро- зией, поскольку разрушение металла происходит за счет образования на по- верхности металла так называемых гальванических пар (микрогальваниче- ских элементов). Причиной их образования может быть наличие в основном металле примесей других металлов или неметаллов, что приводит к появле- нию разности электродных потенциалов в местах их контакта и возникнове- нию микротока. В таком микрогальваническом элементе обычно участки от- носительно чистого металла поляризуются анодно, а примеси - катодно.
Причиной образования короткозамкнутых микрогальванических элемен- тов может служить не только наличие примесей в металле, но и любая энер- гетическая неоднородность его поверхности, вызванная неоднородностью химического или фазового состава как самого металла, так и окружающей его коррозионной среды. Наличие энергетической неоднородности на соседних участках металлической поверхности приводит к тому, что участок с более отрицательным электродным потенциалом становится анодом, а с более по- ложительным - катодом.
На аноде происходит окисление и растворение металла по схеме: Me0 - nē → Men+
Электроны, оставшиеся в металле, перемещаются с анода на катод (более по- ложительно поляризованный участок) и участвуют в процессе восстановле- ния.
Скорость окисления металлов в растворах электролитов, в частности в водных растворах неорганических кислот, зависит от природы кислоты и ме- талла, концентрации раствора, температуры и примесей, содержащихся в ки- слоте и металле. Так, в растворах кислот-окислителей (серной и азотной ки- слот) скорость растворения углеродистых сталей, в том числе и низколегиро- ванных, с увеличением концентрации электролита усиливается, достигая мак- симума, а затем резко снижается. Растворение практически прекращается в концентрированном растворе азотной (от 13 моль/л) и серной кислот (от 7.5 моль/л) - сталь пассивируется, что объясняется образованием на её поверхно- сти нерастворимой оксидной пленки.
В соляной кислоте этот процесс идет иначе. С ростом концентрации ки- слоты растворение металла непрерывно возрастает. В качестве примера рас- смотрим коррозию на стыке двух металлов - железа и меди в кислой среде. Стандартные электродные потенциалы железа и меди соответственно равны: φ0 Fe2+/Fe0 = - 0.44 B, φ0 Cu2+/ Cu0 = +0.34 B. Железо в этой паре металлов является
более активным (анодом) и поляризуется отрицательно по отношению к меди (катоду). При этом электроны с железной пластинки переходят на медь. Же- лезо, окисляясь до ионов Fe2+, растворяется по схеме: Fe0- 2ē →Fe2+.
Образующиеся при диссоциации HCl хлорид–ионы играют роль актива- торов коррозии многих металлов. Они характеризуются высокой адсорбируе- мостью на железе и повышают его растворимость в виде хлорида железа. Ио- ны же водорода на меди (катоде) принимают электроны, разряжаются до сво- бодного водорода по схеме:
2H+ + 2ē → H2
Это вызывает дальнейшее растворение железа вплоть до полного его раз- рушения. Хлорид железа, гидролизуясь, дает малорастворимый гидроксид железа Fe(ОН)2, который в свою очередь под влиянием атмосферного кисло- рода окисляется до Fe(ОН)3 по реакции:
4Fe(OH)2 + 2H2O + O2 → 4Fe(OH)3.
При дальнейшем преобразовании Fe(OH)3 образуется бурая ржавчина: Fe(ОН)3 → FeOOH + Н2О
Общее уравнение протекающей в данном процессе реакции:
Fe0 + 2H+ → Fe2+ + H2
тождественно простому растворению железа в кислоте. Однако в процессе коррозии окисление железа и восстановление водорода пространственно раз- делены и протекают на разных поверхностях, но сопряженных в общей цепи процесса.
Существуют различные способы защиты металлов от коррозии. Все существующие методы защиты металлов от коррозии сводятся к созданию условий, уменьшающих или полностью исключающих возможность протека- ния коррозионных процессов.
Легирование металлов - введение в состав металлов и сплавов компонентов (Cr, Ni, Si, Mo, W, Mg и др.), образующих на поверхности металлов плотные защитные пленки оксидов. Легирующие добавки повышают коррозионную стойкость металлов, работающих в агрессивных средах при высоких темпера- турах.
Защитные металлические и неметаллические покрытияДля создания покрытия применяют металлы, образующие на своей по- верхности защитные пленки. К таким металлам относятся Cr, Zn, Ni, Al, Sn и и другие. Металлические защитные покрытия обладают протекторным дейст- вием. Их нанесение осуществляют различными способами: гальваническим (гальванические покрытия), распылением расплавленного металла или окуна-
нием в расплавленный металл и др. По механизму защитного действия метал- лические покрытия делятся на катодные и анодные.
Катодное покрытие - это покрытие более активного металла менее ак- тивным. Примером катодного покрытия может служить железо, покрытое оловом (луженое железо). Тип покрытия легко определяется при нарушении его целостности. В этом случае и при наличии тонкой пленки влаги образует- ся гальваническая пара, в которой анодом является более активный металл - железное изделие, а катодом - менее активный металл (покрытие из олова). Более активный металл - железо - будет окисляться, корродировать, а на ме- нее активном металле - олове - будут протекать восстановительные процессы.
Катодный участок (φ0 2+
0= - 0.14 B):
Sn /Sn
2H+ + 2ē → H2O ( pH 7 ); или
H2O + O2 + 4 ē → 4OH- ( pH = 7 ).
Анодный участок (φ0 2+ 0= - 0.44 B):
Fe / Fe
Fe0 - 2 ē → Fe2+
Fe2+ + 2 OH- → Fe(OH)2
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3
Принцип защиты основан на том, что менее активный металл более стоек к коррозии, и пока он сохраняет целостность, основной металл защищён от коррозионно активной среды. В местах нарушения покрытия защищаемый металл будет подвергаться коррозии.
Анодное покрытие - это покрытие менее активного металла более ак- тивным, например, покрытие железа - цинком (оцинкованное железо). При нарушении целостности покрытия в образовавшемся гальваническом элемен- те металл покрытия (цинк) становится анодом и разрушается:
Zn0 – 2ē → Zn2+;
Zn2+ + 2OH-→ Zn(OH)2.
На обнажённом участке железа - катоде - будут идти процессы восстановле- ния: 2H+ + 2 ē → H2О (при рН 7) или H2O + O2 + 4ē → 4OH- ( pH = 7 ).
Таким образом, анодное покрытие будет защищать основной металл и при нарушении его целостности.
Диффузионная металлизация - это процесс насыщения стали алюмини- ем, хромом и др. с целью упрочнения или придания особых физико- химических свойств поверхностному слою изделия. Наиболее распростра- ненными способами металлизации являются алитирование (насыщение по- верхности металла алюминием), хромирование (насыщение поверхности ме- талла хромом), плакирование (нанесение поверхностного слоя в процессе со- вместного проката листов защищаемого и защищающего металла, например, покрытие стали алюминием) и метод окунания (изделие погружают в расплав
металла, температура плавления которого должна быть ниже температуры плавления самого изделия. Так покрывают стальные листы оловом, цинком, свинцом).
К неметаллическим покрытиям относят полимерные и лакокрасочные покрытия, обладающие высокими электроизоляционными свойствами. по- крытие химических аппаратов трубопроводов, цистерн, ёмкостей для пере- возки и хранения химических веществ. резиной и эбонитом, кислотоупорны- ми и жаростойкими свойствами.
- Диаграммы Латимера, Фроста, Пурбе
В настоящее время широко применяются графические способы представ- ления химии окислительно-восстановительных состояний элемента. Для это- го в первую очередь пользуются диаграммами Латимера, а также диаграмма- ми Фроста и диаграммами Пурбе.
- Диаграммы Латимера
Для оценки термодинамической устойчивости молекул или формульных единиц веществ и ионов, содержащих атомы одного и того же элемента в раз- ных степенях окисления удобно использовать диаграммы Латимера (У.М. Ла- тимер, 1953 г., США). Они представляют собой линейное изображение стан- дартных потенциалов взаимоперехода Red/Ox форм в водных растворах при рН=0 и рН=14. Диаграмма начинается с формы, имеющей наивысшую сте- пень окисления (слева) и заканчивается формой в низшей степени окисления (справа). Рассмотрим пример диаграммы Латимера для возможных форм мар- ганца, существующих в кислой и щелочной средах:
+0.564 B +2.26 B +0.95 B +1.51 B -1.18 B
(рН=0) MnO − → MnO 2− → MnO → Mn3+ → Mn2+ → Mn04 4 2
+0.564 B +0.60 B +0.15 B -0.23 B -1.56 B
(рН=14) MnO −→ MnO 2−→ MnO → Mn О → Mn(ОН) → Mn04 4 2 2 3 2
Над каждой стрелкой приводится табличное значение стандартного элек- тродного потенциала (φо) в расчете на один электрон.
+0.564 B
В данной диаграмме запись MnO − → MnO 2−
4 4
означает, что для полуреакции MnO − + ē → MnO 2− φо = 0.564 B.
4 4
Для расчета неизвестных потенциалов полуреакций пользуются значе- ниями уже имеющихся потенциалов ступеней восстановления.
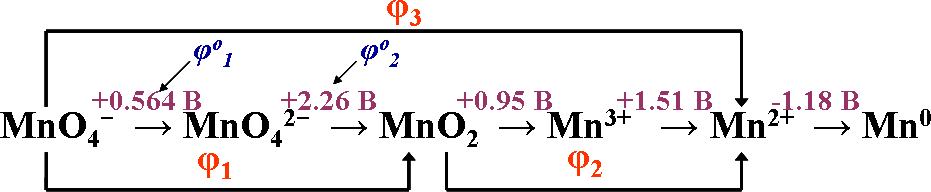
Весь расчет основан на аддитивности свободных энергий Гиббса ΔGo ступеней восстановления (функция φ не обладает таким свойством):
ΔGo = -nFφo, где n – число электронов, F – число Фарадея,
φo – стандартный потенциал выбранной ступени восстановления.
4
Так, для расчета перехода MnO − в MnO2 :ΔGo
=ΔGo +ΔGo = (–n φo F) + (–n φo F)
φ1 1 2 1 1 2 2
Учитывая, что для первого выбранного перехода
4 4 1
MnO − + 1ē → MnO 2− φо= 0.564 B, а для второго -
4
MnO 2− + 2ē → MnO2 φо 2= 2.26 B, тогда
1 2 2
ΔGo=(–n1φo F) + (–n φ o F)=(-1·0.564F)+(-2·2.26F) =-5.088F Дж,
0 Go1 nF
(5.088F ) 3F
1.70 B
Для выбранных на вышеприведенной схеме диаграммы Латимера φ1-φ3
соответственно:
MnO − + 4H+ + 3ē → MnО + 2H O φ o = 1.70 В;
4 2 2 1
2
MnO2 + 4H+ + 2ē → Mn2+ + 2H2O φ o = 1.23 В; MnO − + 8H+ + 5ē → Mn2+ + 4H O φ o = 1.51 В.4 2 3
По диаграммам Латимера легко предсказать :
Формы, образование которых в данных условиях невозможно. Для них характерно отрицательное значение потенциала. Так, для диаграммы Латиме- ра в кислой области такой формой является Mn0,, т.е. самопроизволный пере- ход Mn2+ + 2ē → Mn0 (φо = -1.18 B) невозможен. Однако обратная реакция Mn0
→ Mn2+ идет самопроизвольно.
Неустойчивые формы, склонные к диспропорционированию.
Как правило, значения потенциалов на всех диаграммах Латимера уменьша- ются слева направо. Поэтому указанием на склонность данной формы к дис- пропорционированию является нарушение монотонности уменьшения значе- ний потенциалов. Ион, подвергающийся диспропорционированию, выступает и в качестве окислителя (в диаграмме все формы слева направо – окислители) и в качестве восстановителя. Чтобы выступить в качестве восстановителя должно выполняться условие Δφо = φоок–φовосст 0 (т.е. значение потенциала φо над стрелкой справа относительно формы, склонной к диспропорционирова- нию должно быть больше, чем значение φо слева).
4
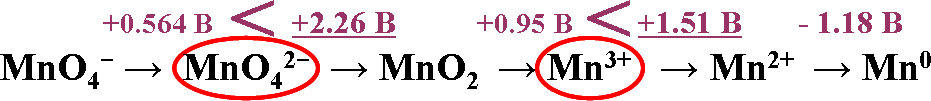 Так, на приведенной ниже схеме
Так, на приведенной ниже схеме диспропорционировать могут ионы MnO 2- и Mn3+:
3MnO 2− + 4Н+ → 2MnO − + MnO + 2Н О
4 4 2 2
2Mn3+ + 2Н2О → Mn2+ + MnO2 + 4Н+
- Диаграммы Фроста
Диаграммы вольт-эквивалент – степень окисления или диаграммы Фро- ста (А.А. Фроста, 1951 г., США) представляют собой графическое изображе- ние диаграмм Латимера в координатах: (Х) ось абсцисс– степень окисления (n); (Y) ось ординат– вольт-эквивалент (nφо) пары Xn+/Xo. Вольт-эквивалент (nφо) пары Xn+/Xo – это произведение стандартного электродного потенциала (φо) полуреакции Xn+ + nе → Xo на степень окисления (n).
В приведенной ниже таблице 4 собраны значения данных величин для всех существующих в растворе форм марганца:
Таблица 4. Значения степеней окисления, стандартных электроднывх потенциалов и величин вольт-эквивалент для форм марганца.
| Форма | Степень окисления (n) | φo(Mnn+/Mno), B | nφo, B |
| Mn0 Mn2+ Mn3+ MnO2 MnO 2- 4 MnO - 4 | 0 +2 +3 +4 +6 +7 | 0 -1.18 -0.283 0.025 0.77 0.74 | 0 -2.36 -0.85 0.10 4.62 5.18 |
Ниже приведена диаграмма Фроста для форм марганца в кислой (верхняя кривая) и щелочной (нижняя кривая) среде: устойчивые формы выделены на левом графике, а неустойчивые – на правом.
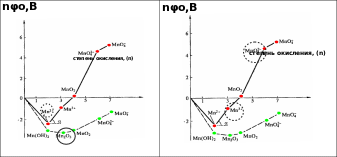
Начало координат соответствует очевидному условию nφ0 = 0 для пары Xn+/Xo при n=0 (для Mn0 наклон линий (tg α) равен стандартному электродно- му потенциалу сопряженной Red/Оx пары tgα = φо(Mn3+/Mn2+)).
По диаграммам Фроста наиболее устойчивой степени окисления элемен- та соответствует форма, которой отвечает минимум на кривой. В кислой сре- де такой формой является – Mn2+, в щелочной среде – Mn2O3.
4
Неустойчивые, склонные к диспропорционированию формы занимают положения с координатами точек, находящиеся выше линии, соединяющей соседние точки (правый график). При рН=0 для марганца такими формами являются Mn3+ и MnO 2-.- Диаграммы Пурбе
Для наглядности часто используют построение графика зависимости стандартного электродного потенциала от диапазона рН существования Red/Ox форм – диаграммы Пурбе. (М. Пурбе, 1963 г., Бельгия). Ниже приве- дена диаграмма Пурбе для всех форм брома(слева) и железа(справа) , сущест- вование которых возможно в растворе при определенных значениях рН.
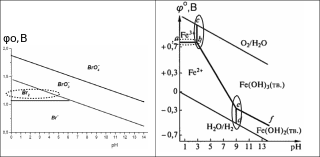
Диаграммы Пурбе обобщают химию водных растворов элементов и в наглядной форме показывают, какие химические частицы (ионы, молекулы) термодинамически устойчивы к окислению-восстановлению в зависимости от рН и значений стандартных электродных потенциалов. Такие диаграммы от- ражают взаимосвязь между фазами системы, а линии ограничения соответст- вуют переходам между фазами. По диаграммам можно определить продукты Red/Ox реакций при разных значениях рН среды в зависимости от значений стандартных электродных потенциалов. Так, зависимость φо от рН имеет пря- мую, если Red/Ox формы в некотором диапазоне рН одинаковы (на графике – это линия, разделяющая формы Br2 и Br - в диапазоне рН от 0 до 6.5, и отре- зок ab на диаграмме для железа). Если образуется малорастворимая кислота или осадок гидроксида, то на графике наблюдается излом (вертикальные от- резки сb и de при рН=3 и рН=9 для Fe(ОН)3 и Fe(ОН)2 соответственно).
- Глоссарий
Анод - электрод, на котором происходит процесс окисления. Анод отри- цательно заряжен в гальваническом элементе и положительно заряжен в про- цессах электролиза.
Внутримолекулярные ОВР – ОВР, в ходе которой степень окисления ме- няется у разных атомов, входящих в состав одной молекулы.
Водородный электрод - платиновая пластинка, покрытая платиновой чернью, погружённую в раствор кислоты с определённой концентрацией ио- нов водорода Н+.
Восстановление - это процесс принятия электронов окислителем.
Гальванический элемент — устройство, состоящее из катода, анода и электролита, генерирующих в замкнутой цепи электрический ток вследствие происходящих ОВР.
Диаграммы Латимера (У.М. Латимер, 1953 г., США). - линейное изо- бражение стандартных потенциалов взаимоперехода Red/Ox форм в водных растворах при рН=0 и рН=14.
Диаграммы Пурбе. (М. Пурбе, 1963 г., Бельгия).- график зависимости стандартного электродного потенциала от диапазона рН существования Red/Ox форм.
Диаграммы Фроста (А.А. Фрост, 1951 г., США) - диаграммы вольт- эквивалент – степень окисления или представляют собой графическое изо- бражение диаграмм Латимера в координатах: (Х) ось абсцисс– степень окис- ления (n); (Y) ось ординат– вольт-эквивалент (nφо) пары Xn+/Xo.
Диспропорционирование - ОВР, в ходе которой один элемент с неустой- чивой степенью окисления выступает одновременно в роли и окислителя, и восстановителя.
Инертный электрод – электрод, не окисляющийся в процессе электроли- за и служащий только для подвода электрического тока.
Катод - электрод, на котором происходит процесс восстановления. Катод положительно заряжен в гальваническом элементе и отрицательно заряжен в процессах электролиза.
Конпропорционирование – ОВР, в ходе которой атомы одного и того же элемента с неустойчивыми степенями окисления в разных молекулах (при совместном присутствии) превращаются в одно соединение этого элемента с устойчивой степенью окисления.
Межмолекулярные ОВР – ОВР, в которой атомы/ионы окислителя и вос- становителя находятся в молекулах разных веществ.
Окислительно-восстановительные реакции (ОВР) – реакции, которые идут с изменением степеней окисления элементов, входящих в состав реаги- рующих веществ.
Окисление – это процесс отдачи электронов восстановителем.
Стандартный электродный потенциал (0) - потенциал электрода, опу- щенного в 1 М раствор электролита.
Стандартный водородный электрод – водородный электрод, опущенный в раствор кислоты с концентрацией ионов водорода равна 1 моль/л. Его по- тенциал равен 0.
Степень окисления (OS) элемента в химическом соединении – это услов- ный заряд, который приписывается его атому в предположении, что вещество состоит из ионов (положительным считается заряд менее электроотрицатель- ного элемента).
Эквивалентная масса окислителя/восстановителя равна отношению мо- лярной массы окислителя к числу электронов, принятых/отданных 1 молеку- лой окислителя/ восстановителя.
Электрод (полуэлемент) - окислительно-восстановительная система, со- стоящая из металла, опущенного в раствор его соли.
Электродвижущая сила (ЭДС) гальванического элемента численно равна разности потенциалов катода и анода.
Электролиз - совокупность процессов, протекающих при прохождении постоянного электрического тока через систему, состоящую из двух электро- дов в растворе или расплаве электролита.
Электрохимический ряд напряжений металлов – ряд металлов, выстро- енный в соответствии с ростом величины стандартного потенциала полуреак- ции Mn+ + nē → M0.
- Вопросы и задачи
Какие реакции называются окислительно-восстановительными? Что назы- вается процессом окисления, восстановления?
Какие вещества называют окислителями, восстановителями? Каким обра- зом рассчитывается эквивалентная масса окислителя и восстановителя?
Как классифицируются окислительно-восстановительные реакции?
Приведите алгоритм составления уравнений окислительно- восстановительных реакций и расстановки коэффициентов методами элек- тронного и электронно-ионного баланса.
Чем определяется направление и глубина протекания окислительно- восстановительной реакции? Как можно использовать ряд напряжений метал- лов для определения направления протекания ОВР?
Чем отличаются понятия «электродный потенциал» и «стандартный элек- тродный потенциал» окислительно-восстановительной системы? От каких факторов зависит?
Какие процессы приводят к образованию двойного электрического слоя при погружении металлического электрода в раствор его соли?
Как влияет концентрация веществ, температура и рН среды на величину электродного потенциала?
Что представляет собой водородный электрод? Для каких целей использу- ется? Как зависит потенциал водородного электрода от рН раствора?
Потенциал какого электрода принимают равным нулю и используют в ка- честве электрода сравнения при измерении электродных потенциалов различ- ных металлов?
Чем определяется положение металлов в ряду напряжений? Как изменяет- ся окислительная и восстановительная активности металлов в ряду напряже- ний?
Какую информацию о химических свойствах металла можно получить по его положению в ряду напряжений?
В каких случаях сравнительная активность металлов может оцениваться по величинам ионизационных потенциалов их атомов, в каких случаях – по величинам стандартных электродных потенциалов металлов?
Почему цинк, алюминий, железо и другие сравнительно активные метал- лы не растворяются в воде (сравните стандартные значения потенциалов ме- таллов и потенциал водорода в воде)?
Почему медь, нерастворимая в воде, растворяется в щелочных растворах цианидов? Что при этом играет роль окислителя?
С учетом величины электродного потенциала водорода в водных раство- рах щелочей и способности металлов к образованию в щелочных растворах гидроксокомплексов оцените, какие металлы могут растворяться в щелочах.
Чем объяснить, что алюминий, железо и другие активные металлы встре- чаются в природе исключительно в форме соединений, в то время как основ- ной формой нахождения в природе золота является самородное золото, то есть простое вещество?
По величинам стандартных окислительно-восстановительных потенциа- лов сравните окислительную способность соединений марганца в кислой сре- де: КMnO4, К2MnO4, MnO2.
По величинам стандартных окислительно-восстановительных потенциа- лов сравните восстановительные свойства двухзарядных ионов:
Со+2, Сr+2, Fe+2, Mn+2, Pb+2, Sn+2.
Можно ли использовать перманганат калия в роли окислителя для сле- дующих превращений: Сr+3→ Сr+6, Pb+2→ Pb+4, Sn+2→ Sn+4 ?
Используя значения стандартных окислительно-восстановительных по- тенциалов, оцените наиболее вероятный продукт (I2, IO-, IO3-) окисления йо- дид-ионов под действием дихромата калия.
В каких пределах значений окислительно-восстановительных потенциалов
Red/Ox системы термодинамически устойчивы в водных растворах?
Является ли водный раствор перманганата калия термодинамически ус- тойчивым? Почему при длительном хранении водный раствор КMnO4 обес- цвечивается и при этом образуется осадок?
Составьте схему гальванического элемента и объясните процессы, проте- кающие в гальваническом элементе, состоящем из никелевой пластинки в растворе хлорида никеля и медной пластинки в растворе хлорида меди.
Какие процессы протекают на электродах при разрядке и зарядке свинцо- вого аккумулятора?
Что называется электролизом? Какие количественные данные можно по- лучить из законов Фарадея?
Одинаково ли заряжены электроды в гальванических и электролитических процессах?
Какие процессы протекают на аноде и катоде при электролизе расплавов?
Какие металлы можно получить при электролизе расплавов и нельзя по- лучить при электролизе водных растворов их солей?
Для каких металлов характер катодных процессов при электролизе рас- творов и расплавов их солей одинаков?
Почему при электролизе водных растворов солей не выделяются металлы, стоящие в ряду напряжений левее цинка?
Чем отличаются реакции, протекающие на неактивных (инертных) и ак- тивных (растворимых) электродах? Может ли растворяться катод при элек- тролизе?
Какие продукты образуются на электродах при электролизе водного рас- твора сульфата никеля с платиновыми электродами? Напишите уравнения электролиза в случае никелевого анода.
Укажите какие окислительно-восстановительные процессы протекают на инертных электродах при электролизе водного раствора хлората калия?
Хром находится в контакте с медью. Какой из металлов будет окисляться при коррозии, если эта пара металлов попадет в кислую среду (НСl)? Со- ставьте схему образующегося гальванического элемента, работающего при коррозии металла.
Какие процессы будут происходить при коррозии а) никелированного же- леза, б) оцинкованного железа?
Сопоставьте теорию ОВР и кислотно-основных равновесий по теории ки- слот и оснований Бренстеда-Лоури (сущность процесса, сопряженные пары, терминология). Приведите примеры.
Сопоставьте теорию ОВР и теорию кислот и оснований по Льюису (сущ-
ность процесса, сопряженные пары, терминология). Приведите примеры.
Назовите наиболее распространенные окислители, восстановители, веще- ства, обладающие двойственной окислительно-восстановительной функцией. Какие из этих веществ используются в промышленности, какие в лаборато- рии? Приведите примеры реакций с участием этих веществ.
Уравняйте следующие ОВР, используя метод электронного баланса. Ука- жите условия протекания реакций и степени окисления атомов, которые яв- ляются окислителями и восстановителями.
а) MnO2 + Na2O2 → Na2MnO4
б) (NH4)2Cr2O7 → N2 + Cr2O3 + H2O
в) Fe + FeCl3→ FeCl2
г) Fe + H2O → Fe3O4 + H2 д) NH4NO3 = N2O + H2O е) S(тв) + HI(г) = H2S(г) + I2(г) ж) Al + Fe3O4 = Fe + Al2O3 з) NH4NO2 = N2 + H2O
и) N2O4(ж) + N2H4(ж) = N2(г) + H2O(г)
к) WO3 + H2 = W + H2O
л) KBiO3 + HNO3 → Bi(NO3)3 + KNO3 + H2O + O2
м) K2FeO4 +H2O → KOH + Fe(OH)3 + O2 н) KMnO4 + H2O → MnO2 + KOH + O2 о) PbO2 + H2SO4 → PbSO4 + H2O + O2
п) Co2O3 + HNO3 →Co(NO3)2 + H2O + O2
р) Fe(OH)2 + O2 + H2O → Fe(OH)3
с) CrCl2 + O2 + HCl → CrCl3 + H2O
т) Si + 2KOH + H2O → K2SiO3 + 2H2
Уравняйте реакции методом электронно-ионного баланса, добавляя при
+ -
необходимости в правую часть уравнений ионы H , OH и (или) молекулы
H2O. Укажите окислитель и восстановитель в левой части уравнения. а) TlBr3 + 2Ag(тв) → TlBr(тв) + 2AgBr(тв)
3+
б) H2O2 + K2Cr2O7 + H2SO4 → Cr + …
3+
в) K2Cr2O7 + HI → Cr
-.
+ I3
г) Na4V6O17 + KI + H2SO4 → V2(SO4)3 + I2 +
2-
д) K2S2O8 + MnSO4 → SO4
-..
2-
+ MnO4
2-
е) NaI3 + Na2S2O3 → I + S4O6
ж) Si + NaOH + H2O → Na2SiO3 + H2
_
з) Cu(NO3)2 + KI → СuI(тв) + I3
.
и) KIO3 + H3AsO3 + HCl = ICl2 + H3AsO4
4-
к) XeO3 + KOH +O3 = XeO6 + O2
л) Ca + H2O = Ca(OH)2 + H2
Уравняйте реакции, протекающие в расплавах. а) K2Cr2O7 + S = Cr2O3 + K2SO4
б) MnO2 + KOH + KNO3 = K2MnO4 + KNO2 + …
в) Cr2O3 + O2 + Na2CO3 = Na2CrO4 + CO2
г) SnO2 + KCN(ж) = Sn + KCNO(ж)
Уравняйте реакции с участием органических веществ.
C2H4 + KMnO4 → HOCH2CH2OH + MnO2 + KOH
C2H5OH + KI3 + KOH → CHI3 + HCOOK + KI
C6H5CH3 + HNO3 → C6H5COOH + NO
.
4) C6H12O6 + Cu(OH)2 + KOH → C6H11O7 + Cu2O +
_
(CH3)2CO + Ca(OCl)2 → CHCl3 + CH3COO
C2H5OH + Mn2O7 → CO2 + H2O + MnO2
C12H22O11 + KClO3 → CO2 + H2O + KCl
Минералы подвергают: 1) обжигу в атмосфере кислорода; 2) действию концентрированной азотной кислоты. Запишите уравнения реакций и урав- няйте их.
а) Арсенопирит. Сu3AsS4 + O2 → CuO + As2O3 + SO2
Сu3AsS4 + HNO3(конц) → Cu(NO3)2 + H3AsO4 + H2SO4 + NO
б) Борнит. Cu5FeS4 + O2 → CuO + Fe2O3 + SO2
Cu5FeS4 + HNO3(конц) → Cu(NO3)2 + Fe(NO3)3 + H2SO4 + NO
в) Буланжерит. Pb5Sb4S4 + O2 → Pb3O4 + Sb2O3 + SO2 Pb5Sb4S4 + HNO3(конц) → Pb(NO3)2 + Sb2O5 + H2SO4 + NO
Уравняйте реакции (указаны все исходные вещества и продукты реакции): а) NH4ClO4 + P → Cl2 + N2 + H3PO4 + H2
б) SOCl2 + KMnO4 → K2SO4 + MnSO4 + KCl + Cl2
в) KCl + CuCl2 + F2 = K3CuF6 + ClF3
Какие процессы протекают при внесении металлической пластинки в во- ду, в раствор соли? Можно ли измерить потенциал, возникающий на границе металл-раствор?
Какие из приведенных ниже процессов следует проводить в щелочной среде?
а) Pb(IV) + Cr(III) → Pb(II) + Cr(VI)
б) Cl- + Mn(VII) → Cl2 + Mn(II)
а) Pb(IV) + Bi(III) → Pb(II) + Bi(V)
а) S(IV) + Cr(VI) → S(VI) + Cr(III)
б) Br2 + Fe(III) → Br-+ Fe(VI)
Почему с помощью соединений Cu(II) можно окислить иодид-ион, хотя электродный потенциал электрохимической системы Cu2+ + ē → Cu+ (φ0=0.15 B) меньше электродного потенциала, характеризующего равновесие в системе I2 + 2 ē → 2I- (φ0 = 0.54 B)? Дайте аргументированный ответ.
Объясните, почему серебро не окисляется кислородом воздуха, однако легко протекает реакция:
4Ag + O2 + 8KCN + 2H2O → 4K[Ag(CN)2] + 4KOH
Подтвердите термодинамическую возможность протекания данной реакции.
Почему смесь HNO3(конц.) + HF является одним из наиболее сильных окислителей в водных расвтворах?
Как влияет природа растворителя на протекание окислительно- восстановительных реакций? Приведите примеры.
Сравните воздействие малорастворимых осадков на смещение равновесия электродного процесса в следующих Red/Ox системах:
а) AgI🢙 + ē → Ag + I- (φ0 (Ag+/Ag0)= 0.80 B, ПРAgI=8.3•10-17)
б) Cu2+ + I-+ ē → CuI🢙 + (φ0 (Cu2+/Cu+)= 0.16 B, ПРCuI=1.1•10-12)
Что такое электродвижущая сила (ЭДС) гальванического элемента? Како- ва ее связь с изменением энергии Гиббса реакции, протекающей в гальвани- ческом элементе?
Рассчитайте ЭДС гальванического элемента, состоящего из стандартного медного электрода (φ0(Сu+2/Cu0)=+0.34 В) и водородного электрода в растворе с рН=8.
Какова ЭДС гальванического элемента, состоящего из двух водородных электродов, из которых один погружен в раствор с рН=2, а другой – в раство- ре с рН=10?
Каков потенциал никелевого электрода, погруженного в раствор NiCl2 c
концентрацией 10-2 моль/л? φ0 (Ni2+/Ni0) = -0.25B.
Для каждой окислительно-восстановительной пары составьте уравнения полуреакции, определите ΔG° процессов и укажите направление самопроиз- вольного протекания при стандартных условиях. Рассчитайте константы рав- новесия окислительно-восстановительных реакций.
3
а) φ°(NO -/NO)= 0.961 В б) φ°(NiO2/Ni-2+)= 1.593 В
4
в) φ°(PO 3-/P(бел.)
)= -0.411 В
Каков потенциал никелевого электрода, погруженного в раствор NiCl2 c
концентрацией 10-2 моль/л? φ0 (Ni2+/Ni0) = -0.25B?
ЭДС гальванического элемента, состоящего из стандартного медного электрода и водородного электрода 0.52В. Каков рН раствора у водородного электрода? φ0 (Cu2+/Cu0) = 0.34B
ЭДС медно-цинкового гальванического элемента 1.22В. Медный электрод находится в растворе с концентрацией ионов [Cu2+]=0.1моль/л. Определите концентрацию ионов [Zn2+] у цинкового электрода. φ0 (Cu2+/Cu0) = 0.34B, φ0 (Zn2+/Zn0)=-0.76B.
Какова ЭДС гальванического элемента, состоящего из двух водородных электродов, из которых один погружен в раствор с рН=3, а другой – в раство- ре с рН=8.
Какова ЭДС гальванического элемента, состоящего из железной пласти- ны, находящейся в растворе сульфата железа(II) c концентрацией ионов [Fe2+]=0.01моль/л, и оловянной пластины, находящейся в растворе хлорида олова(II) с концентрацией ионов [Sn2+]=0.001моль/л ? φ0 (Fe2+/Fe0) = -0.44B, φ0 (Sn 2+/ Sn0) = -0.14B.
7
2
В 1 л раствора содержится 0.1 моль хлорида хрома(III) и 0,01 моль дихро- мата калия, рН раствора = 3. φ0 (Cr3+/CrO42-) = 1.33 B. Вычислите потенциал системы Cr2O 2− + 14H+ + 6ē → 2Cr3+ + 7H O.Потенциал серебряной пластины, находящейся в насыщенном растворе
AgCl равен 0.51 В. Вычислите ПР хлорида серебра. φ0 (Ag+/Ag0)= 0.80B.
Стандартный электродный потенциал а) железного электрода φ0 (Fe2+/Fe0)
= -0.44B, б) кадмиевого электрода φ0 (Cd2+/Cd0)=-0.40B. Как изготовить галь- ванический элемент, в котором кадмиевый электрод был бы анодом, а желез- ный электрод катодом? Предложите не менее двух способов.
Каков потенциал серебряной пластины в растворе AgI, содержащем 0.1.моль/л KI? φ0 (Ag+/Ag0)= 0.80B, ПРAgI=8.3•10-17. Будет ли серебро раство- ряться в HI с выделением водорода?
Рассчитать ЭДС, ΔG°, Кр указанных ниже реакций. Что можно сказать о направлении самопроизвольного протекания процесса?
а) разрядка свинцового аккумулятора
PbO2(тв) + 2H2SO4 + Pb(мет) = 2PbSO4(тв) + 2H2O
б) работа сухого элемента
Zn + MnO2 + NH4Cl = [Zn(NH3)4 ]Cl2 + MnCl3 + H2O
в) электролиз раствора поваренной соли
NaCl + H2O = NaOH + Cl2 + H2
Почему рассчитанные значения отличаются от наблюдаемых в действитель- ности?
Каким окислителем: перманганатом калия, бихроматом калия или иодом можно окислить в стандартных условиях хлорид-ионы до свободного хлора? Можно ли хлорид олова(II) окислить иодом? Ответ подтвердите расчетами.
Проводится электролиз воды в присутствии: а)NaClO4, KNO3, б) HClO4, HNO3, в) NaOH, LiOH. Составьте уравнения электрохимических реакций.
Составьте уравнения электролиза водных растворов: а)MgI2, BaCl2 и KF,
б) смеси NaOH и NaCl.
Составьте уравнения электролиза расплавов: а)MgCl2, LiOH, CaBr2, Ba(OH)2, NaF и LiH, б) смеси KF и KCl.
При электролизе раствора хлорида кальция на катоде выделилось 5.6 г во- дорода. Какой газ выделился на аноде и какова его масса.
Имеется три железных пластины одинаковых размеров: а) без защитного покрытия, б) оцинкованная, в) лужёная. Со второй и третьей пластины удали- ли часть защитного покрытия, после чего все три пластины опустили в рас- твор соляной кислоты. В каком случае растворение железа будет протекать быстрее, а в каком медленнее? 1) Составьте схемы процессов, протекающих на катоде и на аноде и полное уравнение электролиза раствора сульфата ме- ди(II) с инертными электродами. 2) Составьте схемы процессов, протекаю- щих на катоде и на оловянном аноде при электролизе раствора хлорида оло- ва(II).
Что такое диаграмма Латимера? Как она строится? Как определить по этой диаграмме неизвестные электродные потенциалы?
По диаграммам Латимера рассчитайте значения потенциал перехода
7
По диаграммам Латимера рассчитайте значения φ 0 для перехода
2
На основании приведенной диаграммы Латимера рассчитать потенциал перехода MnO2/Mn2+
![]()
![]() На основании приведенной диаграммы Латимера рассчитать потенциал перехода Н3РO4/Р4:
На основании приведенной диаграммы Латимера рассчитать потенциал перехода Н3РO4/Р4:
Докажите, что в стандартных условиях бромоводородная кислота не мо- жет выступать в качестве восстановителя по отношению к соединениям желе- за(III).
Почему в кислой среде восстановление протекает глубже? На примере данной системы MnO4-. + 8H++ 5ē = Mn2+ + 4H2O (φ°(MnO4-/Mn2+) = 1.51 В) проанализируйте, как зависит величина окислительно-восстановительного потенциала от рН раствора, для чего вычислите значения потенциала в рас- творах с рН, равным 1 и 6. Концентрации ионов принять равными 1 М. По полученным данным построить зависимость φ° = f (pH).
Ахметов Н.С. Общая и неорганическая химия. М.: Высшая школа. 2003.
ч.1, разд. V, гл.6.
Неорганическая химия: в 3 т. Т.1. Физико-химические основы неорганиче- ской химии: учебник для студ. высш. учеб. Заведений / М.Е. Томм, Ю.Д. Третьяков. Под. Ред. Ю.Д. Третьякова. – М.: Академия, 2004. – 240 с.
О.М. Полторак, Л.М. Ковба. «Физико-химические основы неорганической химии». М.: МГУ, 1994, гл. 7, § 7.9.
Коренев Ю.М. Задачи и вопросы по общей и неорганической химии с отве- тами и решениями. – М.: Мир, 2004.-368 с.
В.И. Горшков, И.А. Кузнецов. «Физическая химия». М.: МГУ, 1993. гл.5, разд. 2, § 1-3.
А. Джонсон. Термодинамические аспекты в курсе неорганической химии. М.: Мир. 1985. Гл.4. стр.110-116, стр.134.
Анорганикум. Под ред. Л. Кольдица. М. Мир. 1984. Т.1. стр.308-316, стр.407-420, стр.540-545.
Хьюи Дж. Неорганическая химия. Строение вещества и реакционная спо- собность. М., Химия, 1987.
Дж. Кемпбел. Современная общая химия. М.:Мир. 1975 г. Т.2. с. 90. гл. 20.
Дикерсон Р., Грей Г., Хейт Дж. Основные законы химии. М.: Мир,1982. Т.2.
Б.Б.Дамаскин, О.А.Петрий. Электрохимия. М: Высшая школа, 1987.
CRC Hand book of Chemistry and Physics. 82 издание. 2001-2002.
ЭЛЕКТРОННО-ОБРАЗОВАТЕЛЬНЫЕ РЕСУРСЫ
http://www.edurt.ru/index.php?st=2526&type=3&lang=1
http://www.inorg.chem.msu.ru/index_r.php?topic=lit
http://www.chem.msu.su/rus/school/zhukov/18.html
http://znanium.com/catalog.php?item=booksearch&code=%D1%85%D0%B8%D0% BC%D0%B8%D1%8F
http://www.xumuk.ru/biochem/38.html
http://w-rabbit.narod.ru/chem/index.htm
http://www.bestreferat.ru/referat-120154.html
http://tanq.hut4.ru/diszip/himdiszip/ob/lekt/14.htm 9.http://vmede.org/sait/?page=7&id=Obwaja_himija_jolina_2012&menu=Obwaja_himija
_jolina_2012
Содержание
Введение…………………………………………………………………… 3
1. Расширенная программа……………………………………………….. 4
Степень окисления. Процессы окисления и восстановления ………. 5
Важнейшие окислители и восстановители…………………………… 6
3.1. Важнейшие окислители……………………………………………… 6
Важнейшие восстановители…………………………………………. 7
Соединения с окислительно-восстановительной двойственностью 7
Типы окислительно-восстановительных реакций……………………. 8
Составление уравнений окислительно-восстановительных реакций 9
Метод электронного баланса…………………………………………. 9
5.2. Метод электронно-ионного баланса (метод полуреакций)………… 11
Расчет эквивалентных масс окислителей и восстановителей………... 14
Двойной электрический слой. Электродные потенциалы…………… 14
8. Водородный электрод………………………………………………….. 15
Гальванический элемент. ЭДС………………………………………… 15
Стандартные электродные потенциалы. Электрохимический ряд напряжений металлов……………………………………………………… 16
Направление и глубина протекания ОВР…………………………….. 17
12. Уравнение Нернста……………………………………………………. 18
Влияние комплексообразования на величину потенциала окисли- тельно-восстановительной системы……………………………………… 19
Влияние на величину Red/Ox потенциала системы
образования малорастворимого соединения……………………………. 20
13. Окислительно-восстановительные свойства воды………………….. 21
14. Электролиз…………………………………………………………….. 22
Электролиз расплавов и растворов электролитов………………… 22
Количественные соотношения при электролизе………………….. 26
Практическое применение электролиза…………………………… 27
15. Коррозия металлов……………………………………………………. 28
16. Диаграммы Латимера, Фроста, Пурбе………………………………. 32
16.1. Диаграммы Латимера………………………………………………. 32
16.2. Диаграммы Фроста…………………………………………………. 34
16.3. Диаграммы Пурбе…………………………………………………... 35
17. Глоссарий……………………………………………………………… 37
18. Вопросы и задачи……………………………………………………... 39
Литература………………………………………………………………… 47
Электронно-образовательные ресурсы………………………………….. 47
Полезное для учителя





















