
Окислительно-восстановительные реакции

Классификация реакций
Все химические реакции можно разделить на 2 группы , в одних реакциях степень окисления атомов остается неизменной ( обменные реакции ), а в других реакциях она меняется – это окислительно-восстановительные реакции .
Протекание их связано с переходом электронов от одних атомов (ионов) к другим.
Процесс отдачи электронов - окисление , сопровождается увеличением положительной степени окисления или уменьшением отрицательной.
Процесс принятия электронов - восстановление , сопровождается уменьшением положительной степени окисления или увеличением отрицательной.
Атомы, молекулы или ионы, присоединяющие электроны, называются окислителями .
Атомы, молекулы или ионы, отдающие электроны, называются восстановителями .
Окисление всегда сопровождается восстановлением.
Окислительно-восстановительные реакции представляют собой единство двух противоположных процессов – окисления и восстановления.

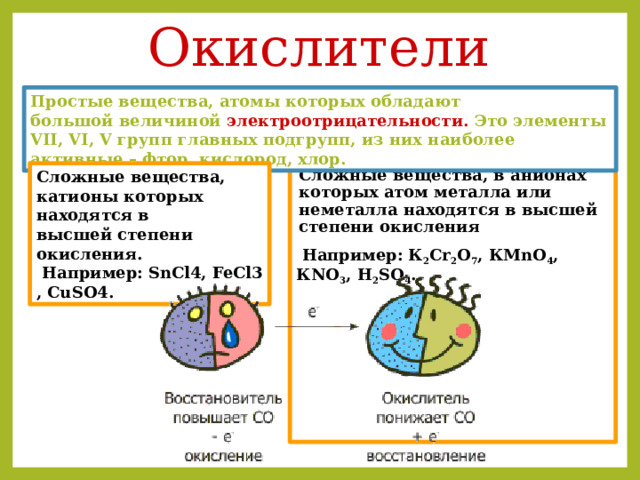
Окислители
Простые вещества, атомы которых обладают большой величиной электроотрицательности. Это элементы VII, VI, V групп главных подгрупп, из них наиболее активные – фтор, кислород, хлор.
Сложные вещества, катионы которых находятся в высшей степени окисления.
Например: SnCl4, FeCl3, CuSO4.
Сложные вещества, в анионах которых атом металла или неметалла находятся в высшей степени окисления
Например: К 2 Сr 2 O 7 , КМnO 4 , КNO 3 , H 2 SO 4 .

Восстановители
Элементы I, II, III групп главных подгрупп. Например: Na, Zn, H 2 , Al.
Сложные вещества, катионы которых находятся в низшей степени окисления. Например: SnCl 2 , FeCl 2 .
Сложные вещества, у которых анионы достигают предельной отрицательной степени окисления. Например: KI, H 2 S, NH 3 .
Вещества, ионы которых находятся в промежуточных степенях окисления могут быть как окислителем, так и восстановителем Например: Na 2 SO 3 .
Мерой восстановительных свойств служит величина энергии ионизации (это энергия, необходимая для последовательного отделения электронов от атома.)

5

5

Типы ОВР
Межмолекулярные
Внутримолекулярные
Диспропорционирования
Протекают с одновременным уменьшением и увеличением степени окисления атомов одного и того же элемента.
3HNO2 → HNO3 + 2NO + H2O
В межмолекулярных ОВР элементы окислитель и восстановитель находятся в разных веществах.
2 N 3+ + e = N 2+ - восстановление
Например:
1 N 3+ - 2е = N 5+ - окисление
SnCl 2 + 2FeCl 3 → SnCl 4 +2FeCl 2
2 Fe 3+ + e = Fe 2+ - восстановление
1 Sn 2+ - 2е = Sn 4+ окисление
Происходят с изменением степени окисления разных атомов в одной и той же молекуле. Например:
2 КClO 3 → 2KCl + 3O 2
2 Cl 5+ + 6e = Cl - - восстановление
3 2О 2- - 4е- = О 2 - окисление

Влияние среды на характер протекания ОВР
ОВР могут протекать в различных средах: в кислой (избыток Н 3 О + - ионов), нейтральной ( Н 2 О ) и щелочной (избыток ОН - - ионов).
В зависимости от среды может меняться характер протекания реакции между одними и теми же веществами. Среда влияет на изменение степени окисления атомов.
-
5

Окислительно-восстановительные реакции с перманганатом калия
1 . KMnO 4 (перманганат калия) является сильным окислителем, в сильнокислой среде восстанавливается до ионов Мn 2+ , в нейтральной среде - до MnO 2 (оксида марганца IV) и в сильно щелочной среде - до МnО 4 2- (манганат-иона).


Окислительно- восстановительная двойственность пероксида водорода
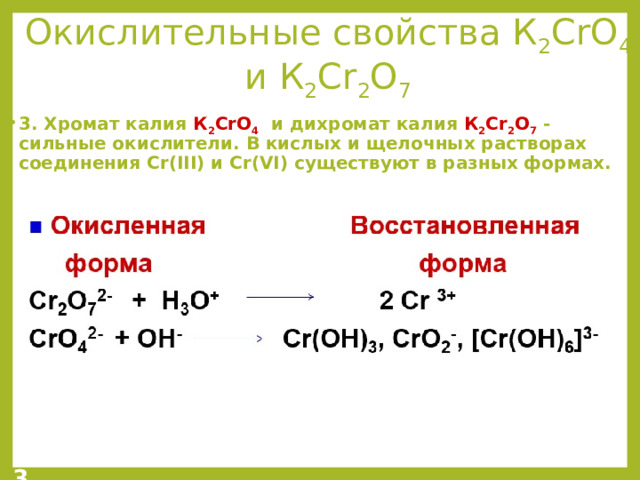
Окислительные свойства К 2 СrО 4 и К 2 Сr 2 О 7
- 3. Хромат калия К 2 СrО 4 и дихромат калия К 2 Сr 2 О 7 - сильные окислители. В кислых и щелочных растворах соединения Сr(III) и Сr(VI) существуют в разных формах.


Метод электронно-ионного баланса (метод полуреакций).
- Реакции, протекающие в кислой среде.
- Правило: если реакция протекает в кислой среде, то можно оперировать ионами Н 3 О+ (Н+) и молекулами воды. Ионы Н 3 О+ (Н+) записывают в той части уравнения полуреакции, где есть избыток кислорода, молекулы воды записывают соответственно в той части, где кислорода нет или есть недостаток его. Причем количество Н 3 О+ (Н+) берется в два раза больше, чем количество избыточных атомов кислорода.
5
1)Na2SO3 + KMnO4 + H2SO4 = Na2SO4 + MnSO4 + K2SO4 + H2O
2)В уравнении сократим те ионы, которые не принимают участие в процессе окисления-восстановления:
SO 3 2- + MnO 4 — + 2H + = Mn 2+ + SO 4 2- + H 2 O
3)Определить окислитель и восстановитель и составить полуреакции процессов восстановления и окисления.
В приведенной реакции окислитель — MnO 4 — принимает 5 электронов восстанавливаясь в кислой среде до Mn 2+ . При этом освобождается кислород, входящий в состав MnO 4 — , который, соединяясь с H + образует воду:
MnO 4 — + 8H + + 5e — = Mn 2+ + 4H 2 O
Восстановитель SO 3 2- — окисляется до SO 4 2- , отдав 2 электрона. Как видно образовавшийся ион SO 4 2- содержит больше кислорода, чем исходный SO 3 2- . Недостаток кислорода восполняется за счет молекул воды и в результате этого происходит выделение 2H + :
SO 3 2- + H 2 O — 2e — = SO 4 2- + 2H +
4) Найти коэффициенты для окислителя и восстановителя
Необходимо учесть, что окислитель присоединяет столько электронов, сколько отдает восстановитель в процессе окисления-восстановления:
MnO 4 — + 8H + + 5e — = Mn 2+ + 4H 2 O |2 окислитель, процесс восстановления
SO 3 2- + H 2 O — 2e — = SO 4 2- + 2H + |5 восстановитель, процесс окисления
5) Просуммировать обе полуреакции
Предварительно умножая на найденные коэффициенты, получаем:
2MnO 4 — + 16H + + 5SO 3 2- + 5H 2 O = 2Mn 2+ + 8H 2 O + 5SO 4 2- + 10H +
Сократив подобные члены, находим ионное уравнение:
2MnO 4 — + 5SO 3 2- + 6H + = 2Mn 2+ + 5SO 4 2- + 3H 2 O
6) Записать молекулярное уравнение
Молекулярное уравнение имеет следующий вид:
5Na 2 SO 3 + 2KMnO 4 + 3H 2 SO 4 = 5Na 2 SO 4 + 2MnSO 4 + K 2 SO 4 + 3H 2 O

- Na 2 Cr 2 O 7 + KBr + H 2 SO 4 = Cr 2 (SO 4 ) 3 + Br 2 + …
ок. вос. среда
1| Cr 2 O 7 2- + 14H + + 6e = 2Cr 3+ + 7H 2 O
3| 2Br - - 2e = Br 2
Cr 2 O 7 2- + 14H + + 6Br - = 2Cr 3+ + 7H 2 O + 3Br 2
Na 2 Cr 2 O 7 + 6KBr + 7 H 2 SO 4 = Cr 2 (SO 4 ) 3 + 3Br 2 +
3 К 2 SO 4 + Na 2 SO 4 + 7H 2 O
Na 2 Cr 2 O 7 - окислитель, восстанавливается;
KBr - восстановитель, окисляется.
5

Реакции, протекающие в щелочной среде.
Правило: если реакция протекает в щелочной среде , то можно оперировать ионами ОН- и молекулами воды . Ионы ОН- записываются в той части уравнения полуреакции, где есть недостаток кислорода, молекулы воды записываются соответственно в той части, где кислорода больше. Причем, на каждый недостающий атом кислорода записывают два иона ОН-.
5

Составление уравнения реакции между сульфитом натрия и перманганатом калия в щелочной среде.
Na2SO3 + KMnO4 + KOH = Na2SO4 + K2MnO4 + H2O
В ионном виде уравнение принимает вид:
SO32- + MnO4— + OH— = MnO2 + SO42- + H2O
В щелочной среде окислитель MnO4— принимает 1 электрон и восстанавливается до MnО42-. Восстановитель SO32-— окисляется до SO42-, отдав 2 электрона.
Полуреакции имеют следующий вид:
MnO4— + e— = MnО2 |2 окислитель, процесс восстановления
SO32- + 2OH—— 2e— = SO42- + H2O |1 восстановитель, процесс окисления
Запишем ионное и молекулярное уравнения , учитывая коэффициенты при окислителе и восстановителе:
SO32- + 2MnO4— + 2OH— = 2MnО42- + SO42- + H2O
Na2SO3 + 2KMnO4 + H2O = 2K2MnO4 + 3Na2SO4 + 2KOH
5
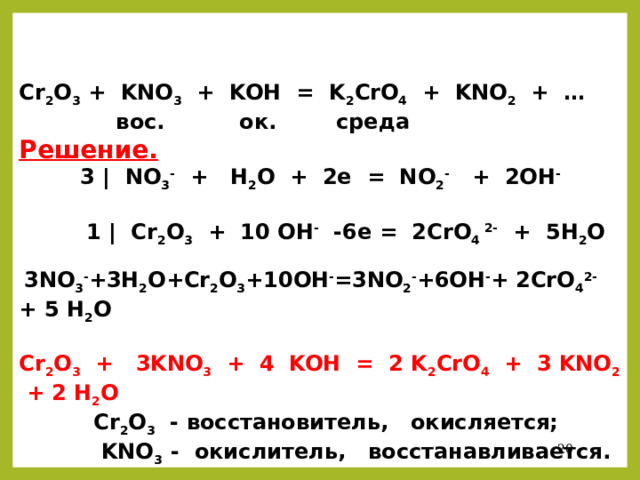
Cr 2 O 3 + KNO 3 + KOH = K 2 CrO 4 + KNO 2 + …
вос. ок. среда
Решение.
3 | NO 3 - + H 2 O + 2e = NO 2 - + 2OH -
1 | Cr 2 O 3 + 10 OH - -6e = 2CrO 4 2- + 5H 2 O
3NO 3 - +3H 2 O+Cr 2 O 3 +10OH - =3NO 2 - +6OH - + 2CrO 4 2- + 5 H 2 O
Cr 2 O 3 + 3KNO 3 + 4 KOH = 2 K 2 CrO 4 + 3 KNO 2 + 2 H 2 O
Cr 2 O 3 - восстановитель, окисляется;
KNO 3 - окислитель, восстанавливается.
5

Реакции, протекающие в нейтральной среде.
Правило: если реакция протекает в нейтральной среде, следует оперировать только молекулами воды. Причем избыток кислорода в окислителе связывается молекулами воды, за счёт ионов Н 3 О+ (Н+), на каждый избыточный атом кислорода расходуется одна молекула воды, которая ставится в левую часть уравнения полуреакции, в растворе накапливаются ОН- - ионы и ставятся они в правую часть уравнения полуреакции. Недостаток кислорода восстановитель восполняет из молекул воды за счет ОН- - ионов, на каждый недостающий атом кислорода расходуется одна молекула воды, которая ставится в левую часть уравнения полуреакции, в растворе накапливаются ионы Н 3 О+ (Н+) и ставятся они в правую часть уравнения полуреакции.
5

Пример 1
- KMnO 4 + Na 2 SO 3 + H 2 O = MnO 2 + Na 2 SO 4 + …
- ок. вос.
- Решение .
- 2 | MnO 4 - + 2H 2 O +3e = MnO 2 + 4 OH -
- 3 | SO 3 2- + H 2 O -2e = SO 4 2- + 2 H +
2 MnO 4 - +4H 2 O+3SO 3 2- +3H 2 O=2MnO 2 +8OH - + 6H + + 3SO 4 2-
- 2KMnO 4 +3Na 2 SO 3 + H 2 O = 2 MnO 2 + 3 Na 2 SO 4 + 2 KOH
КMnО 4 –окислитель, вос-ся; Nа 2 SО 3 –восстановитель, окис-ся
5

Пример 2
MnSO 4 + KMnO 4 + H 2 O = MnO 2 + K 2 SO 4 + …
вос. ок. среда
Решение.
2 | MnO 4 - + 2 H 2 O + 3e = MnO 2 + 4 OH -
3 | Mn 2+ + 2 H 2 O - 2e = MnO 2 + 4 H +
2MnO 4 - +4H 2 O+3Mn 2+ +6H 2 O=2MnO 2 +8OH - +3MnO 2 +12H +
3MnSO 4 +2KMnO 4 +2H 2 O=5MnO 2 +K 2 SO 4 +2H 2 SO 4
MnSO 4 - восстановитель, окисляется;
KMnO 4 – окислитель, восстанавливается.
5







































