Просмотр содержимого документа
«Окислительно-восстановительные реакции»

ГБПОУ «Починковский сельскохозяйственный техникум»
Окислительно -
восстановительные
реакции
Познавая бесконечное, наука сама бесконечна.
Д.И. Менделеев

Цель урока: сформировать понятие об окислительно-восстановительных реакциях; научить учащихся уравнивать записи ОВР методом электронного баланса

Что мы узнаем
Какие реакции называются окислительно-восстановительными реакциями.
Чему научимся
Уравнивать записи окислительно-восстановительных реакций методом электронного баланса

Проблемная тема урока:
«Кто-то теряет, а кто-то находит»

1 задание
Повторение
Что такое степень окисления?
Сумма степеней окисления химических элементов в соединении равна 0
x
3 ·(-2) + 2 ·x=0
- 2
Al 2 O 3
- 6 + 2 ·x=0
2 ·x=6
X = 3
+ 3

Определите степени окисления элементов в соединениях
- 1 группа – P, PH3, P2O3, H3PO4
- 2 группа – S, SO2, H2S, Н2SO4
- 3 группа –C, CH4, CO, H2CO3
- 4 группа –CI2, HCI, CI2O, HCIO4

2 задание
- Определите тип химической связи и распределите их по следующим схемам:
- 1
- 2

- 1) NaOH + HCl → NaCl + H2O 7) NaNO3 → NaNO2 + O2
- 2)Fe2O3 + H2 → H2O + Fe 8)Al + S → Al2S3
- 3) CaCO3 → CaO + CO2-Q 9) PbO + Al → Al2O3 + Pb
- 4) Fe + Cl2 → FeCl3 10) Al(OH)3 →Al2O3 + H2O-Q
- 5) H2 + CuO → Cu + H2O 11)NaOH + H2SO4 →Na2SO4 + H2O
- 6)C + O2 → CO2+Q 12)Mg + O2 → MgO + Q
- ОВР с участием простых и сложных неорганических веществ
- Выписать из предложенных реакций отдельно овр с участием простых и с участием сложных веществ
- 1. 2.
Расставление коэффициентов с помощью алгоритма составления электронного баланса
- 1. Запишите формулы исхoдных вeщecтв и прoдуктoв рeaкции:
FeCl 3 + H 2 S → FeCl 2 + S + HCl
- 2. Определите, какое вещество является окислителем, а какое восстановителем и их степени окисления до и после реакции.
Fe +3 Cl 3 + H 2 S -2 → Fe +2 Cl 2 + S 0 + HCl
- 3. Хлорид железа(III) выполняет роль окислителя. Сероводород является восстановителем.
Соcтавьте электронные урaвнeния, вырaжaющиe прoцeccы вoccтанoвлeния и окисления. По измeнeнию степеней окисления oпрeдeлим чиcлo электронов, oтдaвaeмыx восстановителем, и чиcлo электронов, принимaeмыx окислителем:
- восст. S -2 – 2 e = S 0 │ 2 │ 1 процесс окисление
- окис. Fe +3 +1 e = Fe +2 │ │ 2 процесс восстановление
4. Множители электронного баланса запишем в уравнение окислительно-восстановительной реакции кaк ocнoвныe стехиометрические коэффициенты:
2 FeCl 3 + H 2 S → 2FeCl 2 + S + HCl
- 5. Подберем стехиометрические коэффициенты ocтaльныxучacтникoв рeaкции, пeрeйдeм oт сxeмы к уравнению реакции (ставим знак равенства вместо стрелки).
- 2FeCl 3 + H 2 S = 2FeCl 2 + S + 2HCl.
- 6. Проверим правильность написания путeм пoдcчeтa aтoмoв кaждoгo элeмeнтa в лeвoй и прaвoй чaстях уравнения реакции.

Восстановление перманганата калия в кислой среде
MnSO 4 + I 2 + K 2 SO 4 + H 2 O
+7
-1
+6
+6
0
+2
KMnO 4 + KI+ H 2 SO 4
Mn +7 + 5e - Mn +2 2 пр. восстан-я окислитель
2I -1 - 2e - I 2 0 5 пр. окисления восстановитель
Молекулярное уравнение:
KMnO 4 + KI + H 2 SO 4 = MnSO 4 + I 2 + K 2 SO 4 + H 2 O
2
2
10
5
6
8
8

Восстановление перманганата калия в щелочной среде
+4
+7
+6
+6
K 2 MnO 4 + K 2 SO 4 +H 2 O
KMnO 4 + K 2 SO 3 + KOH
Mn +7 +1e - Mn +6 2 пр.восстон-я окислитель
S +4 -2e - S +6 1 пр.окисления восстановитель
Молекулярное уравнение:
KMnO 4 + K 2 SO 3 + KOH = K 2 MnO 4 + K 2 SO 4 + H 2 O
2
2

Восстановление дихромата калия в кислой среде
Fe 2 (SO 4 ) 3 + K 2 SO 4 + Cr 2 (SO 4 ) 3 + H 2 O
+6
+2
+3
+3
K 2 Cr 2 O 7 + FeSO 4 + H 2 SO 4
- 2Cr +6 + 6e Cr +3 2 1 пр.восстановления окислитель
- Fe +2 -1e Fe +3 6 пр.окисления восстановитель
Молекулярное уравнение:
- K 2 Cr 2 O 7 + FeSO 4 + H 2 SO 4 → Fe 2 (SO 4 ) 3 +K 2 SO 4 +Cr 2 (SO 4 ) 3 + H 2 O
6
7
3
7
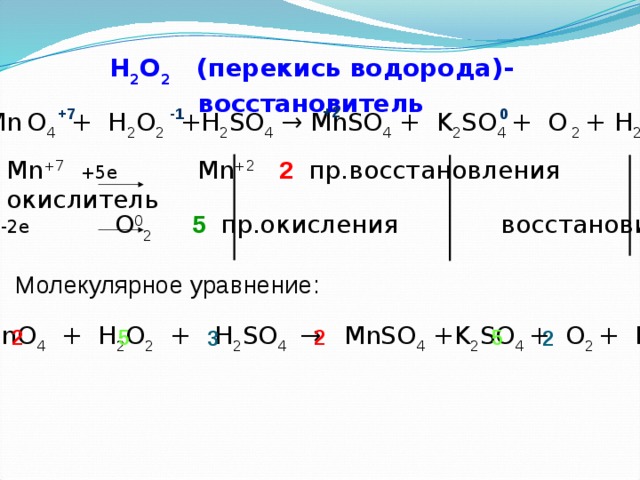
H 2 O 2 (перекись водорода)- восстановитель
+2
+7
-1
0
KMn O 4 + H 2 O 2 +H 2 SO 4 → MnSO 4 + K 2 SO 4 + O 2 + H 2 O
Mn +7 +5e Mn +2 2 пр.восстановления окислитель
2O -1 -2e O 0 2 5 пр.окисления восстановитель
Молекулярное уравнение:
KMnO 4 + H 2 O 2 + H 2 SO 4 → MnSO 4 +K 2 SO 4 + O 2 + H 2 O
5
2
5
2
3
2

я научился…
было интересно…
было трудно…
мои ощущения…
больше всего… понравилось...

- Молодцы! Спасибо всем за внимание.































