
Оксид фосфора (V). Ортофосфорная кислота. Ортофосфаты

Оксид фосфора (V)
P 2 O 5

Физические свойства
Оксид фосфора (V) Р2О5 — белый гигроскопичный порошок (поглощает воду), следует хранить в плотно закрытых сосудах.

Химические свойства
P2O5 – типичный кислотный оксид.
1) При взаимодействии с водой образует на холоде метафосфорную кислоту НРО3:
P2O5 + H2O 2HPO3
при нагревании - ортофосфорную кислоту Н3РО4:
P2O5 + 3H2O 2H3PO4
2) Как кислотный оксид, вступает в реакции с основными оксидами:
P2O5 + 3CaO → Ca3(PO4)2
3) Реагирует со щелочами:
P2O5 +3Ca(OH)2 → Ca3(PO4)2 + 3H2O

Получение
Получается при горении фосфора в избытке воздуха или кислорода
4P + 5O 2 = 2P 2 O 5

Применение
Оксид фосфора (V) очень энергично соединяется с водой, а также отнимает воду от других соединений. Применяется как осушитель газов и жидкостей.
Ортофосфорная кислота
- H 3 PO 4 - бесцветное твердое кристаллическое вещество. Температура плавления +42ºС, хорошо растворяется в воде.
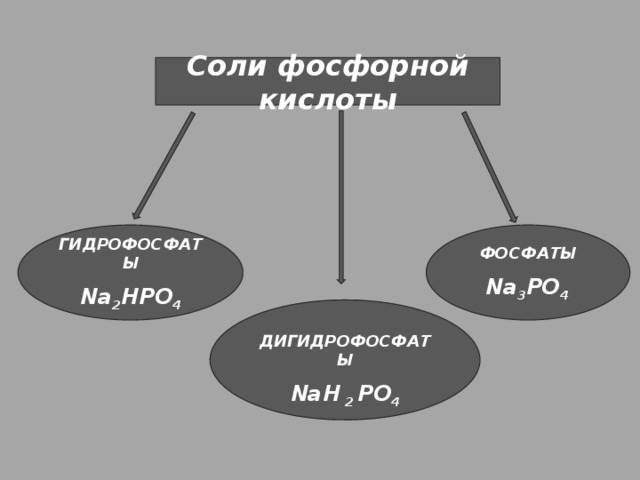
Соли фосфорной кислоты
ФОСФАТЫ
ГИДРОФОСФАТЫ
Na 2 HPO 4
Na 3 PO 4
ДИГИДРОФОСФАТЫ
NaH 2 PO 4

Получение
Р2O5 + 3H2O=2H3PO4
Взаимодействие оксида фосфора (V) с водой при нагревании.
Этим способом получают чистую фосфорную кислоту, которую используют в пищевой промышленности как добавку к безалкогольным напиткам.

Получение
1.Реакции неполной нейтрализации
H3PO4 + 2NaOH → Na2HPO4 + 2H2O гидрофосфат натрия H3PO4 + NaOH → NaH2PO4 + H2O дигидрофосфат натрия
2.Реакция полной нейтрализации
H3PO4 + 3NaOH → Na3PO4 + 3H2O фосфат натрия

Физические свойства
Соли фосфорной кислоты – кристаллические вещества.
Средние соли, или фосфаты (например, Са3(РО4)2), нерастворимы в воде, кроме фосфатов щелочных металлов.
Кислые соли – дигидрофосфаты (например, Са(Н2РО4)2), большинство хорошо растворимы в воде.
Кислые соли - гидрофосфаты (например, СаНРО4), малорастворимы в воде (кроме гидрофосфатов натрия, калия и аммония), т.е. занимают промежуточное положение между фосфатами и дигидрофосфатами по растворимости.

Фосфат кальция
Фосфат калия
Фосфат аммония
Фосфат серебра

Химические свойства
Фосфорная кислота вступает во многие реакции, характерные для кислот:
1). С металлами, стоящими в ряду напряжения металлов до водорода:
3Mg + 2H3PO4 Mg3(PO4)2 + 3H2↑
2). С основными оксидами:
3CaO + 2H3PO4 Сa3(PO4)2 + 3H2O
3). С основаниями и аммиаком:
- H3PO4 + 3NaOH → Na3PO4 + 3H2O
H3PO4 + 2NH3 → (NH4)2HPO4
4).С солями слабых кислот:
2H3PO4 + 3Na2CO3 → 2Na3PO4 + 3H2O + 3CO2↑
5).При действии раствора нитрата серебра появляется желтый осадок:
H3PO4 + 3AgNO3 → Ag3PO4 ↓ + 3HNO3

Применение
- Фосфорную кислоту используют:
- в производстве фосфорных удобрений;
- в производстве кормовых добавок для животноводства;
- в производстве моющих средств (фосфаты щелочных металлов);
- для создания защитных покрытий на металлах.

Ортофосфаты
Ортофосфорная кислота образует три ряда солей (с металлами)

Химические формулы ортофосфатов
Ортофосфаты, содержащие металлы
одновалентные
двухвалентные
Me₃PO₄
Me₂HPO₄
Ортофосфаты Me₃(PO₄)₂
трехвалентные
Гидрофосфаты MeHPO₄
MeH₂PO₄
MePO₄
Дигидрофосфаты Me(H₂PO₄)₂
Me₃(PO₄)₃
Me(H₂PO₄)₃

Применение
Ортофосфаты и гидроортофосфаты кальция и аммония широко используют в качестве удобрений, ортофосфат и гидроортофосфат натрия – для осаждения из воды солей кальция.

Проверь себя
Составьте уравнения реакций по схеме:
- Р 2 О 5 →Н 3 РО 4 →Na 3 PO 4 →Ca 3 (PO 4 ) 2 →H 3 PO 4 →Zn 3 (PO 4 ) 2
- P → Ca 3 P 2 → PH 3 → Р 2 О 5 → Na 3 PO 4 → Ag 3 PO 4
- Ca 3 (PO 4 ) 2 → P → PCl 5 → Н 3 РО 4 → K 3 PO 4 → Fe 3 (PO 4 ) 2












































