Урок №37 8 класс «____»_____20____г.
Тема: Оксиды. Классификация. Номенклатура.
Цель: сформировать понятие о кислотных, основных и амфотерных оксидах, определить признаки для классификации оксидов.
Задачи: О: ознакомиться с составом и физическими свойствами оксидов; разобрать образование названий оксидов; рассмотреть распространение оксидов в природе. Р: развивать умения давать названия формулам оксидов и их составлять. В: формировать познавательный интерес к предмету.
Планируемые результаты обучения
Личностные: развитие познавательного интереса к предмету.
Метапредметные: познавательные: находить сходство и различие между веществами, обобщать полученную информацию, классифицировать вещества; информационно-коммуникативные: умение формулировать определения; регулятивные: выполнять учебное задание в соответствии с поставленной целью. Оценивать свои учебные достижения.
Предметные: формулировать определения, распознавать оксиды среди других веществ, составлять формулы оксидов и называть их, описывать физические свойства оксидов.
Оборудование и материалы: Образцы оксидов, таблица растворимости, периодическая система химических элементов.
Понятия: оксиды, бинарные соединения, валентность, оксиды: кислотные, основные, амфотерные, несолеобразующие оксиды.
Тип урока: изучение новых знаний.
Структура урока
I. Организационный этап....................................................1—2 мин
II. Актуализация и мотивация знаний …........................... 5 мин
III. Изучение нового материала............................................ 20 - 25мин
1. Оксиды. Классификация. Номенклатура.
2. Физические свойства оксидов.
3. Распространение оксидов в природе.
IV. Первичное закрепление знаний ……………………………10 мин
V. Домашнее задание........................................................... 1 - 2 мин
VI. Подведение итогов урока................................................ 2 мин
VII. Рефлексия ………………………………………………….. 1 - 2 мин
ХОД УРОКА
Организационный этап (проверка готовности класса к уроку)
Актуализация и мотивация знаний
Какие вещества называются простыми, а какие сложными веществами?
Какими химическими свойствами обладает кислород? (Взаимодействует с простыми веществами (металлами и не металлами) и сложными (органическими))
Как называются вещества получаемые в результате горения? (Оксиды)
Изучение нового материала
Представьте себе, что это не класс.
Отправимся, все мы на 40 минут,
В страну, где оксиды нас ждут.
В химическом царстве они все живут,
Оксиды окружают нас в жизни всегда.
Одни – как источник жизни, другие – как зла.
Учащиеся записывают тему урока, формулируют цель урока.
Оксиды. Классификация. Номенклатура.
Используя Схему 4 С131 учебника, учащиеся знакомятся с основными классами неорганических соединений. Заполняют таблицу.
Основные классы неорганических соединений
| Соединения | Оксиды С132 | Гидроксиды Основания | Кислоты | Соли |
| Общая формула | R nО n | Ме(ОН)n | H к.о. | Ме к.о. |
| Примеры | Н2О | Са(ОН)2 | НС1 | NaCl |
Коллективное обсуждение с записью определения
Оксиды — это бинарные соединения, состоящие из химических элементов, один из которых — кислород.
Важнейшими классами бинарных соединений являются оксиды и водородные соединения.
Обратите внимание, что это не два атома, например Н2, а атомы двух разных элементов. В названии оксидов должен быть суффикс -ид.
Схема 5 С132 - 133 учебника преобразовываем ее и записываем
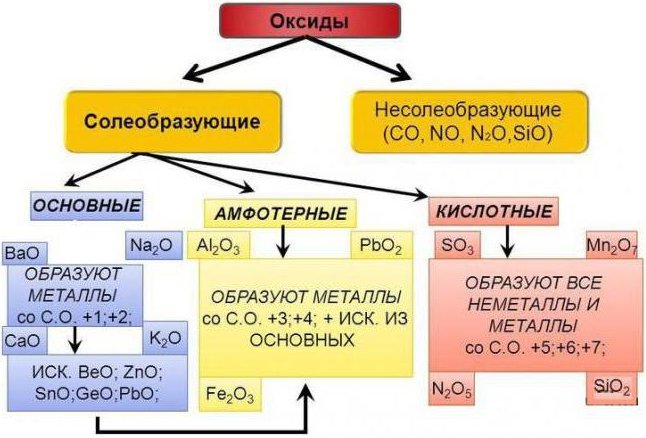
Даем названия оксидам используя таблицу 7 С133.
Физические свойства оксидов. Работа с учебником С13.
Учащиеся знакомятся с физическими свойствами оксидов (выясняют агрегатное состояние рассматриваемых оксидов)
Демонстрация. Учитель демонстрирует образцы оксидов.
Твердые: оксид меди (II) CuО, оксид кальция СаО.
Жидкие: оксид серы (VI) SО3.
Газообразные: оксид углерода (IV) СО2
В минеральной воде я бурлю,
В топочном газе летаю,
Растениям пользу несу,
Пожар затухать заставляю
Распространение оксидов в природе.
Из атомов мир создавала Природа.
Два атома лёгких взяла водорода.
Прибавила атом один кислорода
И получилась частица воды,
Море воды, океаны и льды…
Стал кислород чуть не всюду начинкой.
С кремнием он обернулся песчинкой.
В воздух попал кислород,
Как ни странно,
Из голубой глубины океана.
И на Земле появились растения,
Жизнь появилась: дыханье, горение…
Первые птицы и первые звери,
Первые люди, что жили в пещере…
Огонь добывали при помощи трения,
Хотя и не знали причины горения…
Прослушав стихотворение учащимся предлагается записать оксиды (оксид водорода (вода) Н2О, оксид кремния SiО2, оксид углерода (IV) СО2).
Далее учащиеся продолжают знакомится с распространением оксидов в природе оксид железа (III) Fe2О3, оксид алюминия А12О3, оксид кальция СаО.
Первичное закрепление знаний
Задание 6 С135 Выведите химическую формулу оксида, если известно, что натрий с кислородом соединяется в массовом отношении 2,3 : 0,8.
|
|
| Na | O |
| Находим количество атомов | m | 2.3 | 0.8 |
| Mr | 23 | 16 |
| делим на наименьшее |
| 0,1 | 0,05 |
|
|
| 2 | 1 |
| Ответ: формула оксида Na2O |
Задание На скрытой доске вперемешку заранее записаны формулы веществ, учащиеся отличают оксиды от других классов соединений и называют их.
Например: Na2О, NaOH, CuO, Cu(OH)2, Fe(OH)3, Fe2О3 , SО2, СО2, КОН. LiOH, H2SО4, HCl, MgO, Ca(OH)2, H2CО3, КС1, HCl, КОН, К2О ; FeO, FeCl3, HNО3, SО3, H2SО4, MgSО4.
Домашнее задание Изучить §40. Выполнить №1
Подведение итогов урока
Рефлексия




















