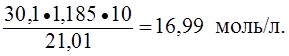СДЕЛАЙТЕ СВОИ УРОКИ ЕЩЁ ЭФФЕКТИВНЕЕ, А ЖИЗНЬ СВОБОДНЕЕ
Благодаря готовым учебным материалам для работы в классе и дистанционно
Скидки до 50 % на комплекты
только до
Готовые ключевые этапы урока всегда будут у вас под рукой
Организационный момент
Проверка знаний
Объяснение материала
Закрепление изученного
Итоги урока

Была в сети 24.09.2025 08:17

Кузнецова Татьяна Александровна
преподаватель
Местоположение
Россия, Краснодар
Специализация
Определение титра, эквивалентной концентрации (нормальности) и титра раствора по определяемому веществу.
Категория:
Химия
23.02.2019 23:40


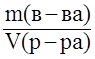 ; (г/мл).
; (г/мл).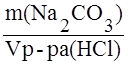 ; г/мл.
; г/мл.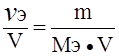 ; моль/л; Сэ = N =
; моль/л; Сэ = N = 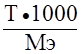 ;
;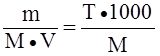 ; моль/л
; моль/л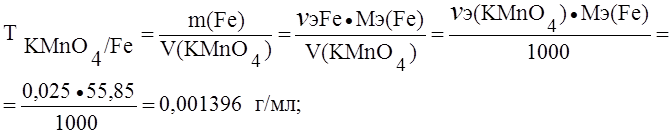
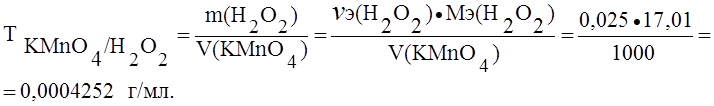
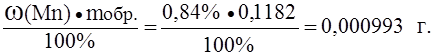
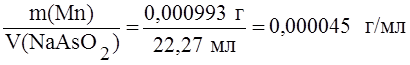 .
.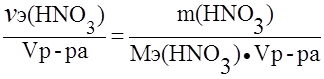 ;
;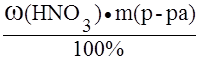 ; если масса раствора равна 100 г, то m(HNO3) = w(HNO3) = 30,1 г;
; если масса раствора равна 100 г, то m(HNO3) = w(HNO3) = 30,1 г;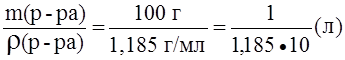 ;
;