№ 3 - сабак
I.Сабактын темасы. ЧЕКТҮҮ УГЛЕВОДОРОДДОР (АЛКАНДАР)
УГЛЕВОДОРОДДОР ЖӨНҮНДӨ TYHIYHYK
Органикалык заттардын айрым класстарын окуп-уйренууну углеводороддор (ациклдуу ~ тизмектүү) менен таанышуудан баштайбыз.
Органикалык заттардын ичинде молекуласынын курамы эки химиялык элементтен тургандары да бар. Алар ете эле кеп турдуу болуп жаратылышта кенири таркалган заттар. Углеводороддор эки элементтен тургандыктан женекей курамдагы бирикмелердин катарына кирет.
Молекуланын курамы кемуртек жана суутек элементтеринен турган органикалык заттарды углеводороддор деп атай- быз. Углеводороддор бардык органикалык заттардын башатын тузушет. Биз жогоруда айтып кеткендей углеводороддордун курамындагы суутектин атомдору башка атомдор жана атом- дордун топтору менен алмашканда бардык органикалык заттардын негизги класстарынын екулдеру, мисалы, углеводороддордун галогендуу туундулары (CL, Br, J) спирттер, нитробирикмелер, аминдер жана аминокислоталар ж. б. келип чыгат.
*
2-схема
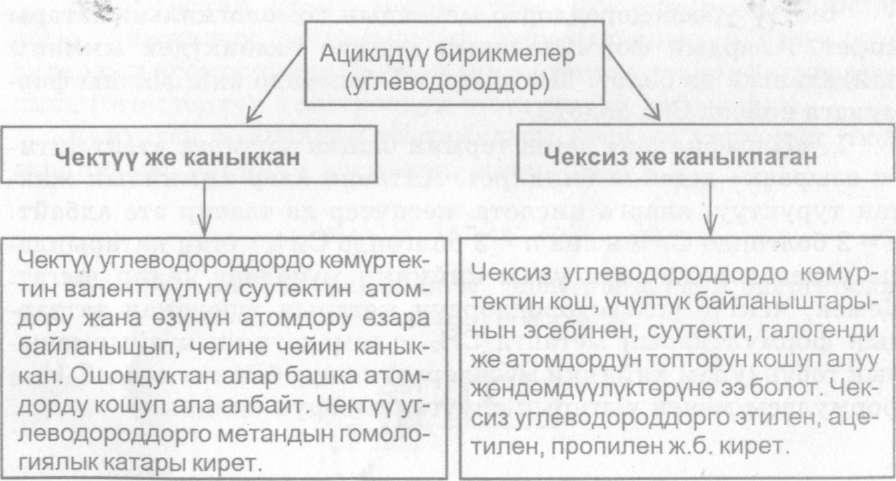
Углеводороддор кеп турдуу болгондуктан (ациклдуу) аларды 2 топко белуштурууге туура келди жана ез атомдору езара бай- ланышып чегине чейин каныккан. Ошондуктан алар башка атомдорду кошуп ала албайт.
Чектуу углеводороддорго метандын гомологиялык катары чексиз углеводороддордо кемуртектин кош учутук байланыш- тарынын эсебинен суутекти, галогендуу же атомдордун топто- рун кошуп алуу жендемдуулуктеруне ээ болот. Чексиз углеводороддорго этилен, ацетилен, пропилен ж. б. кирет.
§ 2.1. Чектуу углеводороддор жонунде тушунук (алкандар)
Чектуу углеводороддордун молекулаларында кемуртек атомдору езара женекей байланыштар аркылуу байланыщкан. Эл- аралык систематикалык номенклатура боюнча чектуу углеводороддорду алкандар деп аташкан. Алкандарды ошондой эле каныккан углеводороддор же парафиндер деп дагы аташат. Чектуу углеводороддордун же алкандардын женекей екулу СН4 - метан жана анын гомологиялык катарлары. Алар менен сил ер таанышасьщар. Чектуу углеводороддордун аталышына «ан» мучесун кошуу менен аташат. Алкандардын курамы СпН2п+2 формуласы менен туюнтулат.
^^ Курамы СпН2п+2 формуласына туура келген комуртектин
атомдорундагы sp3 гибриддешуу абалында болуп башка атомдорду жана атомдордун топторун кошуп ала албаган углеводороддор чектуу деп аталат.
Чектуу углеводороддорго метандын гомологиялык катары кирет. Алардын формулаларын тузууде теменкудей ыкманы пайдалансак да болот. Мисалы п =1 болгондо аны жалпы формулага койсок ChU болот.
1. «Парафиндер» деген термин башка заттарга «тектештиги азыраак» дегенди билдирет. Анткени алар химиялык жак- тан туруктуу, аларга кислота жегичтер да таасир эте албайт. п = 2 болгондо СгНв жана п = 3 болгондо СзНв метан катарында- гы углеводороддордун улам кийинки мучелеру келип чыгат. Демек, чектуу углеводороддордун катарын туюнткан заттар- дын формулаларын метанга СНг - гомологиялык айырмачы- лык тобун (улам кийинки мучелерун) кошуу боюнча жана ОпНгп+г формуласы менен чыгарып алууга болоорун билдик.
2.2. Метан жана анын молекуласынын тузулушу
Чектуу углеводороддордун же алкандардын женекей өкулу метан. Анын молекуласынын курамы бир атом кемуртектен жана терт атом суутектен турат. Метандын - СН4 молекула- сындагы химиялык байланыш коваленттик болот. Метандын молекуласынын курамындагы кемуртектин атомунун терс электрленуучулугу ( 2.5) суутектикине (2.1) Караганда жого- ру болгондуктан, кемуртектин жупсуз электрондору суутек- тин жупсуз электрондору менен жупташуудан пайда болгон электрондук жуптар кемуртекти кездей жылышкан болот. Элек- трондорду чекиттер менен белгилеп теменкудей формуланы ала- быз:
Н
:
н :с: н
:
Н метандын электрондук формуласы
валенттик жуп электрондорду сызыкча менен белгилесек: (-) электрон структуралык формула жазылары менен тааныша- сьщар. СН 4
Н
I
Н-С-Н
I
Н метандын структуралык формула
Кемуртектин атому менен суутектин атомунун ортосун- дагы химиялык байланыштын жаратылышын тушунуу учун булардын атомдорунун ар биринин электрондук конфигурация- сына (атомдордун электрондук тузулушуне) кайрылалы.
Кемуртек мезгилдик системадагы негизги топчонун (под- группанын) биринчи элементи, катар саны 6.
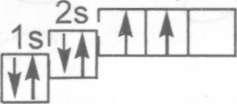
6С© 1s22s22p2
Жогорку конфигурациядагы электрондордун энергетика- лык денгээлчелерде жайланышын жазалы:
37
Мында электрондор | жебе менен белгиленген, энергети- калык денгээл канча болсо анын ошончо энергетикалык ден- гээлчеси болот. Децгээлченин саны энергетикалык денгээлдин санына туура келет. Кемуртектин денгээлинде s жана р - дец- гээлчелери (2 децгээлчелери) бар. Анда электрондордун жай- ланышы электрондук конфигурацияда керунуп турат. Аны теменкудей керсетсек дагы болот.
Электрон ар турдуу денгээлде ар кандай энергияга ээ болот. 1 s электрондук денгээлчелердеги энергияга Караганда 2s - дец- гээлчедеги электрондун энергиясы жогору болот.
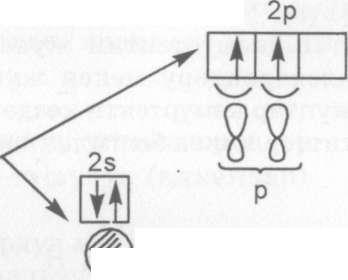
Кемуртектин атомунун электрондук тузулуш конфигурация- сынан көрунуп тургандай р - энергетикалык денгээлчеде бош орун болгондуктан сырттан энергия таасир этсек 2s2 - элек- тронунун бирее 2р - энергетикалык ячейка (бош) етуусу мумкун. Сырттан таасир этилген энергияны керсетуш учун кемуртек атомунун химиялык белгисинин жогорку он жагына (*) жылдызча коюп белгилесек болот. Ал теменкудей жазылат:
Бул учур кемуртек атомунун дуулуккен же козголгон учу- ру. Мындай абалда 2s1 2р3 болуп калды. Электрондук булуттар- дын формасы шар (2) жана гантел (3) формасына ээ болушту. Ошол пайда болгон электрондук булуттардын ортосунда аргын-
дашуу же гибриддешуу журет - SP3ггайда кылат. Пайда болгон 4 алмуруттун формасына окшогон электрондук булуттардын формасы s жана р электрондук булуттардан езгечеленуп капталышты.
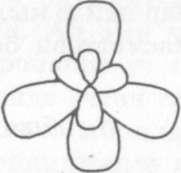
Пайда болгон 4 гибриддик (sp3) электрондук булуттар мейкиндикте жайланышканда, алардын баары тетраэдрдин чоку- ларына багытталып созулуп, симметриялуу эмес келемдегу электрондук булуттар турунде жайланышат.
Алар суутектин шар формасындагы (4s) электрондору менен кайрадан гибриддешкенде пайда болгон электрондук булуттардын елчемдеру бирдей болуп, мейкиндикте пайда болгон химиялык байланыштын октору арасындагы бурчтар 109° 28' га барабар болуп, молекуланын мейкиндиктеги формасы тетраэдр турунде болуп калат.
Демек метандын молекуласынын пайда болушунда терт сигма байланышы пайда болуп, алардын арасындагы бурчту 109° 28' тузгендуктен мейкиндиктеги метандын молекуласынын формасы тетраэдрдей болот-
Метандын молекуласынын пайда болушундагы жупташкан электрондор эки атом дун ядролорун тен камтыйт, жалпы электрондук булуттар атомдордун бардыгына тиешелуу болот.
Метандын молекуласынын тетраэдр формасында болгону масштабдык жана шар-езек моделдери менен да туюнтулат.
1-сурот.
2-сурет.
109° 28' метандын молекуласы.
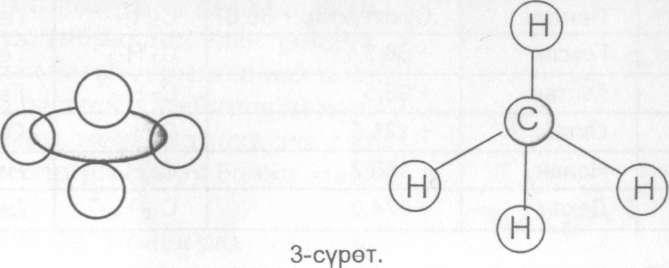
Метандын молекуласынын мейкиндиктик (масштабдык) жана шар-езек моделдери.
2. Чектуу углеводороддордун курамы, химиялык жана мейкиндиктик тузулушу.
Гомологиялык катары.
Жаратылыш газында жана нефтинин курамында ез касиеттери боюнча метанга окшогон углеводороддор кездешет.
Силер метанга касиеттери боюнча окшош газдар, анын го- мологдору, аталыштары жана радикал тушунуктеру менен таа- нышасьщар.
Теменку таблицада метандын гомологдору, алар пайда кыл- ган радикалдар жана гомологдордун айрым касиеттери бе- рилет.
1-таблица
| Формула- лары | Аталыштары | Агрегаттык абалдары жана кайноо темпе- ратуралары (н.ш.) | Радикал- дардын формула- лары | Радикалдын аталыштары |
| СН4 | Метан | газдар -161,6 | СНз" | Метил |
| С2Н6 | Этан | -88,6 | С2Н5- | Этил |
| СзН8 | Пропан | -42,1 | С3Н7 | Пропил |
| С4Н10 | Бутан | -0,5 | С4 Н9 | Бутил |
| С5Н12 | Пентан | Суюктуктар + 36,07 | С5Н11 | Пентил |
| СбН14 | Гексан | + 68,7 | Сз Н13 | Гексил |
| С7Н16 | Гептан | + 98,5 | С7 Н15 | Гептил |
| С8 Hl8 | Октан | + 125,6 | c8H17 | Октил |
| С9 Н20 | Нонан | + 150,7 | Сд Н-19 | Нонил |
| С10 Н22 | Декан | + 174,0 | С10 Н21 | Децил |
Чектуу углеводороддордун курамы кемуртек жана суутек элементтеринин атомдорунан турат.
Углеводороддордун курамына кирген элементтердин атомдорунун сандык езгерушу, алардын касиеттериндеги айрым взгвруулерге алып келгенин 1-таблицадан байкадьщар. Чектуу углеводороддордун кецири таралган екулу метандын молекула- лык тузулушу андагы sp3 - гибрнддешуусу, молекуланын мейкиндиктеги формасы менен дагы таанышасьщар. Эми биз жалпы эле чектуу углеводороддордун байланыштарынын электрондук табиятын жана алардын молекулаларынын мейкиндиктик тузулушун карайлы. Негизинен чектуу углеводороддордун тузулушу метандын молекуласынын тузулушуне окшош.
Этандын (С 2Н 6) молекуласынын тузулушунде химиялык байланыш эки кемуртек атомунун электрондорунун капталышы- нан эки гибриддик электрондук булуттар пайда болот.
Пайда болгон эки гибриддик электрон кайрадан езара гибриддеши кемуртек атомунун ортосунда бир о - байланышын пайда кылат, эми байланышкан эки sp3 - электрондук булут суутектин 6s - электрондору менен капталышып, о - байланыштарын пайда кылды. Мында деле гибриддешкен кемуртектин электрондук булуттары тетраэдрдин чокусуна багытталган. Ал эми чектуу углеводороддордун кийинки екулу С3Н8 - пропанда уч кемуртек атому зр3-гибриддешуусунун натыйжа- сында учтен гибриддик электрондук булуттарды пайда кылат. Ошол гибриддик электрондор кайрадан езара гибриддешип, мейкиндикте жайланышканда экинчи жана учунчу кемуртектин атомдорунун гибриддик электрондорунун багыты, бирин- чи жана экинчи кемуртек атомдорунун ортосундагы электрондук булуттардын багыты менен дал келбей калат. Мында электрондук булуттардын капталышынан пайда болгон бурчтар 109°28'ту тузет. Углеводороддордун кийинки катарларындагы тертунчу жана бешинчи кемуртек атомдорун- да ж. б. ушундай болот.
Ошентип кемуртек атомдорунун ортосундагы гибриддик электрондук булуттардын багыттарынын дал келбей калгандыгынын эсебинен кемуртек чынжыры мейкиндикте туз сы- зыктуу эмес ийри-буйру болуп жайланышат.
Пропандын молекуласындагы химиялык байланыштардын багыты 4-сурет.
кемуртектин уч атомунун 3sp3-rn6- Этандын молекуласы.
6-сурот. Пропандын молекуласынын мейкиндикте жайланышы.
риддешкен s - электрондук булуттары менен байланышып
Ал эми чектуу углеводороддордун структуралык формуласын жазууда кемуртек атомдорунун ийри-буйру жайланышы эске алынбай сызыктуу жазууга макулдашкан. Мисалы, пропандын кыскартылган структуралык формуласы Н3С - СН2- СН3 болуп жазылат. Демек бардык чектуу углеводороддордун структуралык формуласын жогорку принциптин негизинде жазы- шат. Ал эми байланышта кемуртек атомдорунун ийри-буйру жазуусу теменкудей керсетулмек.
Бул кемуртек чынжырынын ийри-буйру керсетулген шар- езек модели. Масштабдык модели теменкудей болот.
Гомологиялык катардын алгачкы тертеенун аталыштары тарыхый берилген аттар. Пентандан баштап гомологдордун аттары грек сандарынын аттарынан тузулген.
3.Чектуу углеводороддордун номенклатурасы жана изомерлери
Бардык каныккан углеводороддордун аталыштары «ан» мучесу менен аяктайт. Чектуу углеводороддордун агрегаттык абалдары, газдар, суюктуктар жана катуу заттар сууда эри- бейт, алар айрым органикалык эриткичтерде эришет. Чектуу углеводороддордун курамын керсеткен жалпы формула силер- ге тааныш.
Чектуу углеводороддордун курамынан бир суутектин атомун кемиткенде алардын радикалдары келип чыгат. Анда чектуу углеводороддорго мунездуу «ан» мучесу «ил» мучесу менен алмашат. Радикалдардын аталыштары таблицада берилген, анын аныктамасын билесинер. Углеводороддор абдан кеп, аларды ажыратып билуу учун Системалык эларалык номенклатура боюнча (ЮПАК) атайбыз. Углеводороддордун курамындагы суутектин атомдору ар кандай радикалдар менен орун алмашкан сайын улам жаны заттар пайда болот.
1. Аларды атоо учун бирикмедеги кемуртектин узун чынжырын табуу андан кийин бутактануу кайсы жагына жакын жайланышкан жактан баштап, узун чынжырдагы кемуртек атомунун символунун устуне сандарды коюп белгилеп чыгуу:
Н3С - СН2 - СН2— СН2 — СН2 - СН3
бул бирикмеде кемуртектин бутактанышы так ортосунда болгондуктан кемуртек атомдорун белгилее солдон оцду кездей же тескерисинче ондон солду кездей белгилей берсе болот.
1 2 3 4 5
Н 3С- СН 2 – СН – СH 2 - СН 3
1
СН3
2. Затты атоо учун радикал жайланышкан кемуртек атомунун санын керсетуп жазып, радикалдарды атайт.
3. Узун чынжырдагы кемуртектин атомунун санына карап углеводороддун толук аты айтылат.
1 2 3 4 5
Н3С—СН2-СН-СН2—СН3
1
С2Н5 3-метил пентан
1 2 3 4 5 6 1 2 3 4 5
Н 3 С-СН-СН 2- СН-СН 2-СН 3 СН 3— СН 2- СН – СН 2—СН3
1 1 1
СНз С 2 Н 5 СНз
2-метил 4-этил гексан 3-метил пентан
Жогорку бирикмеде узун чынжырда эки башка радикал жайланышкандыктан белгилее жана атоо женекей радикалдан башталды.
СН3
1 2 3 4 1 2 3 4 1 5
в) Н3С-СН-СН-СН3 г) H3C-CH2-CH2-C—СН3
1 1 1
СН3 СН3 СН3
2,3 диметил бутан 2,2 диметил пентан
Берилген (2) бирикмесин атоодо 2-кемуртектин атомунда эки радикал жайланышкандыктан 2 деген санды 2,2 деп жаза- быз. Эгерде бирдей радикалдар бирикмеде кездешсе, радикал жайланышкан кемуртекти керсеткен сандарды грек сандары менен атасак да болот (эки - ди, уч - уч, терт - тетра ж. б.).
4. Чектуу углеводороддордун химиялык касиеттери
Чектуу углеводороддордун молекуласындагы бардык атом- дор бири-бири менен ете бекем о - байланыштары менен бай- ланышкан. Кемуртектин езунун атомдору менен байланышкан- дан калган валенттуулуктеру суутектин атомдору менен чегине чейин каныккан. Ошондуктан чектуу углеводороддорду каныккан углеводороддор деп дагы атан журушет. Нормалдуу шартта алардын химиялык активдуулугу темен. Аларга концентрация- ланган жегичтердин, кислоталардын (нормалдуу шартта) эритмелери жана кучтуу кычкылдандыргычтар дагы таасир этишпейт. Алкандар кошулуу реакциясына катышпайт. Өз кезегинде аларды парафиндер деп аташкан (ал активдуулугу темен дегенди билдирет).
Алкандардын химиялык активдуулугунун темендугунун себеби С — С кемуртек менен кемуртектин, С - Н кемуртек менен суутектин ортосундагы байланыштар уюлсуз. Бул байланыштардын энергиясы жогору. Ошондуктан мындай энергиясы жогору болгон байланыштарды узууге кеп энергия талап кы- лынат.
Алкандарга мунездуу касиеттердин бири орун алмашуу реак- циясы. Бул реакция алкандардын молекуласынын курамын- дагы суутектин атомдору белгилуу шартта башка атомдор же атомдордун топтору менен алмашуусу боюнча маалыматыбыз бар. Мисалы, жарыктын таасири менен же ысытканда алар галогендер менен орун алмашуу реакциясына катышат.
Алкандардын хлор менен аракеттенишин карайлы.
Н Н
I I
н — С — Н + С12 ► Н —С — CI + HCI
I I
Н Н хлор метан
Андан ары пайда болгон хлор метан хлордун молекуласы менен аракеттенишет.
Н Н
I 1
н —с —CI + С12 _ ----------------------- Н—С—CI + HCI дихлор метан
1 1
Н CI
Пайда болгон дихлорметан дагы эле хлордун молекуласы менен аракеттенишет.
Н CI
I I
Н— С — CI + С12 ► И — С — CI + HCI трихлорметан
I I
CI CI
Эми пайда болгон хлороформ хлордун молекуласы менен аракеттенишип, тетрахлорметанды пайда кылат
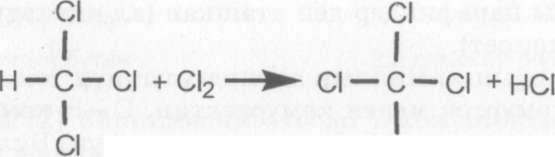
CI тетрахлорметан
Мындай реакциянын натыйжасында галогендуу туундулар- дын хлор метан, дихлорметан, учхлорметан жана тетрахлорме- тандардын аралашмасы пайда болот.
Метандын гомологиялык катарын еткендо бул реакциянын механизми менен таанышкансынар эсинердеби? Квант энергиясын (hv) таасир эткенде хлордун молекуласы анын жупсуз электрону бар атомдорго ажыраган
:
(1)
Пайда болгон хлор-радикалдарынын химиялык активдуулугу жогору болгондуктан, метандын молекулаларына таасир этишет. Натыйжада метандын молекуласынан бир суутектин атомун озуне тартып алат.
Реакциянын натыйжасында хлор метан жана хлор радикалы пайда болду. Мындан ары (II) жана (III) баскычтагыдай реакциялар удаалаш кайталанышып, эркин радикалдык меха- низмдеги чынжырлуу реакциялар журуп, акыркы баскычында терт хлордуу кемуртек пайда болот. Радикалдар езара биригип кеткенге чейин бул реакциялар журе берет.
Радикалдых механизмде белгилуу ырааттуулуктпа удаалаш жургвн реакцияларды чынжырлуу реакция дейбиз.
Жогоркудай реакцияларга чектуу углеводороддордун бар- дыгы белгилуу шартта катыша алат.
Этанды хлордоо реакциясы метанды хлордоо реакциясын- дай эле журет.
t°
Н3С — СН3 + С12 ►НзС - СН2 CI + HCI
хпорэтан
Реакциянын натыйжасында пайда болгон хлорэтан кайра эле хлордун молекуласы менен аракеттенишип 1,1 дихлорэтанды пайда кылат.
Мындай реакцияларды хлордоо реакциясы деп атайбыз. Реакцияга бром катышса, бромдоо реакциясы дейбиз.
Углеводороддордун курамындагы бир же бир нече суутектин атомдору галогендер менен орун алмашуудан пайда болгон заттарды углеводороддордун галогендуу туундулары, ал эми мындай реакцияны галогендештируу реакциясы дейбиз.
Химия илиминдеги улуу ачылыштардын бири чынжырлуу реакциянын ачылышы болду. Чынжырлуу реакциянын теория- сын иштеп чыккандыктары учун орустун академиги Н. Н. Семенов жана англиялык окумуштуу С. Хиншелдвуд жогорку илимий сыйлык - Нобель сыйлыгына татыктуу болушту. Ысы- тууда алкандарга суюлтулган азот кислотасы таасир этет. Бул реакцияда алкандардын курамындагы суутектин бир атому азот кислотасынын калдыгы менен орун алмашат. Мындай реакцияны нитрлее реакциясы деп реакциянын натыйжасында
Орун алмашуу (кайсы жердеги кемуртектин атомунда) суу- тектин атомунун саны аз болгон жеринде журду. Бул орун алмашуу реакциясынын жалпы эрежеси болуп саналат. Аны эси- церге бекем туткула. Алкандар куйуучу заттар, алар куйгенде кеп сандаган энергия белунуп чыгат. Мисалы, метан куйгенде 880 кДжҮмоль энергия белунуп чыгат.
СН 4 + 2О 2—► С02 + 2Н2 О + 880 кДжҮмоль
Алкандар кадимки температурада кычкылдандыргычтар- га туруктуу деп айтканбыз. Эгерде метанды калийдин пер- манганатынын эритмеси аркылуу еткезсек (КМп04 - кычкыл- дандыргыч), анда эритменин мала кызыл ецу езгерген жок. Бул шартта метан кычкылданбаганынын далили.
Алкандар изомерлешууге жендемдуу, тизмектуу алкандар анда бутактанган туруне етет.
изом. AlCl 3 , ,
Н3С - СН2 — СН2 — СН3 ► Н3С — СН — СН3
1
СН3 2-метилпропан
Жогорку изомерлешуу процесси катализатордун (А1С1з) ка- тышуусунда температуранын таасири менен журет.
5.Циклопарафиндер жөнүндө түшүнүк
Биз силер менен жогору жакта ачык чынжырлуу (ациклдүү) углеводороддор менен тааныштык. Андан тышкары, туюк чынжырлуу (циклдуу) углеводороддор да кездешет.
XIX кылымдын 80-жылдарында орус окумуштуусу В. В. Марковников Бакудан чыккан нефтинин курамында циклдуу углеводороддордун беш жана алты мучелуу екулдеру кармалып журерун айткан.
Циклдуу углеводороддордун молекуласындагы кемуртек атомдору, чектуу углеводороддордукундай женекей байланыш- тар менен байланышат. Ушундай байланышкан туюк чынжырлуу (циклдуу) углеводороддорду циклопарафиндер деп аташ- кан. Мындай углеводороддордун кепчулук касиеттери парафин- дерге окшоп кеткен. Тузулушундегу айырмачылыгы кемуртек атомдору ез ара биригип туюк чынжырды (женекей байланыш) пайда кылышып, анын калган валенттуулугу суутектин атомдору менен байланышып толукталган.
а)Циклоалкандардын гомологиялык катары, изомерлери жана номенклатурасы
Циклопарафиндерди Эларалык систематикалык номенклатура (ЮПАК) боюнча циклоалкандар деп аташат. Циклоалкан- дарды ар кандай адабияттарда турдууче аталганын кездешти- ресицер: циклоалкандар, циклопарафиндер, нафтендер ж. б. Теменкудей циклоалкандар белгилуу:
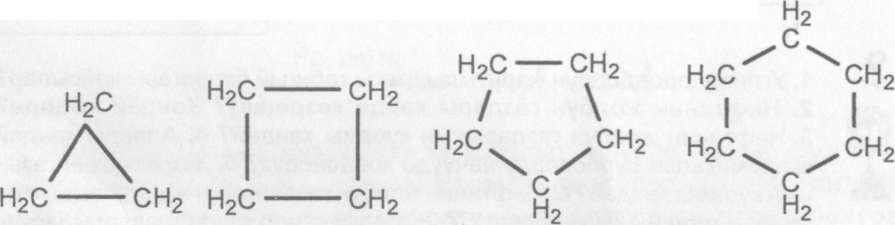
циклопропан циклобутан циклопентан циклогексач
Жогорку бирикмелердин курамдарына изилдее жургузулуп, алардын молекулалары уч, терт, беш жана алты кемуртек атомдору байланышканда пайда болгон заттар экенине ынанасьщар.
Ациклдуу углеводороддордун чектуу екулдеру сыяктуу циклоалкандардагы изомерлерди пайда кылышат. Мисалы, С6 Н12 курамы ушул формулага туура келген циклогексан бир канча изомерлерди пайда кылат. Изомерлери каптал кемуртек чын- жырлары менен байланыштуу болот.
Н 3С – НС -- СН – СН 3 диметил циклобутан
-
1
Н 2 С – С Н 2
Циклопарафиндердин жалпы формуласы Сп Нгл формуласы- на туура келет. Мындан езуне тиешелуу чектуу углеводороддордун курамынан суутектин эки атому кем экендиги байкалат.
б).Циклопарафиндердин касиеттери.
Нормалдуу шартта циклопропан жана циклобутандар газ абалындагы заттар. Ал эми циклопентан жана циклогексан суюктуктар. Циклопарафиндердин бардыгы иш жузунде сууда эрибейт.
Циклопарафиндер менен чектуу углеводороддорду салыш- тырсак, бардык атомдордун валенттуулуктеру толук каныккан. Ошого карабастан циклопарафиндер кошулуу реакциясына да жендемдуу болот. Эмне учун?
Анткени чынжырдагы кемуртек атомдорунун ортосундагы байланыштар узулушу мумкун. Натыйжада эркин радикалдар пайда болуп, алар суутектин атомун же башка атомдорду ко- шуп алуусу ыктымал. Туюк чынжырда кемуртек атомунун саны канчалык аз болсо, алар тезирээк кошуп алуу реакциясына катышат. Ал эми туюк чынжырда кемуртек атомунун саны ескен сайын кемуртек атомунун ортосундагы байланышты узууге кеп энергия талап кылышат. Ошондуктан циклоалкан- дарды гидрлее реакциясы (суутекти кошуп алуу гидрлее реак-циясы болот) ар кандай температуралык режимде журет. Темен- ку мисалдарды алалы.
Н2 С
Үү 50 – 70 0 С. Pt

Н 2С СН2 + Н2 Н 3С - СН2 - СН 3 пропан
циклопропан
н2с-- сн2 +н2 3500 С. Pt
 1 1 Н 3С - СН2 - СН2 - СН2 - СН 3 пентан
1 1 Н 3С - СН2 - СН2 - СН2 - СН 3 пентан
Н2С ~СН2 2. циклопентан
Демек, жогорку реакциялар белгилуу температурада катализатор дун (Pt) катышуусу менен журуп, чектуу углеводороддорду пайда кылды. Мындай реакцияларды гидрлео реакциясы дейбиз. Молекуладагы кемуртек туюк чынжыры жогору болгон циклоалкандарга алкандар сыяктуу орун алмашуу реакциясы мунездуу. Мисалы, циклогексан менен хлордун аракеттениши. Анын тендемесин жазалы:
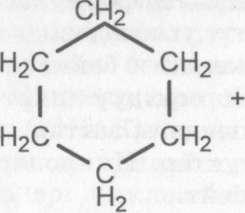 н
н
циклогексан
монохлорциклогексан Мындан тышкары циклоалкандар дегидрлее (суутегинен ажыратуу) реакциясына катышат. Реакцияны схема турунде жазууга болот:
3500 С. Pt
С 6Н 12 ------------------ С 6Н 6 + Н 2
Реакциянын натыйжасында алынган бензол (С 6Н 6) жыпар жыттуу углеводороддун өкүлуү
Циклоалкандар жаратылышта кенири таралган бирикме- лердин курамына кирет. Алар нефтинин курамында кармалып жургендуктен нафтендер деген атка ээ болушкан. Аны биринчи жолу В. В. Марковников белуп алганын билесинер. Эгерде алардын айрымдарын алуу керек болсо, теменкудей реак- цияны колдонобуз.
Циклоалкандардын ичинен циклогексан жана метилциклогександын практикалык мааниси зор. Нефтини ароматташ- тыруу мезгилинде жогорку аталган бирикмелер ароматтык углеводороддор; бензол, толуол жана башка заттарга айланышат. Алынган заттардан синтетикалык боңктор, медикаменттер ендурулет. Ал эми циклопропан медицинада наркоз катары колдонушат.
4.Бышыктоо
1.Углеводороддор (ацикпдуу) бирикмелер кандай класстарга белунот?
2. Чектуу углеводороддорго аныктама берип мисал келтиргиле?
3. Чексиз углеводороддорго кайсылар кирет? Эмне учун чексиз деп аталган?
4. Метандын молекуласын пайда кылууда кемуртек менен суутектин ортосунда кандай байланыш. бар? sp3- гибриддешуусун кандай тушунесуцер?
5. Эмне себептен метандын молекуласы тетраэдр формасына ээ?
6. Чектуу углеводороддордун курамдары кандай жана алардын курамын керсеткен жалпы формуласын корсеткуле?
7. Гомологиялык катар деген эмне?
8. Радикалдар кантип пайда болот?
9. Чектуу углеводороддордун аталышында кайсы номенклатуралык аталыш колдонулат? 10. 5 метил 3 этил нонандын, 3 метил 5 этилгептандын формуласын тузгуле?
12. Этандын молекуласынын электрондук формуласын жазгыла?
13. Циклоалкандардын касиеттери.
14. 3 г этан, 5 г декан куйгенде канча грамм кемуртектин (IV) оксиди жана суу пайда болот? Маселени чыгаргыла.
15. 2,3 гуглеводородду куйгузгенде 4,43 г кемуртектин (IV)- оксиди жана 2,7 г суу пайда болду. Суутек боюнча заттын тыгыздыгы 23ке барабар. Ушул заттын курамын туюнткан жонекой формуланы тузгуле?
роддорду парафиндер дейт?
16. Чектуу углеводородцорго кайсы реакция мунездуу?
5. Үйгө тапшырма. Бет . 34-45. 9-14 маселелер.
6.Баалоо.


















 1 1 Н 3С - СН2 - СН2 - СН2 - СН 3 пентан
1 1 Н 3С - СН2 - СН2 - СН2 - СН 3 пентан н
н


















