Просмотр содержимого документа
«Основные классы неорганических веществ»

Основные классы неорганических веществ
Подготовила ученица 8 класса
СОШ с. Ир
Каллагова Милана.
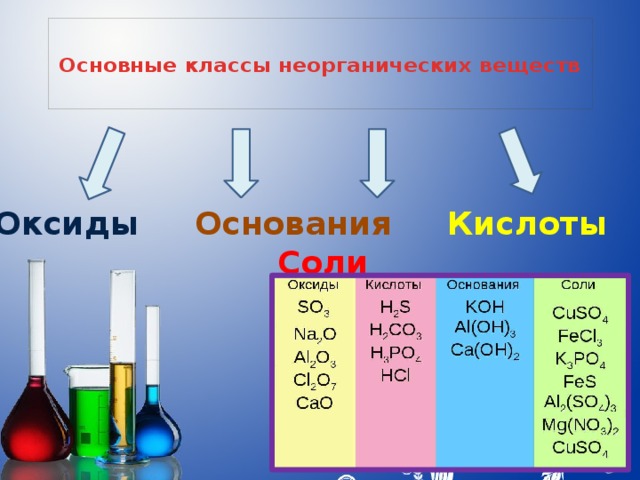
Основные классы неорганических веществ
Оксиды Основания Кислоты Соли

Оксиды
Оксиды - это сложные вещества, состоящие из двух элементов, один из которых - кислород в степени окисления -2.
Оксиды – широко распространенный в природе класс неорганических соединений.
Э +n О -2
n - валентность элемента.
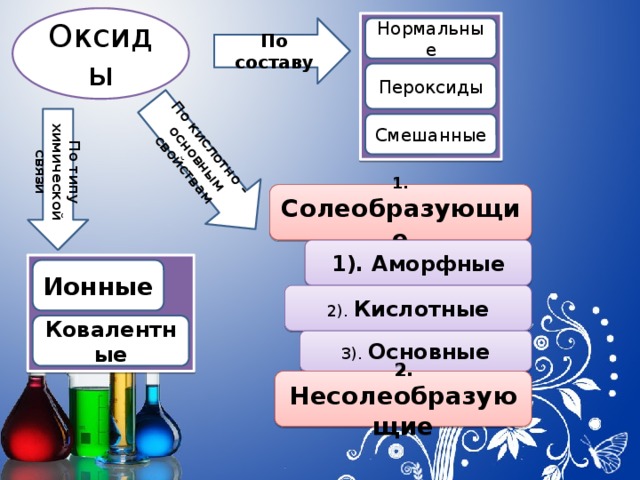
По типу химической связи
По кислотно – основным свойствам
Оксиды
По составу
Нормальные
Пероксиды
Смешанные
1. Солеобразующие
1). Аморфные
Ионные
2). Кислотные
Ковалентные
3). Основные
2. Несолеобразующие

Оксиды принято группировать в зависимости от их способности реагировать с кислотами и основаниям. Различают три важнейшие группы оксидов: основные, кислотные и амфотерные. Их относят к солеобразующим оксидам. Существуют также оксиды, которые называют несолеобразующими. Основные оксиды Основными называют оксиды, которые реагируют с кислотами, образуя соль и воду. Основные оксиды образуются химическими элементами — металлами. Как правило, степень окисления элемента, образующего основной оксид, является невысокой: +1 или +2. Примеры основных оксидов: оксид натрия Na2O, оксид меди(II) CuO. Кислотные оксиды Кислотными называют оксиды, которые реагируют с основаниями, образуя соль и воду. Кислотные оксиды образуют элементы — неметаллы. Например, оксид серы(VI) SO3, оксид азота(IV) NO2. Также кислотные оксиды могут быть образованы металлическими химическими элементами, в которых те проявляют степень окисления от +5 до +8. Например, оксид хрома(VI) CrO3 и оксид марганца(VII) Mn2O7.

Амфотерные оксиды Амфотерными называют оксиды, которые реагируют как с кислотами, так и с основаниями, образуя соли. Амфотерные свойства проявляет оксид цинка ZnO, оксид алюминия Al2O3, оксид бериллия BeO. Если металлический элемент имеет переменную валентность (проявляет несколько степеней окисления), то из всех образуемых им оксидов, амфотерными свойствами обладают те, в которых этот элемент имеет промежуточную валентность (промежуточную степень окисления). Например, хром может быть двухвалентен, трёхвалентен и шестивалентен. Амфотерными свойствами обладает именно оксид хрома (III) Cr2O3. Несолеобразующие оксиды Несолеобразующими называют оксиды, которые при обычных условиях не взаимодействуют ни с кислотами, ни с основаниями. Таких соединений всего три: оксид углерода(II) или угарный газ CO, оксид азота(I) или веселящий газ N2O и оксид азота(II) NO.

Основания
Основания - это сложные вещества, состоящие из атомов металлов и гидроксильных групп ОН
Me +n (OH) n
n - -валентность металла
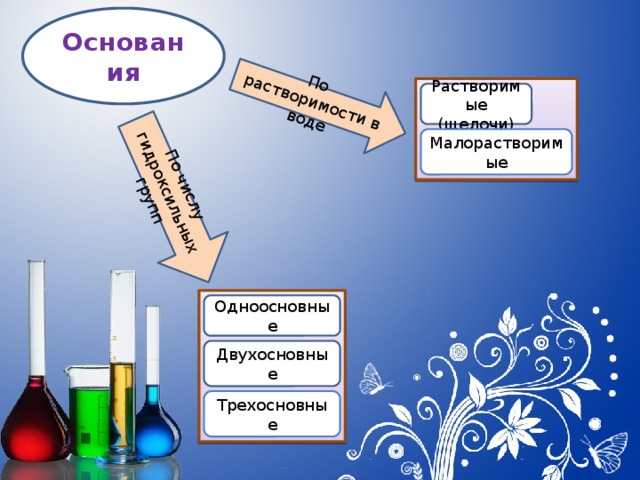
По растворимости в воде
По числу гидроксильных групп
Основания
Растворимые (щелочи)
Малорастворимые
Одноосновные
Двухосновные
Трехосновные

Химические свойства щелочи
Реакции, с помощью которых распознают определенные вещества, называют качественными реакциями
Качественные реакции для щелочи

Кислоты
Кислоты - это сложные вещества, молекулы которых состоят из атомов водорода и кислотного остатка.
H + K ост -n
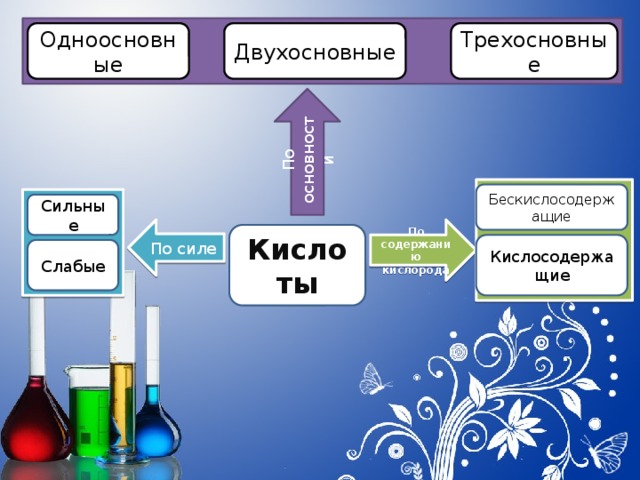
По основности
Одноосновные
Двухосновные
Трехосновные
Бескислосодержащие
Сильные
По содержанию кислорода
По силе
Кислоты
Кислосодержащие
Слабые

Кислосодержащие кислоты
Химическая формула Название кислоты
H2S Сероводородная
H2SO4 Серная
HNO3 Азотная
HNO2 Азотистая
HF Плавиковая
HCl Соляная
H3PO4 Фосфорная
H2CO3 Угольная

Соли
Соли - это сложные вещества, молекулы которых состоят из атомов металла и кислотного остатка
Me +m K ост -n
m- - валентность металла.
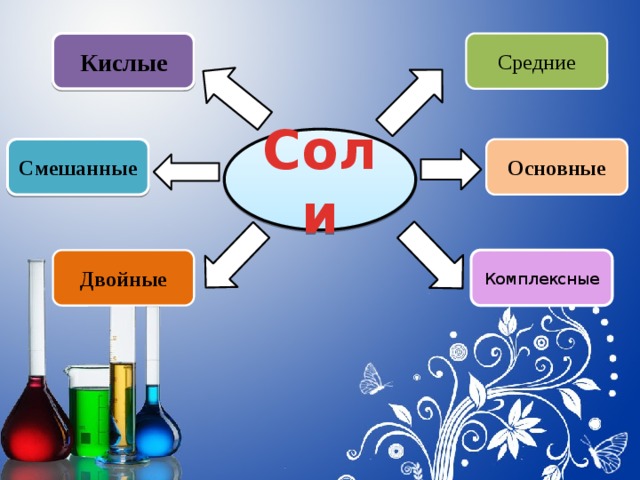
Кислые
Средние
Соли
Смешанные
Основные
Двойные
Комплексные

Номенклатура солей








































