
Тема: §1 7 Галогены
Учитель: Аладинова Р.С.
Предмет: химия
9 класс

Цель урока
- Изучить в сравнении строение атомов и молекул галогенов, их физические и химические свойства;
- Продемонстрировать на примере видеоопытов и реальных превращений химические свойства галогенов;
- Развитие наблюдательности, умения анализировать и сравнивать материальные объекты,
- Развитие умений написания уравнений химических реакций;
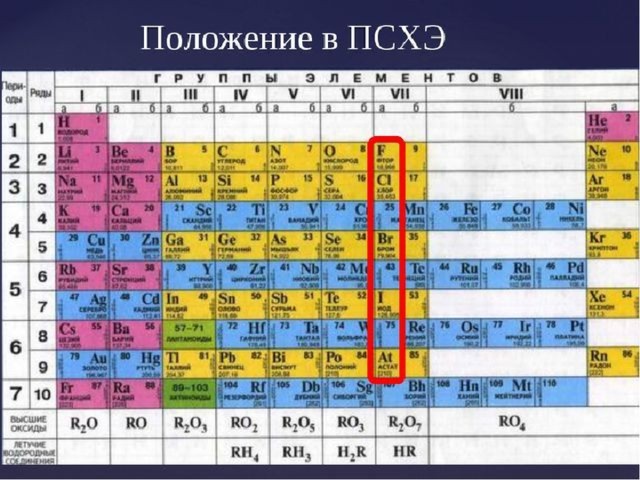

Галогены – рождающие соль
Фтор
F +9 ) )
Хлор
Cl +17 ) ) )
разрушающий
зеленый
Бром
Br +35 ) ) ) )
F 2
Cl 2
Йод
I +53 ) ) ) ) )
зловонный
фиолетовый
Br 2
I 2
Характерная степень окисления:-1
Ковалентная неполярная связь

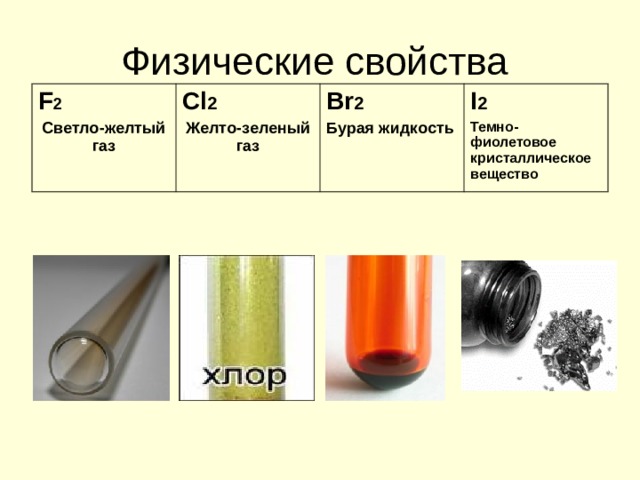
Физические свойства
F 2
Светло-желтый газ
Cl 2
Желто-зеленый газ
Br 2
Бурая жидкость
I 2
Темно-фиолетовое кристаллическое вещество
 Cl 2 Br 2 I 2 Уменьшение активности и ослабление неметаллических свойств. " width="640"
Cl 2 Br 2 I 2 Уменьшение активности и ослабление неметаллических свойств. " width="640"
Изменение химической активности
F 2 Cl 2 Br 2 I 2
Уменьшение активности и ослабление неметаллических свойств.



«Рождение» солей
Закончить уравнения реакций, назвать соли:
F 2 + Na
Cl 2 + Ca
Br 2 + Zn

Образование галогеноводородов
Закончить уравнения:
H 2 + I 2
H 2 + Br 2
Галогеноводороды –бесцветные газы, с резким запахом, при растворении которых в воде получаются кислоты.

Вытеснение галогенов из растворов солей
Более активные галогены вытесняют менее активные из растворов их солей (кроме фтора)
Закончите уравнения возможных реакций:
Cl 2 + KI
I 2 + NaCl
Br 2 + CaI 2
Исключение: F 2 + H 2 O HF + O 2 (расставить коэффициенты)

Вопросы
- Какие элементы называются галогенами и почему?
- Какая степень окисления наиболее характерна для галогенов?
- Каким видом связи образованы молекулы галогенов?
- Какой из галогенов наиболее активный? Почему?
- Может ли хлор вытеснить фтор из раствора фторида калия? Почему?

Домашнее задание
- Учебник Химия-9 авт. Габриелян О.С.
§ 1 7 , выучить.
Упр. 1-4 стр. 82
Заполнит таблицу














 Cl 2 Br 2 I 2 Уменьшение активности и ослабление неметаллических свойств. " width="640"
Cl 2 Br 2 I 2 Уменьшение активности и ослабление неметаллических свойств. " width="640"




























