умеют видеть проблемы в своей деятельности посредством рефлексии своей деятельности в конце урока.
по способу организации – синтетический.
дополнительные – объяснение, беседа, самостоятельная работа.
| № п/п | Этап урока | Содержание | Деятельность учителя | Деятельность учащихся | Планируемые результаты |
| Предметные | Универсальные учебные действия |
| 1. | Организационный. (1 мин) | Приветствие учащихся | Приветствует учащихся, проверяет готовность к уроку | Приветствуют учителя, готовятся к уроку |
| коммуникативные: умеют совместно договариваться о правилах поведения и общения, следовать им, оформлять свои мысли в устной форме. |
| 2. | Актуализация знаний. (10 мин)
| 1) Вокруг нас происходит множество химических
реакций. Например: горение угля. Записываем уравнение химической реакции на доске и в тетрадях:
С + О2 = СО2 2) Проведём эксперимент:
у вас на столах оборудование и, для преведения эксперимента необходимо взять пробирку прилить 2 мл сульфата меди, затем добавить столько же гидроксида натрия. Что вы наблюдаете? Запишите уравнения реакций. Во время проведения опыта не забывайте о технике безопасности. 3) Давайте сравним 2 реакции, которые записаны на доске, для этого вспомните, что такое степень окисления, как определить степень окисления в сложных веществах? | Записывают уравнение химической реакции на доске
С + О2 = СО2 Наблюдение за тем, как дети проводят эксперимент, запись уравнения на доске под диктовку детей. 3)Задание: необходимо проставить степени окисления всех элементов в 2 записанных реакциях
| 1) Записывают уравнение химической реакции в тетрадях:
С + О2 = СО2 2) Проводят опыт и записывают уравнение CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4
3) Расставляют степени оисления элементов | 1)Умеют писать уравнение химической реакции 2) умеют правильно проводить эксперимент 3) умеют расставлять степени окисления элементв | коммуникативные: оформляют свои мысли в письменной форме. познавательные: умеют ориентироваться в своей системе знаний. |
| 3. | 3. Изучение нового материала. (10 минут) | 1.Таким образом, видим, что степень окисления у элементов изменяется в уравнении (1). Такие реакции называются окислительно-восстановительными (реакции, в ходе которых у химических элементов изменяется степень окисления).
Мы познакомились с ещё одним типом классификации химических реакций – по изменению степени окисления элементов. 2.Рассмотрим 1 реакцию подробнее. В ходе ОВР происходят два процесса:
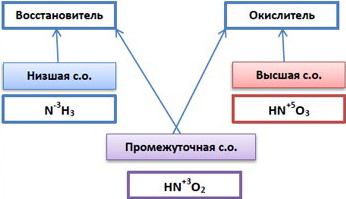
Восстановление – это процесс присоединения электронов атомами, молекулами, ионами. Что происходит со значением степени окисления? (уменьшается). Такая частица называется «окислитель» Окисление – это процесс отдачи электронов атомами, молекулами, ионами. Что происходит со значением степени окисления? (увеличивается). Такая частица называется «восстановитель» Для более легкого запоминания сделайте для себя пометку, там где "+" в схеме-там окислитель. Таким образом, видим, что все ОВР находятся во власти электронных переходов от одного атома к другому атому. Для определения окислительно-восстановительных свойств элемента можно использовать схему.(приложение 1) 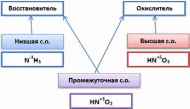

| 1.Диктует определение ОВР. 2. Диктует определение восстановителя и окислителя. Записываем на доске схемы O20 + 2e– →2O–2 Окислитель, процесс восстановления, степень окисления уменьшается.
C0 - 4e– → C+4 Восстановитель, процесс окисления, степень окисления увеличивается.
| 1.Записывают определение ОВР. 2. Записывают определение восстановителя и окислителя Составляем в тетради:
O20 + 2e– → 2O–2
C0 - 4e– → C+4
Указываем окислитель и восстановитель | Узнали что такое окислитель и восстановитель, узнали чт такое ОВР | коммуникативные: умеют слушать и понимать речь учителя, оформлять свои мысли в письменной и устной форме. познавательные: умеют ориентироваться в своей системе знаний. регулятивные: умеют высказывать свое предположение. |
| 4. | Первичное закрепление (5 мин)
| Задание: определите, какие процессы относятся к процессам окисления, а какие к процессам восстановления (карточка н столах):
S → (SO4)2– →
S → (S)2– →
Sn → (Sn)4+ →
2H+ → H2 →
V2+ → (VO3)– →
(IO3)– → I2 →
Работать будем у доски и в тетрадях. На каждое уравнение по очереди приглашаются по 1 ученику. Вам нужно проставить степени окисления и определить где уменьшается степень окисления, а где увеличивается и сделать вывод окислитель это или восстановитель.
| Организует работу учащихся у доски и в тетрадях
| Решают задния карточки в тетрадях и у доски | Научились определять окислитель и восстановитель в уравнениях реакции. | коммуникативные: умеют слушать и понимать речь других, оформлять мысли в устной и письменной форме; познавательные: умеют наблюдать, слушать; сравнивать, анализировать, делать выводы; регулятивные: умеют высказывать свое предположение, осуществлять взаимоконтроль |
| 5. |
Проблемный вопрос. (6 мин)
|
Во многих ОВР очень трудно расставить коэффициенты. Для этого используют метод электронного баланса, который основан на сравнении степеней окисления в исходных и конечных веществах. У вас на столах лежит план расстановки коэффициентов методом электронного баланса (приложение 2) Используя этот план, мы вместе расставим коэффициенты в уравнении, NH3+CuO→N2+Cu+H2O
Физкультминутка. (игра «истинно-ложно») Если высказывание верно, то вы хлопаете в ладоши. Окислитель –там где «+». Окислитель участвует в процессе восстановления 8 класс самый дружный Степень окисления фтора в сложных веществах всегда -1 Химия изучает природу
| Организует реализацию расстановки коэффициентов соответствии с планом. Фиксирование нового знания в речи и знаках.
| Отвечают на вопросы учителя. Записывают в тетрадь. Фиксируют новые знания в речи и знаках.
Хлопают в ладоши, отвечая на вопрос.
. | Знают как записываются и читаются уравнения. Умеют расставлять степени окисления, определять окислитель и восстановитель. Умеют расставлять коэффициенты. | коммуникативные: умеют слушать и понимать речь других, оформлять мысли в устной и письменной форме; познавательные: умеют наблюдать, слушать; сравнивать, анализировать, делать выводы; регулятивные: умеют высказывать свое предположение, осуществлять взаимоконтроль |
| 6. | Первичное закрепление. (5 мин)
| Выполнение задания с комментированием у доски. 1. Из приведенных схем укажите реакции, которые можно отнести к ОВР: 1) CaCO3 → CaО + CO2 2) CuS + O2 → CuO + SO2 2. Расставьте коэффициенты в уравнении 2
химических реакций методом электронного баланса | Организует работу по выполнению заданий. | Выполняют задания с комментированием у доски. Самостоятельно выполняют задание в тетради, осуществляют самоконтроль |
| коммуникативные: умеют слушать и понимать речь других, оформлять мысли в устной и письменной форме. познавательные: умеют ориентироваться в своей системе знаний регулятивные: умеют осуществлять самоконтроль |
| 7. | Рефлексия учебной деятельности. (3 мин)
| Учащимся предлагается заполнить лист достижений и лист оценивания.
Лист самооценки (учащимся нужно высказаться двумя предложениями, выбирая начало фразы из рефлексивного списка и записать в тетрадь:
- сегодня я узнал…
- было интересно…
- было трудно…
- я выполнял задания…
- я понял, что…
- теперь я могу…
- я почувствовал, что…
- я приобрел…
- я научился…
- у меня получилось …
- я смог…
- я попробую…
- меня удивило…
- мне захотелось…
Домашнее задание: § 44; № 7 |
Организует рефлексию, самооценку учебной деятельности
Комментирует домашнее задание | Пишут предложения, осуществляют самоконтроль.
Записывают домашнее задание. | Знают основные понятия темы: ОВР, окислитель, восстановитель. Познакомились с методом электронного баланса | регулятивные: умеют осуществлять самоконтроль, оценивать правильность выполнения учебной задачи личностные: умеют осуществлять самооценку на основе критерия успешности учебной деятельности.
. |
| № | Действия | Пример |
| 1. | Определите и сравните степени окисления элементов до и после реакции. | -3+1 +2-2 0 0 +1-2 NH3+CuO→N2+Cu+H2O |
| 2. | Выписать элементы степени, окисления которых изменяются. (простые вещества выписываются с индексами). | -3+1 +2-2 0 0 +1-2 NH3+CuO→N2+Cu+H2O N-3 →N20 Cu+2 →Cu0 |
| 3. | Определить отдал или принял элемент электроны и их количество Для этого из значения первой степени окисления вычитаем второе значение. (-3-0=-3, 2-0=2) Количество электронов с участием простых веществ умножается на индекс, а перед ионом выставляется коэффициент, равный индексу. | -3+1 +2-2 0 0 +1-2 NH3+CuO→N2+Cu+H2O
2N-3 - 6℮ →N20 Cu+2 +2℮ →Cu0 |
| 4. | Определите окислитель и восстановитель и процессы (окислитель всегда принимает электроны – степень окисления понижается, восстановитель их отдает – степень окисления повышается). | -3+1 +2-2 0 0 +1-2 NH3+CuO→N2+Cu+H2O 2N-3 - 6℮ →N20Восстановитель, окис-тся Cu+2 +2℮ →Cu0 Окислитель, восст-тся |
| 5. | Выписать то количество электронов, которое определили (крест на крест). Полученные цифры и есть коэффициенты. Если их можно сократить, то сокращаем | -3+1 +2-2 0 0 +1-2 NH3+CuO→N2+Cu+H2O 2N-3 - 6℮ →N20 2 1 восстановитель Cu+2 +2℮ →Cu0 6 3 окислитель |
| 6. | Расставьте коэффициенты. Сначала ставим коэффициенты, полученные у всстановителя и окслителя (с той стороны, где степень ниже, за исключением 0), затем у металлов,далее неметаллы, водород и кислород. Число отданных электронов= Число принятых электронов | -3+1 +2-2 0 0 +1-2 NH3+CuO→N2+3Cu+H2O
2N-3 - 6℮ →N20 2 1 востановитель, ок-ся Cu+2 +2℮ →Cu0 6 3 окислитель, вос-ся |
| 7. | Уравнять правую и левую части уравнения (проверить по кислороду, количество атомов кислорода справа и слева должно быть одинаковым). | -3+1 +2-2 0 0 +1-2 2NH3+3CuO→N2+3Cu+H2O 2N-3 - 6℮ →N20 2 1 востановитель, ок-ся Cu+2 +2℮ →Cu0 6 3 окислитель, вос-ся |