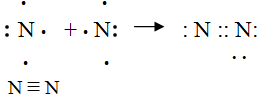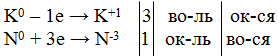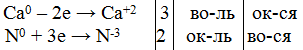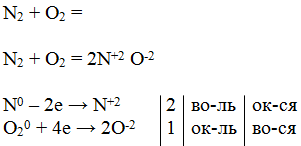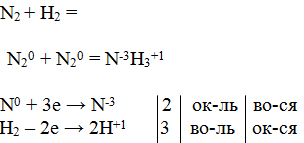Открытый урок по теме «Азот. Химические свойства и способы получения»»
Цель урока: сформировать понятие об азоте, как о химическом элементе и простом веществе, изучить способы получения и химические свойства элемента.
Задачи:
Образовательная: Расширить представление учащихся о неметаллах. Изучить взаимосвязь состава, строения, свойств и применения азота и некоторых его соединений.
Развивающая: Развивать логическое мышление, познавательный интерес.
Воспитывающая: Закрепить на новом материале мировоззренческие знания о причинно-следственной связи состава, строения, свойств вещества; совершенствовать умение обучаться при работе в парах.
Форма работы: индивидуальная, работа в парах, фронтальная.
Время проведения: 45 минут.
Оборудование: Интерактивная доска, ПСХЭ Д.И. Менделеева, презентация «Азот. Химические свойства и способы получения»
Приборы и оборудование для демонстрационного опыта: дихромат аммония, этиловый спирт, асбестовая сетка, спички, подставка для демонстрационных опытов.
Ход урока
I Этап урока: Работа с пройденным материалом (учащиеся выступают с творческим заданием – сказка про подгруппу азота).
Ориентировочно-мотивационный (5 мин).
1. Учитель задаёт вопрос: “О каком химическом элементе идет речь?” и загадывает загадку:
Загадка.
Он нужен всем, когда лишь связан,
А вяжется с большим трудом,
Весь мир живых существ обязан
Ему растительным белком.
Распространен во всех трех средах,
Освобождается в огне,
Он важен красками, лекарством, он нужен миру и войне. (Азот.)
2. Учитель сообщает тему урока и предлагает учащимся сформулировать цель урока, задачи урока выведены на экран интерактивной доски.
2 Этап урока: Изучение нового материала.
1.Краткий рассказ об истории открытия азота на тему: “История одного открытия – Азот” (3 мин).
Вашему вниманию представлены слайды — портреты учёных К. Шееле, Д. Резерфорда, А. Лавуазье, Ж. Шаптала. Имена этих учёных связаны с открытием газа азота. Соединения азота (селитра, азотная кислота, аммиак) были известны задолго до получения азота в свободном состоянии. В 1772 г. Д. Резерфорд, сжигая фосфор и другие вещества в стеклянном колоколе, показал, что остающийся газ не поддерживает дыхания и горения. Учёный назвал его «удушливым воздухом». К. Шееле назвал этот элемент, извлеченный из воздуха,— «дурным воздухом». В 1787 г. А. Лавуазье установил, что «жизненный» и «удушливый» газы, входящие в состав воздуха, это одно и то же простое вещество, и предложил название «азот». «А» — отсутствие, «зоо» — жизнь. «Безжизненный» — азот. И не случайно: испытания проводили на лабораторных мышах, помещая их под колпак с азотом, где животные погибали. В 1790 г. Ж. Шаптал предложил другое латинское название — нитрогениум, означающее «рождающий селитру».
2. Азот – химический элемент: (5-6 мин)
а) Положение в ПСХЭ Д.И. Менделеева–работа по плану характеристики ХЭ.
План характеристики выдается учащимся на каждое рабочее место.
План характеристики ХЭ по положению в ПСХЭ Д.И. Менделеева.
Найдите химический элемент в таблице Д.И. Менделеева и ответьте на вопросы:
| № п/п | Вопрос | Ответ |
| 1. | Каков химический знак? | N |
| 2. | Какой атомный номер и какая относительная атомная масса? | 7, Mr (N) = 14 |
| 3. | Сколько протонов и нейтронов в ядре атома? | Протонов – 7 Нейтронов – 7 |
| 4. | Сколько электронов в атоме? Какова его электронная формула (распределение электронов по атомным орбиталям)? | 7, + 7 N )2 )5 1S2 2S2 2P3 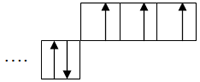
|
| 5. | Составьте электронную и графическую схемы образования молекулы азота. | 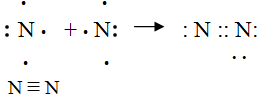
|
| 6. | В какой группе периодической системы находится? | V – А |
| 7. | В каком периоде? | 2 период |
| 8. | Какая низшая (в соединении с водородом и металлами) и высшая (в соединениях с кислородом) степень окисления азота? | -3, +5 |
По завершению работы взаимопроверка (правильные ответы выведены на экран интерактивной доски).
Учитель: Азот имеет несколько степеней окисления — 0, +1, +2, +3, +4, +5 и –3. Примеры соединений представлены на слайде.
Определим степень окисления азота в соединениях. На слайде представлены соединения азота: NH3 , N2O5, Mg3N2, NO, HNO3 , HNO2 , N2. Учащиеся в конспекте записывают соединения, определяя степень окисления азота.
Учитель: Ребята, давайте рассмотрим какое строение имеет молекула азота.
Учащийся расписывает на доске образование молекулы азота и объясняет с чем оно связано. Атомы азота связываются в двухатомную молекулу, для организации октета электронов им требуется расположить между собой три поделенные пары. Связь в молекуле N2 — ковалентная полярная, в молекуле три общие пары электронов, принадлежащие обоим атомам в одинаковой степени; таким образом, кратность связи (число связей) равна трём. При такой кратности связи — одна связь сигма- и две пи-связи. Молекула очень прочная, и необходима температура выше 3000 °C, чтобы разорвать её.
Физические свойства азота. Учащиеся рассказывают про физические свойства азота. На слайде перечислены физические свойства N2: газ без цвета и запаха, малорастворим в воде, Tкип. =− ° 195 C, Tпл. =− ° 210 C.
Учитель. А как вы думаете, ребята, какие химические свойства характерны для азота?
Ученики: Ввиду своей значительной инертности азот при обычных условиях не реагирует с другими веществами, кроме лития:
6Li + N2 → 2Li3N
При нагревании он реагирует с некоторыми другими металлами и неметаллами, также образуя нитриды:
3Mg+ N2 → Mg3N2
2B + N2 → 2BN.
В этих реакциях азот проявляет окислительные свойства.
Восстановительные свойства азота — это реакции с кислородом, протекающие при высоких температурах (электрический разряд — молния). Реакция эндотермическая:
N2+ O2 → 2NO - Q .
Способы получения азота. В промышленности азот получают из воздуха. Температура кипения азота немного ниже ( − ° 195 8, C), чем другого компонента воздуха — кислорода ( − ° 182 9, C), поэтому при осторожном нагревании жидкого воздуха азот испаряется первым.
В лаборатории азот получают термическим разложением нитрита аммония:
NH4NO2 → N2 ↑ + 2H2O .
Кроме этого, его можно получить разложением дихромата аммония.
Демонстрационный опыт. Получение азота разложением дихромата аммония.
У ч и т е л ь :В конспекте расставьте коэффициенты во всех уравнениях реакций по получению азота. А сейчас давайте поговорим о применении азота.
Сообщение ученика о применении азота.
У ч е н и к. Промышленные применения газообразного азота обусловлены его инертными свойствами. Газообразный азот пожаро- и взрывобезопасен, препятствует окислению, гниению. В нефтехимии азот применяется для продувки резервуаров и трубопроводов, проверки работы трубопроводов под давлением, увеличения выработки месторождений. В горнодобывающем деле азот может использоваться для создания в шахтах взрывобезопасной среды, для распирания пластов породы. В производстве электроники азот применяется для продувки областей, не допускающих наличия окисляющего кислорода. Важной областью применения азота является его использование для синтеза самых разнообразных соединений, содержащих азот, таких, как аммиак, азотные удобрения, взрывчатые вещества, красители и т. п. В пищевой промышленности азот зарегистрирован в качестве пищевой добавки E941, как газовая среда для упаковки и хранения, хладагент, а жидкий азот применяется при разливе масел и негазированных напитков для создания избыточного давления и инертной среды в мягкой таре. Жидкий азот применяется как хладагент и для криотерапии. Криотерапия — это лечение холодом. Применяется в таких областях, как общее оздоровление, спортивная медицина и реабилитация после травм, косметология, продление жизни и омоложение. Заморозка жидким азотом живых существ с возможностью последующей их разморозки пока проблематична.
Закрепление материала. (5 мин)
Учащимся дается задание закончить уравнения реакций и расставить в них коэффициенты методом электронного баланса.
1. Взаимодействие азота с металлами.
| 1-й вариант: К + N2 = 6К0 + N20 = 2K3+1N-3 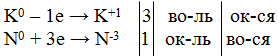
| 2-й вариант: Ca + N2 = Ca0 + N20 = Ca3+2 N2-3 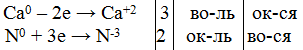
|
2. Взаимодействие с неметаллами.
| 1-й вариант: 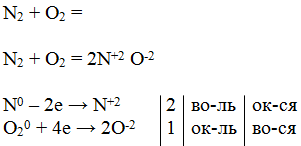
| 2-й вариант: 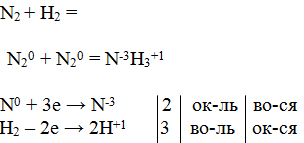
|
По окончанию работы проводится самопроверка (ответы на экране).
III Этап урока: Инструктаж о выполнении домашнего задания.
§22 стр.117-120, упражнения 4-1, 4-2, 4-3.
Даются пояснения к выполнению домашнего задания.
Рефлексия.
Что вам понравилось на уроке?
Что бы вы хотели изменить?