
Открытый урок по неорганической химии.


Учебно-воспитательные цели и задачи урока:
- Повторить и закрепить знания по теме «Электролитическая диссоциация»;
- Углубить понятие о свойствах электролитов как свойствах ионов;
- Научиться составлять полные и сокращенные ионные уравнения реакций;

- Сформировать понятие качественной реакции;
- Выяснить причину обратимости ионного обмена;
- Рассмотреть условия, при которых реакции обмена идут до конца.


Актуализация
знаний
студентов

Мобилизирующий этап

«Лабиринт букв»
Ц
И
К
А
И
Р
С
Е
И
О
Б
Р
О
О
Н
Г
А
Н
Н
М
О
Е
Б
К

- Используя «лабиринт букв» определите ключевое понятие урока.
- Какие уже известные Вам понятия включает это, пока еще новое для Вас понятие?
- Что такое ионы? С помощью каких веществ можно определить Н + и ОН - .
- Какие вещества и при каких условиях образуют ионы?
- На какие ионы диссоциируют водные растворы кислот, солей, оснований?

- Назовите основоположника ТЭД.
- Какие реакции называются реакциями обмена?
- Найдите из предложенных реакций реакции обмена:
1) K 2 CO 3 + H 2 SO 4
2) Mg+HCl
3) Na 2 SO 4 + Ba(NO 3 ) 2
4) Zn(OH) 2 t
5) NaOH+HCl
6) SO 3 + MgO

Сванте АРРЕНИУС (19.II.1859 − 2.X.1927)

Тема урока:

Pb(NO 3 ) 2 + 2KI = PbI 2 ↓+ 2 KNO 3
Почему в сухом виде соли не взаимодействуют , а при растворении протекает химическая реакция?
- Взаимодействие ионов в растворе называется ионной реакцией

При составлении ионных уравнений необходимо помнить:
- Сильные электролиты полностью диссоциируют на ионы;
- Вещества, покидающие сферу реакции ( осадок ↓, газ↑ ), малодиссоциироавнные вещества ( Н 2 О ), а также неэлектролиты ( оксиды, органические вещества ) записываются в молекулярной форме;
- Сумма зарядов в левой и правой частях уравнения равны нулю.

Порядок написания полного и сокращенного ионного уравнения
- Записать уравнение в молекулярной форме, расставить коэффициенты
Pb(NO 3 ) 2 + 2KI = PbI 2 + 2 KNO 3
2 . Обозначить вещества, покидающие сферу реакции

3 . Записать уравнение в ионной форме
Pb 2+ +2NO 3 - +2K + +2I - = PbI 2 ↓+2K + +2NO 3 -
4 . Исключить из обеих частей уравнения одинаковые ионы
Pb 2+ +2NO 3 - +2K + +2I - = PbI 2 ↓+2K + +2NO 3 -
5. Записать оставшиеся ионы
Pb 2+ +2I - = PbI 2 ↓
Сокращенное ионное уравнение:
отражает сущность реакции

В реакции могут вступать слабые электролиты или нерастворимые в воде соединения
СаСО 3 + 2 HCl = CaCl 2 + CO 2 ↑ + H 2 O
СаСО 3 + 2H + +2Cl - = Ca 2+ + 2Cl - + CO 2 ↑ + H 2 O
СаСО 3 + 2H + = Ca 2+ + CO 2 ↑ + H 2 O
- Будет такая реакция идти до конца?

С участием ионов могут протекать как обменные, так и окислительно-восстановительные реакции
5Na 2 SO 3 +2KMnO 4 +3H 2 SO 4 =
=2MnSO 4 +5Na 2 SO 4 +K 2 SO 4 +3H 2 O

Реакции ионного обмена в водных растворах могут протекать
Необратимо до конца
- когда ионы, соединяясь друг с другом образуют вещества:
а) нерастворимые (↓)
б) малодиссоциированные (Н 2 О)
в) газообразные (↑)
Обратимо ,
т.е. одновременно в двух противоположных направлениях
- если среди исходных веществ и среди продуктов имеются слабые электролиты или нерастворимые вещества
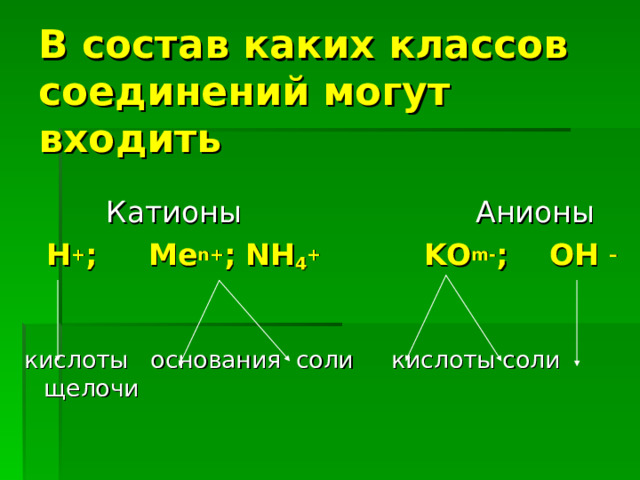
В состав каких классов соединений могут входить
Катионы Анионы
H + ; Me n+ ; NH 4 + KO m- ; OH –
кислоты основания соли кислоты соли щелочи
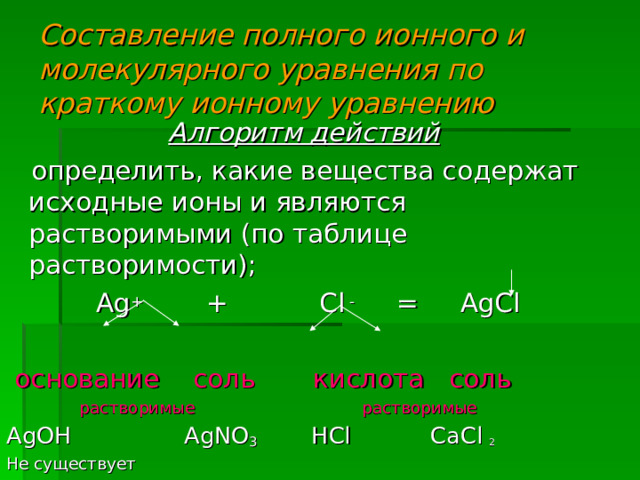
Составление полного ионного и молекулярного уравнения по краткому ионному уравнению
Алгоритм действий
определить, какие вещества содержат исходные ионы и являются растворимыми (по таблице растворимости);
Ag + + Cl - = AgCl
основание соль кислота соль
растворимые растворимые
AgOH AgNO 3 HCl CaCl 2
Не существует

- записать формулы реагентов в молекулярной форме ;
AgNO 3 + CaCl 2
- составить уравнение реакции в молекулярной и ионной форме
AgNO 3 + CaCl 2 = 2 AgCl + Ca(NO 3 ) 2

Приведите примеры трех уравнений реакций, которые можно выразить одним ионным уравнением:
3Ca 2+ + 2PO 4 3- = Ca 3 (PO 4 ) 2

Могут ли одновременно существовать в растворе следующие ионы:
a ) Na + и NO 3- ,
б) OH - и Fe 3+ ,
в) Ag + и Br - ?

Значение реакций ионного обмена
Реакции ионного обмена широко распространены в живой и неживой природе при образовании:
- осадочных пород (гипса, известняка, солей);
- при переработке радиоактивных отходов;
- при очистке сточных вод, очистке воздуха, осаждении катионов тяжелых металлов ( Hg, Pb, Cd, Cu, As, Zn );
- при проведении качественного анализа сырья и готовой продукции
- процесс ионного обмена используют в аналитической химии.

1. Научились составлять уравнения реакций, которые отражают сущность реакций ионного обмена;
2. Выяснили, что сущность реакции нейтрализации сводится к взаимодействию ионов Н + (носителя кислотных свойств) и ОН - (носителя щелочных свойств), в результате чего получается вода. Это можно рассматривать как диалектическое единство противоположных начал .

- Зная свойства ионов, можно предсказать результаты реакций между электролитами .
- Зная свойства ионов, можно предсказать результаты реакций между электролитами .
4. Выяснили условия, при которых реакции ионного обмена идут до конца, и причину обратимости ионного обмена .

- Выполнить задания по опорному конспекту.
- Ю.М. Ерохин, В.И.Фролов "Сборник задач и упражнений по химии" стр. 58-60 № 1,3,5,12, стр.66 №47.
- Подготовиться к лабораторной работе №1





















































