Өткізілген күні «___» ______________ 2012 ж.
ПЕРИОДТЫҚ ЗАҢНЫҢ АШЫЛУЫНА АЛҒАШҚЫ ҚАДАМДАР
тақырыбына ашық cабақ
Қарағанды облысы Бұқаржырау ауданының
Березняк орта мектебінің
химия пәні мұғалімі
Сыздыкова Сабиля Елемесовна
Сабақтың мақсаты:
1) Білімділік: Д.И.Менделеевтің периодтық заңын, периодтық жүйесі мен химиялық реакцияларды қорыту, тарауды жүйелеу.
2) Дамытушылық: Оқушыларға Д.И.Менделеевтің периодтық заңы мен периодтық жүйесінің өмірдегі маңызын меңгерту арқылы белсенділігін арттырып, іскерлікке баулу, дүниетанымдық көзқарастарын қалыптастыру.
3) Тәрбиелік: ойлау қабілеттерін дамыта отырып ұқыптылыққа, байқампаздыққа тәрбиелеу.
Сабақтың типі: алған білімдерін қорытындылау
Сабақтың түрі: сайыс сабағы
Сабақтың әдіс-тәсілдері: ауызша баяндау, ассоциация, сұрақ-жауап, түсіндірмелі-көрсетілімдік, есеп шығару, реакция теңдеулерін жазу
Сабақтың көрнекі-құралдары: Д.И.Менделеевтің периодтық жүйесі, плакаттар, тапсырмалар, химиялық лабораториялық құралдар, слайдтар мен буклеттер
Сабақтың барысы:
І.Ұйымдастыру кезеңі 2 мин
1) Оқушылармен сәлемдесу.
2) Оқушыларды түгелдеу.
3) Оқушыларды сабақтың мақсатымен таныстыру.
Сынып оқушылары үш топқа бөлінеді:
«Менделеев»
«Оттек»
«Сутек»
ІІ. Негізгі бөлім
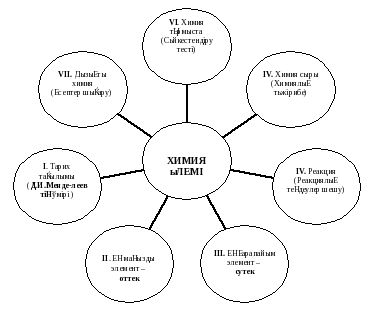
І кезең «Тарих тағылымы» 3 мин
«Д.И.Менделеевтің өмірі мен қызметі»
Менделеев Дмитрий Иванович
1834 - 1907
 Орыс ғалымы, Петербург ҒА-ның (ғылыми академиясы) мүше-корреспондентi (1876 жылдан) Менделеев Д.И. Тобольскiде туылып (1834ж.), Петербургтегi Бас педагогикалық институтты (1855ж.) тәмамдады. 1855 – 1856 жылдары Одессадағы Ришельевский лицейi жанындағы гимназия мұғалiмi. 1857 – 1890 жылдары Петербург университетiнде (1865 жылдан профессор) дәрiс оқыды, сонымен бiр мезгiлде 1863 – 1872 жылдары Петербург технология институтының проессоры. 1859 – 1861 жылдары Гейдельбергте ғылыми iс-сапарда болды. 1890 жылы оқу-ағарту министрiмен келiспеушiлiктен кейiн университеттен шығып кеттi. Ғылыми жұмыстары негiзнен химия саласына және одан басқа физика, химиялық технология, экономика, ауылшаруашылығы, метрология, география, метеорология салаларына қатысты. Изоморфизм құбылысын (1854-1856 жылдары) және элементтер қасиетiнiң олардың атомдық көлемiнен тәуелдiлiгiн зерттедi. 1860 жылы “сұйықтың абсолюттiк қайнау температурасын" (немесе дағдарыстық) ашты.
Орыс ғалымы, Петербург ҒА-ның (ғылыми академиясы) мүше-корреспондентi (1876 жылдан) Менделеев Д.И. Тобольскiде туылып (1834ж.), Петербургтегi Бас педагогикалық институтты (1855ж.) тәмамдады. 1855 – 1856 жылдары Одессадағы Ришельевский лицейi жанындағы гимназия мұғалiмi. 1857 – 1890 жылдары Петербург университетiнде (1865 жылдан профессор) дәрiс оқыды, сонымен бiр мезгiлде 1863 – 1872 жылдары Петербург технология институтының проессоры. 1859 – 1861 жылдары Гейдельбергте ғылыми iс-сапарда болды. 1890 жылы оқу-ағарту министрiмен келiспеушiлiктен кейiн университеттен шығып кеттi. Ғылыми жұмыстары негiзнен химия саласына және одан басқа физика, химиялық технология, экономика, ауылшаруашылығы, метрология, география, метеорология салаларына қатысты. Изоморфизм құбылысын (1854-1856 жылдары) және элементтер қасиетiнiң олардың атомдық көлемiнен тәуелдiлiгiн зерттедi. 1860 жылы “сұйықтың абсолюттiк қайнау температурасын" (немесе дағдарыстық) ашты.
“Органикалық химия" – атты бiрiншi орыс оқулығының авторы (1861ж.). “Химия негiздерi" еңбегiмен жұмыс кезiнде (1869ж. февраль) химиялық элементтердiң периодтық заңын ашты. Ол ашқан периодтықзаңы кейiнгi химиктер мен физиктерге атом құрылысын зерттеуге, периодтық себептерiн талқылауға және заңның физикалық мағынасын зерттеуге жол ашты.
1859 ж. сұйық тығыздығын анықтайтын құралды – пикнометрдi құрастырды. 1865 – 1887 жылдары қопалардың гидраттық теориясын жасады.
Ол көптеген ғылым академиялары мен ғылыми қоғамдардың мүшесi. Орыс физика-химия қоғамын (1868ж.) құрушылардың бiрi.
Оның құрметiне №101 – ші элемент менделевий деп аталған.
Х1Х ғасырдың екінші жартысында алпыстан астам химиялық элементтер ашылып, олардың қасиеттері және ол элементтердің қосылыстарының қасиеттері зерттелді. Осындай толып жатқан материалдарды бір жүйеге келтіру қажет болды. Элементтерді жүйеге келтіру мәселесін Д. И. Менделеев шешті. Ол 1869 жылы периодтық заңды ашып, 1871 жылы анықтамасын берді және сол заңның негізінде элементтердің периодтық жүйесін жасады. Элементтерді жүйеге келтірудің негізі етіп олардың атомдық массаларын алды. Д. И. Менделеевтің периодтық заңы химия ғылымдарын дамуына зор ықпалын тигізді. Периодтық заң барлық элементтерді бір жүйеге келтірді. Жеке алынған бір элементтің қасиеттерін кестедегі оны қоршаған басқа элементтердің қасиеттері арқылы анықтауға мүмкіндік туды. Периодтық заңды пайдаланып химияда алдын ала ғылыми болжамдар жасауға жол ашылды. Жаңа элементтердің қасиеттері мен олардың қосылыстарының қасиеттерін болжап айтуға мүмкін болды.
ІІ кезең «Ең маңызды элемент – оттек» 3 мин
«Оттек» латын тілінен аударғанда – оксигениум – қышқыл тудырушы деген мағына білдіреді. Д.И.Менделеев құрастырған химиялық элементтердің периодтық жүйесінде оттек 8-орында тұр. Салыстырмалы атомдық массасы 16 тең. Оттек молекуласы екі атомды жай зат болып саналады. Газ күйіндегі оттек басқа газдармен бірге ауа атмосферасын құрайды. Біздің планетамыздағы атмосферада оттек бос күйінде 21% (көлем бойынша) шамасында болады. Жер қыртысында басқа химиялық элементтермен қосылыс түріндегі оттектің массасы 49,13% тең. Оттек биохимиялық процестерге қатысады, тыныс алу үшін қажет. Ол иіссіз, түссіз, дәмсіз газ. Суда аз ериді. Ауадан сәл ауыр. Табиғатта күн сәулесі әсерінен жүретін әйгілі фотосинтез процесі кезінде жасыл өсімдіктер оттекті бөліп шығарады. Өнеркәсңпте оттекті көп мөлшерде сұйық ауаны айдау арқылы алды. Лабораторияда құрамында оттек мол болатын әрі қыздыру кезінде тез айырылатын күрделі заттардан алады. Жай және күрделі заттармен қосып қыздырғанда, оттек олармен қуатты әрекеттеседі. Реакция кезінде жылу бөлініп, жарық шықса - жану реакциясы пайда болады. Оттек жану, тыныс алу, металдың таттануы, өсімдік пен жануар қалдықтарының шіруі сияқты маңызды процестерге қатысады. Оттек элементінің екі атомнан тұратын моолекуласынан басқа, кәдімгі жағдайда үш атомнан құралған газ тектес болып келетін тағы бір түрі О3 – озон молекуласы бар. Озон көкшілдеу түсті, өзіне тән ерекше иісі бар газ. Суда аз ериді, оттек газынан 1,5 есе ауыр. Оны қолдану арқылы ауыз су мен ақын судағы, бөлме ауасындағы бактерияны жояды. Найзағай ойнағанда, кварц лампалары жұмыс істеп тұрғанда пайда болады. Найзағайлы жаңбырдан соң шығатын ерекше иіс те озонға тән.
III кезең «Ең қарапайым элемент – сутек» 3 мин
Сутек Д.И.Менделеев жасаған элементтердің периодтық кестесінде бірінші орында тұр. Атомдық массасы 1,008. Жай зат түзетін газ күйіндегі сутек – екі атомнан тұратын молекуладан тұрады. Ең жеңіл газ болғандықтан, ғарыш кеңістігінде кең тараған. Күн жүйесі планеталарының 92% сутек атомы құрайды. Көп тараған сутектің ең басты қосылысы – су.судағы сутектің массалық үлесі – 11%. Сутекті отын ретіне пайдаланған тиімді. Әзірше сутекті көп мөлшерде өндіруге болатын шикізаттар – метан мен суды айыру қымбатқа түсіп отыр. Келешекте автомобильдерді сутек отыны көмегімен жүргізуді дамыту көзделуде. Сутекті 1776 жылы ағылшын ғалымы Г.Кавендиш алды. Латын тілінен «гидрогениум» - «су тудырушы» деген мағынаны білдіреді.
ІV кезең «Реакция» (Реакциялық теңдеулер шешу) 6 мин
Химиялық реакциялардың қандай типтері болады?
Тақтаға сызба-нұсқа ілініп, айналасындағы реакция типтеріне сәйкес реакция теңдеулерін жазу.

I.
Na2CO3 + 2HCl =2NaCl + H2O + CO2
KOH + HNO3=KNO3 + H2O
Mg(OH)2 + H2SO4=MgSO4 + 2H2O
II.
2Fe(OH)3=Fe2O3 + 3H2O
SO3 + H2O=H2SO4
CaCO3 +2 NaCl=CaCl2 + Na2CO3
III.
H2 + Cl2=2HCl
2Al(OH)3=Al2O3 + 3H2O
MgSiO3 + 2LiOH=Mg(OH)2 + Li2SiO3
V кезең «Химия сыры» (Химиялық тәжірибелер) 10 мин

Тәжірибе: I. Мырышқа қышқылмен әсер етіп сутек газын алу.
Газ алатын қондырғы құрастырып, оның герметикалықтығың тексеріңдер. Сынауыққа 6-7 түйір мырыш салыңдар, үстіне 8-9 мл фосфор қышқылы ерітіндісін құйындар. Сынауықтың аузын газ шығатын түтікпен бекітіп, екінші сынауықтың аузын төмен қаратып сутек газын жинаңдар. Сутекті неге бұлай жинайды? Сутекті қалай анықтауға болады?
Тәжірибе: II. Бейтараптану реакциясы.
Құтыға натрий гидрокисді ерітіндісінің 5-6 мл құйыңдар. Үстіне түссіз фенолфталеин индикаторын құйыңдар. Ерітіндінің түсі қалай өзгереді? Неге? Бұдан соң өлшеуірден азот қышқылын тамшылап құйыңдар. Қандай өзгерістер байқалады? Реакция нәтижесінде қандай қосылыстар түзіледі?
Тәжірибе: III. Натрийдің сумен әрекеттесуі.
Химиялық құтыға 5 г натрий металын салыңдар. Үстіне су құйып, құтыны құйғымен жабыңдар. Құйғының үстінен аузы төмен қаратылған сынауықты орналастырыңдар. Не байқалады? Реакция нәтижесінде түзілетін сутек газы сынауықтын ішінде жиналады.
VI кезең «Химия тұрмыста» (Сәйкестендіру тесті) 5 мин
Бейорганикалық қосылыстар неше класқа жіктеледі? (4 класқа: оксидтер, негіздер, қышқылдар, тұздар)
Тұздар дегеніміз не? (Тұз – металл атомдарынан және қышқыл қалдықтарынан тұратын күрделі заттар. Тұзды - қышқылды негізбен бейтараптау реакциясы нәтижесінде түзіледі.)
Тапсырма: Тұздардың химиялық және тұрмыстық аталуының формулаға сәйкес тобын құрастыру.
| Р/с | Формуласы | Химиялық атауы | Тұрмыстық атауы |
| Т | NaNO3 |
|
|
| Ұ | NaHCO3 |
|
|
| З | KClO3 |
|
|
| Д | CaCO3 |
|
|
| А | KMnO4 |
|
|
| Р | NaCl |
|
|
Жауабы:
| Р/с | Формуласы | Химиялық атауы | Тұрмыстық атауы |
| Т | NaNO3 | Натрий нитраты | Тыңайтқыш, үнді селитрасы |
| Ұ | NaHCO3 | Натрий гидрокарбонаты | Ас содасы |
| З | KClO3 | Калий хлораты | Бертолле тұзы |
| Д | CaCO3 | Кальций карбонаты | Әк тас, бор |
| А | KMnO4 | Калий перманганаты | Марганцовка |
| Р | NaCl | Натрий хлориді | Ас тұзы |
VII кезең «Қызықты химия» (Есептер шығару) 10 мин
14,7г мыс (ІІ) гидроксиді ыдырау кезінде түзілетін мыс оксидінің массасын есептеңдер.
Шешуі:
14,7г х г
Cu(OH)2 = CuO + H2O
97,5г 79,5г
m(CuO)=m(Cu(OH)2)* m(CuO)/m(Cu(OH)2)
m(CuO)=63.5 + 16 = 79.5г
m(Сu(OH)2)=63.5 + 2*16 + 2*1 = 97.5г
m(CuO)= 14.7 г * 79.5г/97,5г =12г
Жауабы: m(CuO) = 12 г
13 г цинк тұз қышқылымен әрекеттескенде түзілетін тұздың массасын есептеңдер.
Шешуі:
13г x г
Zn + 2HCl = ZnCl2 + H2↑
65 г 136 г
m(Zn) = 65 г
m(ZnCl2)= 65 + 2*35.5 = 136 г
m(ZnCl2) = m(ZnCl2)·m(Zn)/m(Zn) = 13г·136 г/65г = 27,2 г
Жауабы: m(ZnCl2) = 27,2 г
6 г магний оксиді ыдыраған кезде түзілетін оттегінің көлемін (қ.ж.) есептеңдер.
Шешуі:
6 г х л
2MgO = 2Mg + O2↑
80 г 22,4 л
m(MgO) = (24 + 16)*2 = 80 г
Vm(O2)=22.4 л/моль
V(O2) = m(MgO)·Vm / m(MgO) = 6г * 22,4 л / 80 г = 1,68 л
Жауабы: V(O2) = 1,68 л.
ІІІ. Қорытынды
Бағалау. 2 мин
Оқушыларды алған білімдері бойынша бағалау. Бағаларын күнделікке қою.
Үй тапсырмасы. 2 мин
Д.И.Менделееевтің ғылым, білім туралы нақыл сөздерін жазып келу.








 Орыс ғалымы, Петербург ҒА-ның (ғылыми академиясы) мүше-корреспондентi (1876 жылдан) Менделеев Д.И. Тобольскiде туылып (1834ж.), Петербургтегi Бас педагогикалық институтты (1855ж.) тәмамдады. 1855 – 1856 жылдары Одессадағы Ришельевский лицейi жанындағы гимназия мұғалiмi. 1857 – 1890 жылдары Петербург университетiнде (1865 жылдан профессор) дәрiс оқыды, сонымен бiр мезгiлде 1863 – 1872 жылдары Петербург технология институтының проессоры. 1859 – 1861 жылдары Гейдельбергте ғылыми iс-сапарда болды. 1890 жылы оқу-ағарту министрiмен келiспеушiлiктен кейiн университеттен шығып кеттi. Ғылыми жұмыстары негiзнен химия саласына және одан басқа физика, химиялық технология, экономика, ауылшаруашылығы, метрология, география, метеорология салаларына қатысты. Изоморфизм құбылысын (1854-1856 жылдары) және элементтер қасиетiнiң олардың атомдық көлемiнен тәуелдiлiгiн зерттедi. 1860 жылы “сұйықтың абсолюттiк қайнау температурасын" (немесе дағдарыстық) ашты.
Орыс ғалымы, Петербург ҒА-ның (ғылыми академиясы) мүше-корреспондентi (1876 жылдан) Менделеев Д.И. Тобольскiде туылып (1834ж.), Петербургтегi Бас педагогикалық институтты (1855ж.) тәмамдады. 1855 – 1856 жылдары Одессадағы Ришельевский лицейi жанындағы гимназия мұғалiмi. 1857 – 1890 жылдары Петербург университетiнде (1865 жылдан профессор) дәрiс оқыды, сонымен бiр мезгiлде 1863 – 1872 жылдары Петербург технология институтының проессоры. 1859 – 1861 жылдары Гейдельбергте ғылыми iс-сапарда болды. 1890 жылы оқу-ағарту министрiмен келiспеушiлiктен кейiн университеттен шығып кеттi. Ғылыми жұмыстары негiзнен химия саласына және одан басқа физика, химиялық технология, экономика, ауылшаруашылығы, метрология, география, метеорология салаларына қатысты. Изоморфизм құбылысын (1854-1856 жылдары) және элементтер қасиетiнiң олардың атомдық көлемiнен тәуелдiлiгiн зерттедi. 1860 жылы “сұйықтың абсолюттiк қайнау температурасын" (немесе дағдарыстық) ашты. 












