ПЛАН-КОНСПЕКТ открытого урока по химии,
составленного на основе системно-деятельностного подхода с применением технологии В.Ф. Шаталова для учеников 9 класса с целью профориентационной работы
Тема: Реакции ионного обмена
Цель: Ознакомить учащихся с реакциями ионного обмена и условиями их протекания
Задачи:
Обучающие:
Формирование знаний об обратимых и необратимых реакциях.
Формирование представления о реакциях ионного обмена между растворами электролитов.
Формирование знаний об условиях протекания реакций ионного обмена
Формирование умений составления полных и сокращенных ионных уравнений
Закрепление навыков составления полных и сокращенных ионных уравнений
Развивающие:
Развитие интеллектуальных умений (для составления опорных конспектов путем анализа и синтеза приобретенных знаний)
Повышение уровня владения устной речью
Развитие коммуникативных умений (для участия в дискуссии)
Закрепление приемов обращения с лабораторным оборудованием и соблюдение техники безопасности в кабинете химии
Воспитывающие:
Обучение взаимоконтролю
Повышение интереса к изучаемому предмету и выбранной профессии
Создание эмоционального настроя, активирование творческой деятельности учащихся
Оборудование: набор реактивов для демонстрации реакций, программа деятельности «Составление ионных уравнений реакций», опорные конспекты «Классификация неорганических веществ», «Классы неорганических веществ», таблица Д.И. Менделеева, таблица растворимости
Технологии – 1) Интенсификация обучения на основе схемных и знаковых моделей учебного материала; 2) Системно-деятельностный метод; 3) Педагогика сотрудничества.
Эпиграф к уроку –
Электролитическая диссоциация
оказалась применимой и полезной
во всех областях современной науки
Сванте Аррениус
Ход урока
Организационный момент
Здравствуйте ребята. Работать будем следующим образом: Систематизация знаний, контроль домашнего задания, изучение новой темы с последующим закреплением. Отсутствующих отметим в конце урока.
Актуализация и систематизация знаний
(Составление опорного конспекта)
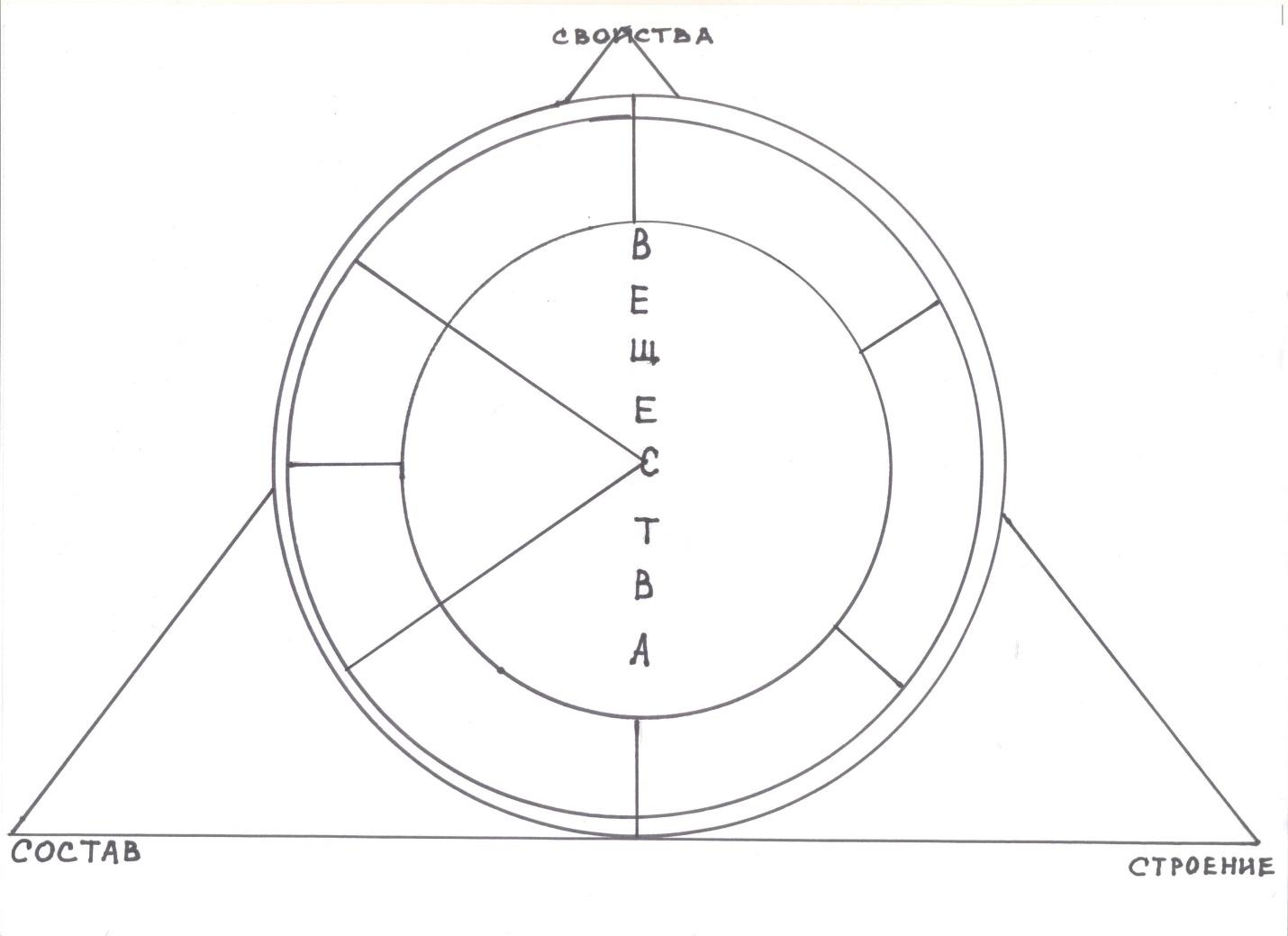
Любые накопленные знания требуют их систематизации. Учебный материал, факты, большой объем информации можно зашифровать в опорный конспект.
Преподаватель: Что является объектом изучения химии?
Учащиеся: Вещества
Преподаватель: Только ли вещества изучает химия?
Учащиеся: Свойства, состав и строение
Преподаватель: Как классифицируются вещества?
Учащиеся: Простые и сложные (Вписывают в опорный конспект)
Преподаватель: Как классифицируются простые вещества?
Учащиеся: Металлы и неметаллы (Вписывают в опорный конспект)
Преподаватель: Как классифицируются сложные вещества?
Учащиеся: Оксиды, кислоты, основания, соли (Вписывают в опорный конспект)
Преподаватель: По какому принципу происходит деление на металлы и неметаллы?
Учащиеся: Потому что одни из них имеют металлический блеск, ковки, тепло- и электропроводны, а другие не обладают этими физическими свойствами. Металлы являются проводниками первого рода (носитель заряда – электрон).
Преподаватель: Электрической проводимостью обладают не только металлы, но и растворы, и расплавы многих сложных веществ. Как называются такие вещества?
Учащиеся: Электролиты (Вписывают в опорный конспект)
Преподаватель: «Литос»- растворенный. Это проводники второго рода (носитель заряда – ион). Какие вещества являются электролитами?
Учащиеся: Кислоты, основания и соли
Преподаватель: Какие вещества называются неэлектролитами и что к ним относится?
Учащиеся: Это вещества, растворы и расплавы которых не проводят электрический ток. (Вписывают в опорный конспект) Простые вещества и оксиды.
Преподаватель: Как называется процесс распада электролита на ионы?
Учащиеся: Электролитическая диссоциация
Преподаватель: Дайте определения терминам кислота, основание и соль с точки зрения ТЭД (если на это останется время)
Учащиеся: отвечают по желанию с места
Преподаватель: В домашнем задании (Упр. 2 на стр. 68) необходимо было написать уравнения диссоциации веществ
Контроль домашнего задания
(взаимоконтроль)
Учащиеся обмениваются тетрадями. 3 человека воспроизводят уравнения на доске по 1 веществу – кислота, основание и соль. Остальные проверяют друг у друга только эти 3 вещества и выставляют оценки по критерию:
Решено верно 1 уравнение – «3»
Решено верно 2 уравнения – «4»
Решено верно 3 уравнения – «5»
Оценки учитель выставит после собственной проверки, оценивая при этом объективность уже поставленной оценки. Тетради собрать в конце урока.
Изучение нового материала
Мы систематизировали наши знания о веществах. Вещества характеризуются не только физическими свойствами, но и химическими.
Преподаватель: Что называют химическими свойствами?
Учащиеся: Способность реагировать между собой, вступать в химические реакции
Преподаватель: Реакция (лат.) «ре» - против; «акцио» - действие. Это действие в ответ на какое-либо воздействие. Какие вы знаете признаки химической реакции?
Учащиеся: появление газа, осадка, запаха, изменение цвета, образование теплоты
Преподаватель: Какие вы знаете типы химических реакций?
Учащиеся: Соединения, разложения, обмена, замещения
Преподаватель: Сегодня мы продолжим изучение типов реакции и углубим свои знания. Согласно теории электролитической диссоциации все реакции в водных растворах электролитов являются реакциями между ионами. Тема урока – реакции ионного обмена (Учитель записывает на доске)
Реакции ионного обмена – это реакции, протекающие между ионами в растворах электролитов (Запись определения в тетрадь)
Преподаватель на доске, учащиеся в тетради записывают мини-схему:
| Реакции ионного обмена |
| Необратимые (протекают до конца) | Обратимые (не протекают до конца) |
| 1.Образуется осадок ↓
| Продукты реакции хорошо растворимы в воде и не уходят из сферы реакции |
| 2.Выделяется газ ↑
|
| 3.Образуется малодиссоциирующее вещество, например вода (Н2О)
|
Объяснение учителя сопровождается очень быстрой демонстрацией реакции без записей уравнения.
Преподаватель: Реакции ионного обмена имеют большое значение в любой отрасли. И не случайно эпиграфом к уроку взяты слова основоположника теории электролитической диссоциации С. Аррениуса. (Учитель обращает внимание на эпиграф).
В сельском хозяйстве (процессы, происходящие в почве – это ионнообменные взаимодействия веществ)
В пищевой отрасли (Для выпекания тортов и бисквитов используют соду, гашеную уксусом)
В полиграфическом производстве тоже используются реакции ионного обмена. Они записаны на листах. (Учитель обращает внимание листы).
Химические реакции, используемые в полиграфическом производстве
| Уравнение | Применение |
| 1 | ВаCl2+H2SO4→BaSO4↓+2HCl | Бариевые белила. Приготовление пигментов и красок |
| 2 | ВаCl2+К2CrO4→ ВаCrO4+2КCl | Приготовление желтого пигмента |
| 3 | AgNO3+KBr→AgBr↓+KNO3 | В фотографии при изготовлении светочувствительной пленки |
| 4 | AgNO3+NaCl→AgCl↓+NaNO3 | Применение в фотографическом процессе солей серебра. Пропитка листа бумаги AgNO3 и погружение его в раствор NaCl. На бумаге протекает данная обменная реакция |
| 5 | AlCl3+3NaOH→Al(OH)3↓+3NaCl | Приготовление прозрачного пигмента |
| 6 | 2Al+6HCl→2AlCl3+3H2↑ | Алюминий применяют для изготовления офсетных форм позитивным копированием |
| 7 | ZnCO3+H2SO4→ZnSO4+H2O+CO2↑ | Изготовление печатных форм |
| 8 | ZnCO3+2HCl→ ZnCl2+H2O+CO2↑ | Приготовление копирующего слоя |
Необратимые реакции записывают в ионном виде. Для этого нам нужна программа деятельности, памятка, таблица растворимости и опорный конспект, выданный ранее. (Учитель показывает материалы к уроку. Они лежат на столах).
Работа по программе деятельности
Учитель на примере реакций, используемых в полиграфическом производстве, объясняет составление реакций ионного обмена. Объяснение сопровождает демонстрацией реакций.
ПРОГРАММА ДЕЯТЕЛЬНОСТИ
«Составление ионных уравнений реакций»
| Программа деятельности | Пример |
| 1. А) Записать молекулярное уравнение реакции (смотри опорный конспект). Б) Определить растворимость каждого вещества (смотри таблицу растворимости) |
|
| 2. А) Составить полное ионное уравнение реакции (смотри памятку). Б) Найти одинаковые ионы и сократить их в правой и левой части |
|
| 3.Составить сокращенное ионное уравнение реакции |
|
| Проверка: Сумма электрических зарядов ионов в левой части уравнения должна быть равна сумме электрических зарядов ионов в правой части |
|
Таблица растворимости – специальная таблица, по которой судят о растворимости веществ в воде. Составлена химиками на основании опытов. (Объясняет, как пользоваться таблицей растворимости)
| ПАМЯТКА При составлении ионных уравнений реакций НЕЛЬЗЯ записывать в виде ионов:
Малорастворимые и нерастворимые соединения (см. таблицу растворимости). Слабые электролиты (слабые кислоты, слабые основания, вода) (см. опорный конспект). Газообразные продукты (Н2, О2, Cl2, РН3, SiH4, N2) Простые вещества (S, Zn, Al, F, Br2, I2) Оксиды (CO, CO2, H2O, SO2, SO3, P2O5) |
Закрепление
Один учащийся у доски осуществляет практически реакцию и записывает уравнение в ионном виде. Остальные записывают в тетради. Учитель направляет, проверяет:
| ВаCl2+К2CrO4→ ВаCrO4+2КCl |
| AlCl3+3NaOH→Al(OH)3↓+3NaCl |
| ZnCO3+H2SO4→ZnSO4+H2O+CO2↑ |
| ZnCO3+2HCl→ ZnCl2+H2O+CO2↑ |
Заключительный этап урока
Подведение итогов. Сбор тетрадей с домашним заданием
Домашнее задание
§ 17. Упр. 2 стр. 74.
Приложение 1
РЕАКЦИИ ИОННОГО ОБМЕНА
| ПАМЯТКА При составлении ионных уравнений реакций НЕЛЬЗЯ записывать в виде ионов:
Малорастворимые и нерастворимые соединения (см. таблицу растворимости). Слабые электролиты (слабые кислоты, слабые основания, вода) (см. опорный конспект). Газообразные продукты (Н2, О2, Cl2, РН3, SiH4, N2) Простые вещества (S, Zn, Al, F, Br2, I2) Оксиды (CO, CO2, H2O, SO2, SO3, P2O5) |
ПРОГРАММА ДЕЯТЕЛЬНОСТИ
«Составление ионных уравнений реакций»
| Программа деятельности | Пример |
| 1. А) Записать молекулярное уравнение реакции (смотри опорный конспект). Б) Определить растворимость каждого вещества (смотри таблицу растворимости) |
|
| 2. А) Составить полное ионное уравнение реакции (смотри памятку). Б) Найти одинаковые ионы и сократить их в правой и левой части |
|
| 3.Составить сокращенное ионное уравнение реакции |
|
| Проверка: Сумма электрических зарядов ионов в левой части уравнения должна быть равна сумме электрических зарядов ионов в правой части |
|
Химические реакции, используемые в полиграфическом производстве
| Уравнение | Применение |
| 1 | ВаCl2+H2SO4→BaSO4↓+2HCl | Бариевые белила. Приготовление пигментов и красок |
| 2 | ВаCl2+К2CrO4→ ВаCrO4+2КCl | Приготовление желтого пигмента |
| 3 | AgNO3+KBr→AgBr↓+KNO3 | В фотографии при изготовлении светочувствительной пленки |
| 4 | AgNO3+NaCl→AgCl↓+NaNO3 | Применение в фотографическом процессе солей серебра. Пропитка листа бумаги AgNO3 и погружение его в раствор NaCl. На бумаге протекает данная обменная реакция |
| 5 | AlCl3+3NaOH→Al(OH)3↓+3NaCl | Приготовление прозрачного пигмента |
| 6 | 2Al+6HCl→2AlCl3+3H2↑ | Алюминий применяют для изготовления офсетных форм позитивным копированием |
| 7 | ZnCO3+H2SO4→ZnSO4+H2O+CO2↑ | Изготовление печатных форм |
| 8 | ZnCO3+2HCl→ ZnCl2+H2O+CO2↑ | Приготовление копирующего слоя |
Приложение 2