|
Вспомните что же представляет собой химическая связь? химическая связь - это такое взаимодействие атомов, которое связывает их в молекулы, ионы, радикалы, кристаллы
Какова же причина образования химической связи? Почему атомы образуют химические связи? Причина в стремлении атомов к стабильной электронной конфигурации. -Атомы каких химических элементов практически не образуют химических связей? Инертные газы, так как они имеют стабильную электронную конфигурацию. - Сегодня мы продолжаем изучение строение веществ. На сегодняшнем уроке мы с вами должны расширить знаний о химических связях и их типах.
Рассказ учителя. В образовании химической связи участвуют только валентные электроны. У элементов главных подгрупп это электроны внешнего энергетического уровня. Они расположены дальше от ядра и менее прочно связаны с ним. В зависимости от способа образования завершённых электронных структур атомов различают несколько видов химической связи.
Различают три случая образования химической связи. а) Между атомами элементов, электроотрицательность которых одинакова; б) Между атомами в металле, электроотрицательность которых также одинакова. 2. Между атомами элементов, электроотрицательность которых отличается, но не сильно. 3. Между атомами элементов, электроотрицательность которых резко отличается. Химическая связь, возникающая в результате образования общих электронных пар, называют ковалентной связью. Н + Н Н : Н s-s - связь s-p - связь p-p - связь - связь Ковалентная химическая связь бывает полярной и неполярной Н + CI H : CI H CI Химическую связь, возникающую между ионами в результате действия электростатических сил притяжения, называют ионной связью Связь, образованная между двумя неметаллами, называется ковалентной. Она осуществляется за счет образования общих электронных пар между двумя атомами неметаллов. КОВАЛЕНТНАЯ СВЯЗЬ - это связь, возникающая между атомами за счет образования общих электронных пар (Например: H2, HCl, H2O). По степени смещённости общих электронных пар к одному из связанных ими атомов ковалентная связь может быть полярной и неполярной. Вспомним что такое электроотрицательность? Электроотрицательность (ЭО) - это свойство атомов одного элемента притягивать к себе электроны от атомов других элементов. Какой самый электроотрицательный химический элемент? Самый электроотрицательный элемент – фтор F Электроотрицательность можно выразить количественно и выстроить элементы в ряд по ее возрастанию. Наиболее часто используют ряд электроотрицательности элементов, предложенный американским химиком Л. Полингом. Как меняются значения электроотрицательности в периодической системе по периоду и подгруппе? (вывод: Металлы имеют более низкое значение электроотрицательности, чем неметаллы. И между ними она сильно отличается.) Таблица. Электроотрицательности (ЭО) некоторых элементов (приведены в порядке возрастания ЭО). Составим схемы образования ковалентной связи. Если связь образуется между двумя одинаковыми атомами или между атомами с одинаковым значением ЭО, то смещения общей электронной пары нет и такая связь носит название неполярной. КОВАЛЕНТНАЯ НЕПОЛЯРНАЯ СВЯЗЬ(КНС) - образуют атомы одного и того же химического элемента - неметалла (Например: H2, O2, О3). Механизм образования связи. (Составление электронных формул молекул простых веществ неметаллов) Число неспаренных электронов =8 – номер группы элемента Например, у серы число неспаренных электронов равно 8 – 6 = 2. Ковалентная связь – это химическая связь между атомами, осуществляемая при помощи общих электронных пар. . Электронная пара принадлежит в равной мере обоим атомам. Рассмотрим механизм образования молекулы хлора:Cl2 – кнс. Электронная схема образования молекулы Cl2: 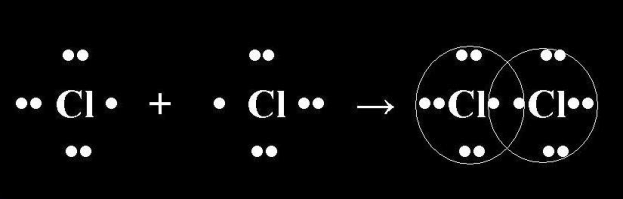
Структурная формула молекулы Cl2:. σ Cl – Cl , σ (p – p) - одинарная связь 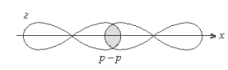
Образование молекулы водорода Атомы образуют связь, осуществляемую общей для них электронной парой, для достижения наиболее стабильной электронной конфигурации, которая может быть представлена следующим образом (электроны обозначены точками): 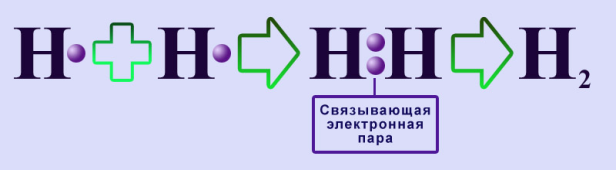
Электронную пару можно обозначить черточкой: 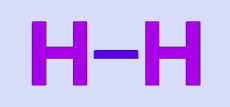
Связь между двумя атомами образуется тогда, когда они приближаются друг к другу на расстояние, достаточное для того, чтобы электроны каждого из них оказались в пределах взаимодействия с ядром другого атома. Предположим, что связь образуют два неметалла с различными значениями электроотрицательности. (Учитель берет за руку ученика, имитируя образование химической связи). Неспаренные электроны одного атома соединяются с неспаренными электронами другого атома, образуется общая электронная пара, которая принадлежит каждому из атомов. Если сила атомов различная, их ЭО различная, то связь смещается в сторону более сильного атома, т.е. атома с большим значением ЭО. Такая связь называется полярной. КОВАЛЕНТНАЯ ПОЛЯРНАЯ СВЯЗЬ (КПС) - образуют атомы разных неметаллов, отличающихся по значениям электроотрицательности (Например: HCl, H2O). Механизм образования связи. Каждый атом неметалла отдает в общее пользование другому атому свои наружные не спаренные электроны. Образуются общие электронные пары. Общая электронная пара смещена к более электроотрицательному элементу. Рассмотрим механизм образования молекулы хлороводорода: НCl – кпс. Электронная схема образования молекулы НCl: 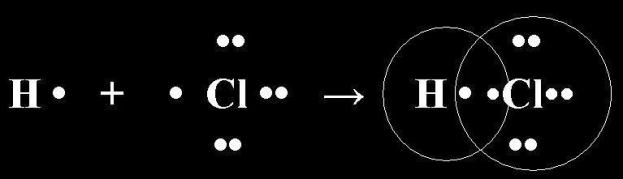
Общая электронная пара смещена к хлору, как более электроотрицательному. Значит это ковалентная связь. Она образована атомами, электроотрицательности которых несильно отличаются, поэтому это ковалентная полярная связь. Структурная формула молекулы НCl: σ Н → Cl , σ (s – p) - одинарная связь σ, смещение электронной плотности в сторону более электроотрицательного атома хлора (→) 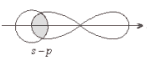
Составление электронных формул молекул йодоводорода и воды: электронная формула молекулы йодоводорода, •• H •• J •• •• структурная формула молекулы йодоводорода. H → J электронная формула молекулы воды, •• H •• O •• •• H структурная формула молекулы воды. Н →О ↑ Н По степени смещенности общих электронных пар к одному из связанных ими атомов ковалентная связь может быть полярной и неполярной. При этом особую актуальность приобретает такое понятие как электроотрицательность. Вещества с ковалентной связью характеризуются кристаллической решеткой 2-х типов (демонстрирую модели кристаллических решеток алмаза, графита, иода): атомной (алмаз, графит), молекулярная (хлор, иод и др.) | 

































