| Сообщение «Жизнь и деятельность М.Фарадея» ( «Чем больше у меня работы, тем больше я учусь» М.Фарадей)
Существует класс проводников, прохождение электрического тока в которых всегда сопровождается химическими изменениями и переносом вещества. Такими проводниками являются растворы многих солей, кислот и щелочей, а также расплавы солей и оксидов металлов. Жидкости, как и твердые тела, могут быть проводниками, полупроводниками и диэлектриками. Сегодня речь пойдет о жидкостях-проводниках. Причем не о жидкостях с электронной проводимостью (расплавленные металлы), а о жидкостях-проводниках второго рода (растворы и расплавы солей, кислот, оснований). Тип проводимости таких проводников – ионный. Проводники второго рода – такие проводники, в которых при протекании тока происходят химические процессы. Для лучшего понимания процесса проводимости тока в жидкостях, можно представить следующий опыт: В ванну с водой поместили два электрода, подключенные к источнику тока, в цепи в качестве индикатора тока можно взять лампочку. Если замкнуть такую цепь, лампа гореть не будет, что означает отсутствие тока, а это значит, что в цепи есть разрыв, и вода сама по себе ток не проводит. Но если в ванную поместить некоторое количество  – поваренной соли – и повторить замыкание, то лампочка загорится. Это значит, что в ванной между катодом и анодом начали двигаться свободные носители заряда, в данном случае ионы. – поваренной соли – и повторить замыкание, то лампочка загорится. Это значит, что в ванной между катодом и анодом начали двигаться свободные носители заряда, в данном случае ионы. 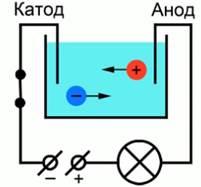 Схема опыта Проводимость электролитов Откуда во втором случае берутся свободные заряды? Как было сказано в одном из предыдущих уроков, некоторые диэлектрики – полярные. Вода имеет полярные молекулы. 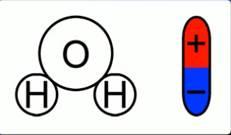 Полярность молекулы воды При внесении в воду соли молекулы воды ориентируются таким образом, что их отрицательные полюса находятся возле натрия, положительные – возле хлора. В результате взаимодействий между зарядами молекулы воды разрывают молекулы соли на пары разноименных ионов. Ион натрия имеет положительный заряд, ион хлора – отрицательный. Именно эти ионы и будут двигаться между электродами под действием электрического поля. 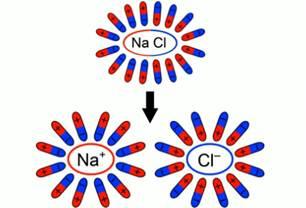 Схема образования свободных ионов При подходе ионов натрия к катоду он получает свои недостающие электроны, ионы хлора при достижении анода отдают свои. Так как протекание тока в жидкостях связано с переносом вещества, при таком токе имеет место процесс электролиза. Электролиз – процесс, связанный с окислительно-восстановительными реакциями, при которых на электродах выделяется вещество. Вещества, которые в результате подобных расщеплений обеспечивают ионную проводимость, называются электролитами. Такое название предложил английский физик Майкл Фарадей Электролиз позволяет получать из растворов вещества в достаточно чистом виде, поэтому его применяют для получения редких материалов, как натрий, кальций… в чистом виде. Этим занимается так называемая электролитическая металлургия. Законы Фарадея В первой работе по электролизу 1833 года Фарадей представил свои два закона электролиза. В первом речь шла о массе вещества, выделяющегося на электродах:  Первый закон Фарадея гласит, что эта масса пропорциональна заряду, прошедшему через электролит:  Здесь роль коэффициента пропорциональности играет величина  – электрохимический эквивалент. Это табличная величина, которая уникальна для каждого электролита и является его главной характеристикой. Размерность электрохимического эквивалента: – электрохимический эквивалент. Это табличная величина, которая уникальна для каждого электролита и является его главной характеристикой. Размерность электрохимического эквивалента:  Физический смысл электрохимического эквивалента – масса, выделившаяся на электроде при прохождении через электролит количества электричества в 1 Кл. Если вспомнить формулы из темы о постоянном токе:  То можно представить первый закон Фарадея в виде:  Второй закон Фарадея непосредственно касается измерения электрохимического эквивалента через другие константы для конкретно взятого электролита:  Здесь:  – молярная масса электролита; – молярная масса электролита;  – элементарный заряд; – элементарный заряд;  – валентность электролита; – валентность электролита;  – число Авогадро. – число Авогадро. Величина  называется химическим эквивалентом электролита. Исходя из второго закона Фарадея, первый закон можно представить в виде: называется химическим эквивалентом электролита. Исходя из второго закона Фарадея, первый закон можно представить в виде:  Фарадей предложил терминологию этих ионов по признаку того электрода, к которому они движутся. Положительные ионы называются катионами, потому что они движутся к отрицательно заряженному катоду, отрицательные заряды называются анионами как движущиеся к аноду. Вышеописанное действие воды по разрыву молекулы на два иона называется электролитической диссоциацией. Помимо растворов, проводниками второго рода могут быть и расплавы. В этом случае наличие свободных ионов достигается тем, что при высокой температуре начинаются очень активные молекулярные движения и колебания, в результате которых и происходит разрушение молекул на ионы. Практическое применение электролиза. Первое практическое применение электролиза произошло в 1838 году русским ученым Якоби. С помощью электролиза он получил оттиск фигур для Исаакиевского собора. Такое применение электролиза получило название гальванопластика. Другой сферой применения является гальваностегия – покрытие одного металла другим (хромирование, никелирование, золочение Также электролиз применяется в металлургии для выплавки редких металлов в чистом виде (алюминий, натрий, кальций, магний). Техническое применение электролиза. Электролиз нашёл различные применения в промышленности. Рассмотрим некоторые из них. 1. Нанесение защитных и декоративных покрытий на металлические изделия (гальваностегия). Для предохранения металлов от окисления, а также для придания изделиям прочности и улучшения внешнего вида их покрывают тонким слоем благородных металлов (золотом, серебром) или мало окисляющимися металлами (хромом, никелем). Предмет, подлежащий гальваническому покрытию, например ложку , погружают в качестве катода в электролитическую ванну. Электролитом является раствор соли металла, которым осуществляется покрытие. Анодом служит пластина из того же металла. Пропуская через электролитическую ванну в течение определённого промежутка времени электрический ток, ложку покрывают слоем металла нужной толщины. Для наиболее равномерного покрытия ложки её нужно поместить между двумя или более анодными пластинами. После покрытия ложку вынимают из ванны, сушат и полируют. 2. Производство металлических копий с рельефных моделей (гальванопластика).Для получения копий предметов (монет, медалей, барельефов и т. п.) де_ лают слепки из какого_нибудь пластичного материала (например, воска). Для придания слепку электропроводности его покрывают графитовой пылью, погружают в ванну в качестве катода и получают на нём слой металла нужной толщины. Затем путём нагревания удаляют воск. Процесс гальванопластики был разработан в 1836 г. русским академиком Б. С. Якоби (1801—1874). 3. Получение металлов из расплавленных руд и их очистка, электрохимическая обработка металлов. Процесс очистки металлов происходит в электролитической ванне. Анодом служит металл, подлежащий очистке, катодом — тонкая пластина из чистого металла, а электролитом — раствор соли данного металла. Например, пластину из неочищенной меди помещают в качестве анода в ванну с раствором медного купороса, где катодом служит лист чистой меди (рис. 143). В загрязнённых металлах могут содержаться ценные примеси. Так, в меди часто содержатся никель и серебро. При пропускании через ванну электрического тока медь с анода переходит в раствор, из раствора на катоде выделяется чистая медь, а примеси выпадают в виде осадка или переходят в раствор. | 

















