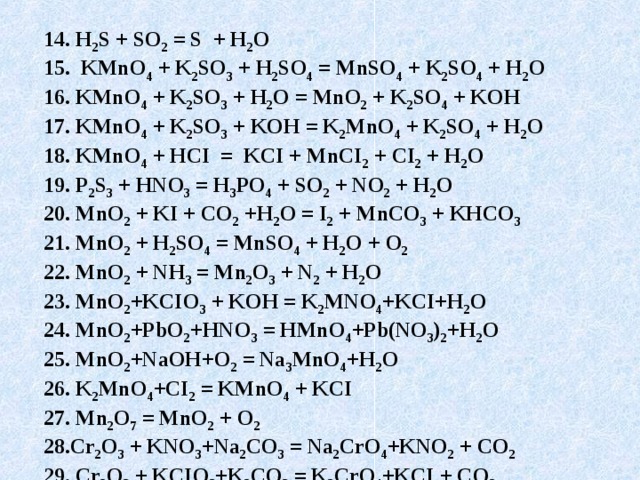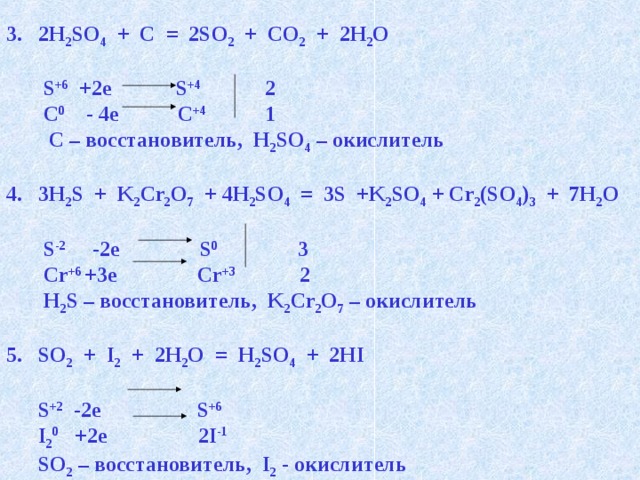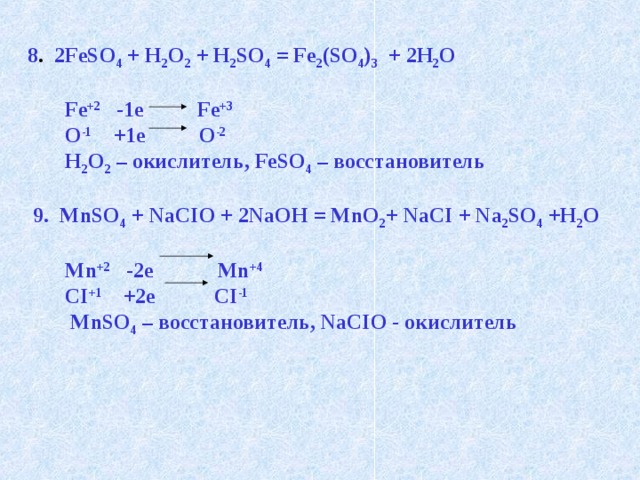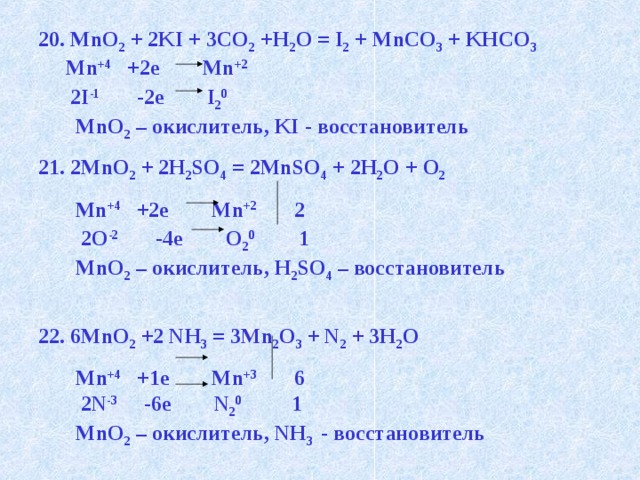ПОДГОТОВКА К ЕГЭ ПО ХИМИИ
БЛОК ЗАДАНИЙ № 36
Учитель химии МКОУ СОШ № 28
Пшукова З.Х
2015г.

Часть С в экзаменационной работе по химии начинается с задания С1, которое предполагает составление окислительно-восстановительной реакции (содержащей уже часть реагентов и продуктов). Оно сформулировано таким образом:
С1. Используя метод электронного баланса, составьте уравнение реакции. Определите окислитель и восстановитель.
Давайте разберёмся, как действовать при подготовке к решению заданий этого типа, на что обратить внимание.
ВВЕДЕНИЕ

Необходимые навыки
1.Расстановка степеней окисления. Необходимо помнить, что степень окисления — это гипотетический заряд атома (т.е. условный, мнимый), но он должен не выходить за рамки здравого смысла. Он может быть целым, дробным или равным нулю.
2.Расстановка степеней окисления в органических веществах. Помните, что нас интересуют степени окисления только тех атомов углерода, которые меняют своё окружение в процессе ОВР, при этом общий заряд атома углерода и его неуглеродного окружения принимается за 0.
3 .Не забывайте задавать себе главный вопрос: кто в этой реакции отдаёт электроны, а кто их принимает, и во что они переходят? Чтобы не получалось, что электроны прилетают из ниоткуда или улетают в никуда.

4. Составление электронного баланса сложнее, если формульная единица вещества содержит несколько атомов окислителя или восстановителя. В этом случае это необходимо учитывать в полуреакции, рассчитывая число электронов.
5 . Определите, в какой среде (кислой, нейтральной или щелочной) протекает реакция. Это можно сделать либо про продуктам восстановления марганца и хрома, либо по типу соединений, которые получились в правой части реакции: например, если в продуктах мы видим кислоту , кислотный оксид — значит, это точно не щелочная среда, а если выпадает гидроксид металла — точно не кислая. Ну и разумеется, если в левой части мы видим сульфаты металлов, а в правой — ничего похожего на соединения серы — видимо, реакция проводится в присутствии серной кислоты.

6 . Помните, что вода — вольный путешественник, она может как участвовать в реакции, так и образовываться .
7. Иногда какой-либо продукт реакции можно определить, только составив электронный баланс и поняв, каких частиц у нас больше.
8 . Во что переходят реагенты в реакции? Если ответ на этот вопрос не дают выученные нами схемы, то нужно проанализировать, какие в реакции окислитель и восстановитель — сильные или не очень? Если окислитель средней силы, вряд ли он может окислить, например, серу из −2 в +6, обычно окисление идёт только до S0. И наоборот, если KI — сильный восстановитель и может восстановить серу из +6 до −2, то KBr — только до +4.

9. Проверьте, чтобы в реакции был и окислитель, и восстановитель.
Если оба вещества могут проявлять свойства и восстановителя, и окислителя — надо продумать, какое из них более активный окислитель. Тогда второй будет восстановителем.
Если же один из реагентов — типичный окислитель или восстановитель — тогда второй будет «выполнять его волю», либо отдавая электроны окислителю, либо принимая у восстановителя.
Возможные ошибки
Расстановка степеней окисления: проверяйте каждое вещество внимательно. Часто ошибаются в следующих случаях:
а) степени окисления в водородных соединениях неметаллов: фосфин РН 3 — степень окисления у фосфора — отрицательная ; б) в органических веществах — проверьте ещё раз, всё ли окружение атома С учтено; в) аммиак и соли аммония — в них азот всегда имеет степень окисления −3; г) кислородные соли и кислоты хлора — в них хлор может иметь степень окисления +1, +3, +5, +7; д) пероксиды и надпероксиды — в них кислород не имеет степени окисления −2, бывает −1, а в КО 2 — даже −(½) е) двойные оксиды: Fe 3 O 4 , Pb 3 O 4 — в них металлы имеют две разные степени окисления, обычно только одна из них участвует в переносе электронов.
Выбор продуктов без учёта переноса электронов — то есть, например, в реакции есть только окислитель без восстановителя или наоборот.Неверные с химической точки зрения продукты: не может получиться такое вещество, которое вступает во взаимодействие со средой!
а) в кислой среде не может получиться оксид металла, основание, аммиак; б) в щелочной среде не получится кислота или кислотный оксид; в) оксид или тем более металл, бурно реагирующие с водой, не образуются в водном растворе.

ИСПОЛЬЗУЯ МЕТОД ЭЛЕКТРОННОГО БАЛАНСА,
СОСТАВТЕ УРАВНЕНИЯ РЕАКЦИЙ.
ОПРЕДЕЛИТЕ ОКИСЛИТЕЛЬ И ВОССТАНОВИТЕЛЬ
- H 2 SO 4 + Zn = H 2 S + ZnSO 4 + H 2 O
- Ca 3 (PO 4 ) 2 + AI = Ca 3 Р 2 + AI 2 O 3
- H 2 SO 4 + C = SO 2 + CO 2 + H 2 O
- H 2 S +K 2 Cr 2 O 7 + H 2 SO 4 =S +K 2 SO 4 + Cr 2 (SO 4 ) 3 + H 2 O
- SO 2 + I 2 + H 2 O = H 2 SO 4 + HI
- H 2 S + HNO 3 = H 2 SO 4 +NO 2 + H 2 O
- NO +K 2 Cr 2 O 7 +H 2 SO 4 = HNO 3 +Cr 2 (SO 4 ) 3 +K 2 SO 4 +H 2 O
8. FeSO 4 + H 2 O 2 + H 2 SO 4 = Fe 2 (SO 4 ) 3 + H 2 O
9. MnSO 4 +NaCIO +NaOH=MnO 2 + NaCI+ Na 2 SO 4 +H 2 O
10. KMnO 4 + HCI = KCI + MnCI 2 + CI 2 + H 2 O
11. KCIO 3 + P = KCI + P 2 O 5
12. KCIO 3 = KCI + O 2
13. KCIO 3 = KCI + KCIO 4
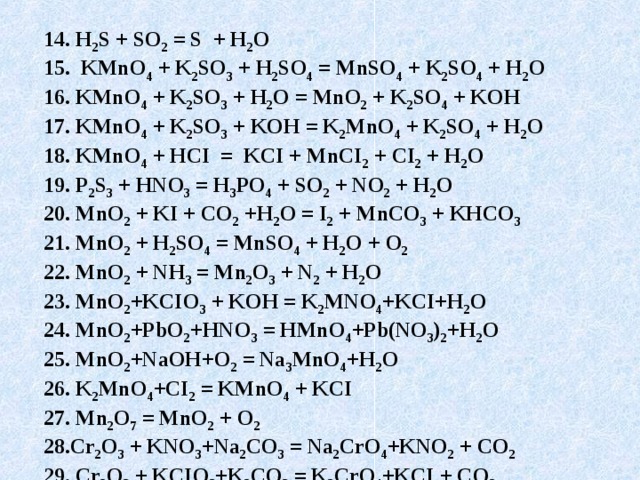
14. H 2 S + SO 2 = S + H 2 O
15. KMnO 4 + K 2 SO 3 + H 2 SO 4 = MnSO 4 + K 2 SO 4 + H 2 O
16. KMnO 4 + K 2 SO 3 + H 2 O = MnO 2 + K 2 SO 4 + KOH
17. KMnO 4 + K 2 SO 3 + KOH = K 2 MnO 4 + K 2 SO 4 + H 2 O
18. KMnO 4 + HCI = KCI + MnCI 2 + CI 2 + H 2 O
19. P 2 S 3 + HNO 3 = H 3 PO 4 + SO 2 + NO 2 + H 2 O
20. MnO 2 + KI + CO 2 +H 2 O = I 2 + MnCO 3 + KHCO 3
21. MnO 2 + H 2 SO 4 = MnSO 4 + H 2 O + O 2
22. MnO 2 + NH 3 = Mn 2 O 3 + N 2 + H 2 O
23. MnO 2 +KCIO 3 + KOH = K 2 MNO 4 +KCI+H 2 O
24. MnO 2 +PbO 2 +HNO 3 = HMnO 4 +Pb(NO 3 ) 2 +H 2 O
25. MnO 2 +NaOH+O 2 = Na 3 MnO 4 +H 2 O
26. K 2 MnO 4 +CI 2 = KMnO 4 + KCI
27. Mn 2 O 7 = MnO 2 + O 2
28.Cr 2 O 3 + KNO 3 +Na 2 CO 3 = Na 2 CrO 4 +KNO 2 + CO 2
29. Cr 2 O 3 + KCIO 3 +K 2 CO 3 = K 2 CrO 4 +KCI + CO 2
30. Cr 2 O 3 + H 2 S = Cr(OH) 3 + S

!!! ПРОВЕРЬ СЕБЯ !!!
Правильные решения

ИСПОЛЬЗУЯ МЕТОД ЭЛЕКТРОННОГО БАЛАНСА,
СОСТАВТЕ УРАВНЕНИЯ РЕАКЦИЙ.
ОПРЕДЕЛИТЕ ОКИСЛИТЕЛЬ И ВОССТАНОВИТЕЛЬ .
- 5H 2 SO 4 + 4 Zn = H 2 S + 4ZnSO 4 + 4H 2 O
Zn 0 – 2e Zn +2 4
S +6 + 8e S -2 1
Zn – восстановитель, H 2 SO 4 - окислитель
- 3Ca 3 (PO 4 ) 2 + 16AI = 3Ca 3 Р 2 + 8 AI 2 O 3
P +5 + 8e P -3 3
AI 0 - 3e AI +3 8
AI – восстановитель, Ca 3 (PO 4 ) 2 - окислитель
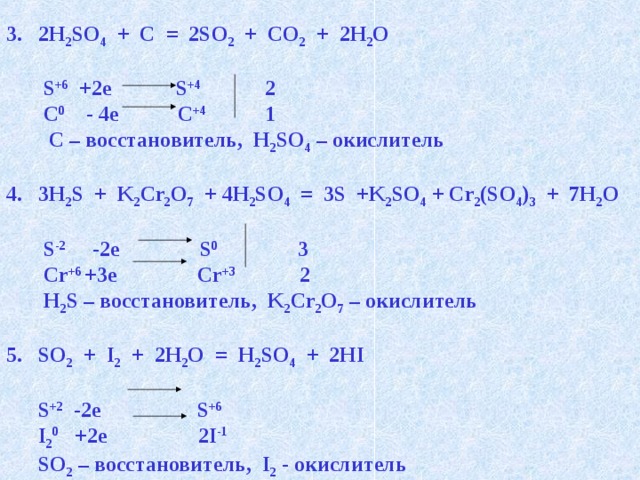
- 2H 2 SO 4 + C = 2SO 2 + CO 2 + 2H 2 O
S +6 +2e S +4 2
C 0 - 4e C +4 1
C – восстановитель, H 2 SO 4 – окислитель
- 3H 2 S + K 2 Cr 2 O 7 + 4H 2 SO 4 = 3S +K 2 SO 4 + Cr 2 (SO 4 ) 3 + 7H 2 O
S -2 -2e S 0 3
Cr +6 +3e Cr +3 2
H 2 S – восстановитель, K 2 Cr 2 O 7 – окислитель
- SO 2 + I 2 + 2H 2 O = H 2 SO 4 + 2HI
S +2 -2e S +6
I 2 0 +2e 2I -1
SO 2 – восстановитель, I 2 - окислитель

- H 2 S + 8HNO 3 = H 2 SO 4 +8NO 2 + 4H 2 O
S -2 – 8e S 0 1
N +5 +1e N +4 8
HNO 3 – окислитель, H 2 S – восстановитель
- 2NO + K 2 Cr 2 O 7 + 4H 2 SO 4 = 2HNO 3 +Cr 2 (SO 4 ) 3 +K 2 SO 4 +3H 2 O
N +2 -3e N +5
Cr +6 +3e Cr +3
K 2 Cr 2 O 7 – окислитель, NO – воостановитель
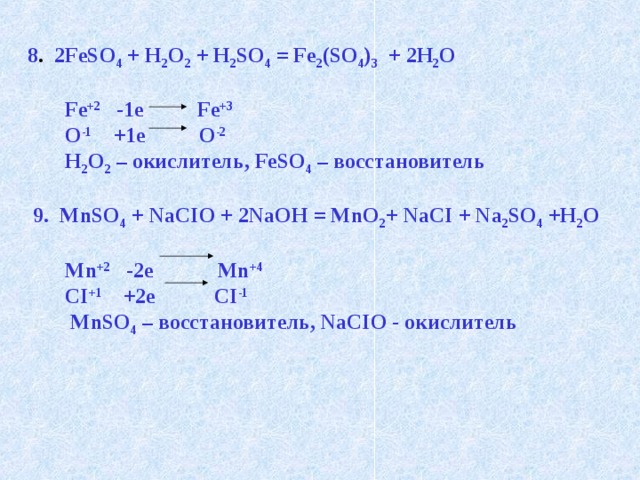
8 . 2FeSO 4 + H 2 O 2 + H 2 SO 4 = Fe 2 (SO 4 ) 3 + 2H 2 O
Fe +2 -1e Fe +3
O -1 +1e O -2
H 2 O 2 – окислитель, FeSO 4 – восстановитель
9. MnSO 4 + NaCIO + 2NaOH = MnO 2 + NaCI + Na 2 SO 4 +H 2 O
Mn +2 -2e Mn +4
CI +1 +2e CI -1
MnSO 4 – восстановитель, NaCIO - окислитель

10. 2KMnO 4 + 16HCI = 2KCI + 2MnCI 2 +5CI 2 + 8H 2 O
Mn +7 +5e Mn +2 2
2CI -1 -2e CI 2 5
KMnO 4 – окислитель, HCI- восстановитель
11. 2KMnO 4 + 6P = 5KCI + 3P 2 O 5
CI +5 +6e CI -1 5
P 0 -5e P +5 6
KMnO 4 – окислитель, P - восстановитель
12. 2KCIO 3 = 2KCI + 3O 2
CI +5 +6e CI -1 2
2O -2 -4e O 2 0 3
CI +5 - окислитель, O -2 - восстановитель

13. 4KCIO 3 = KCI + 3KCIO 4
CI +5 +6e CI -1 1
CI +5 -2e CI +7 3
KCIO 3 – и окислитель, и восстановитель
14. 2H 2 S + SO 2 =3 S + 2H 2 O
S -2 - 2e S 0 2
S +4 +4e S 0 1
H 2 S – восстановитель, SO 2 - окислитель
- 2KMnO 4 + 5K 2 SO 3 + 3H 2 SO 4 = 2MnSO 4 + 6K 2 SO 4 + 3H 2 O
Mn +7 +5e Mn +2 2
S +4 -2e S +6 5
KMnO 4 – окислитель, K 2 SO 3 - восстановитель

16. 2KMnO 4 + 3K 2 SO 3 + H 2 O =2 MnO 2 + 3K 2 SO 4 + 2KOH
Mn +7 +3e Mn +4 2
S +4 -2e S +6 3
KMnO 4 – окислитель, K 2 SO 3 – восстановитель
17. 2KMnO 4 + K 2 SO 3 + 2KOH = 2K 2 MnO 4 + K 2 SO 4 + H 2 O
Mn +7 +1e Mn +6 2
S +4 -2e S +6 1
KMnO 4 – окислитель, K 2 SO 3 – восстановитель

18. 2KMnO 4 + 16HCI = 2KCI +2MnCI 2 + 5CI 2 + 8H 2 O
Mn +7 +5e Mn +2 2
2CI -1 -2e CI 2 0 5
KMnO 4 – окислитель, HC – восстановитель
19 * . P 2 S 3 +22HNO 3 = 2H 3 PO 4 + 3SO 2 + 22NO 2 + H 2 O
2Р +3 -4е 2P +5 4
3S -2 -18e 3S +4 18
N +5 +1e N +4 1
P 2 S 3 - восстановитель, HNO 3 - окислитель
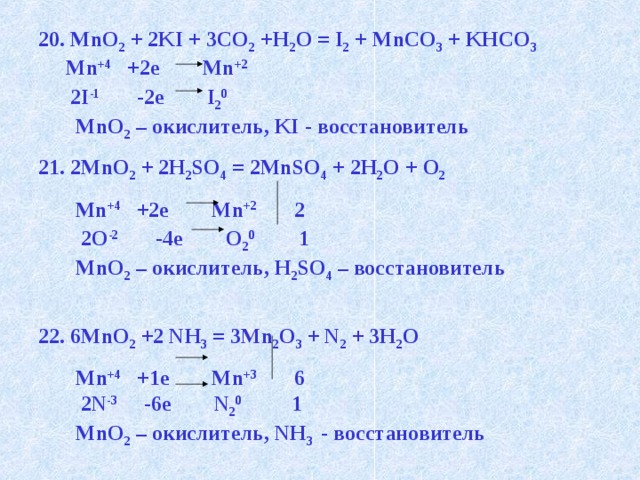
20. MnO 2 + 2KI + 3CO 2 +H 2 O = I 2 + MnCO 3 + KHCO 3
Mn +4 +2e Mn +2
2I -1 -2e I 2 0
MnO 2 – окислитель, KI - восстановитель
21. 2MnO 2 + 2H 2 SO 4 = 2MnSO 4 + 2H 2 O + O 2
Mn +4 +2e Mn +2 2
2O -2 -4e O 2 0 1
MnO 2 – окислитель, H 2 SO 4 – восстановитель
22. 6MnO 2 +2 NH 3 = 3Mn 2 O 3 + N 2 + 3H 2 O
Mn +4 +1e Mn +3 6
2N -3 -6e N 2 0 1
MnO 2 – окислитель, NH 3 - восстановитель

23. 3MnO 2 + KCIO 3 + 6KOH =3 K 2 MNO 4 + KCI+ 3H 2 O
Mn +4 -2e Mn +6 3
CI +5 +6e CI - 1
MnO 2 – восстановитель, KCIO 3 – окислитель
24. 2MnO 2 + 3PbO 2 + 6HNO 3 = 2HMnO 4 + 3Pb(NO 3 ) 2 + 2H 2 O
Mn +4 -3e Mn +7 2
Pb +4 +2e Pb +2 3
MnO 2 – восстановитель, PbO 2 – окислитель
25. 4MnO 2 + 12NaOH+ O 2 = 4Na 3 MnO 4 + 6H 2 O
Mn +4 -1e Mn +5 4
O 2 0 +4e O -2 1
MnO 2 – восстановитель, O 2 – окислитель

26. 2K 2 MnO 4 + CI 2 = 2KMnO 4 + 2KCI
Mn +6 -1e Mn +7 2
CI 2 0 +2e 2CI - 1
K 2 MnO 4 – восстановитель, CI 2 – окислитель
27. 2Mn 2 O 7 = 4MnO 2 + 3O 2
Mn +7 +3e Mn +4 4
2О -2 -4e О 2 0 3
Mn +7 – окислитель, О -2 - восстановтель

28. Cr 2 O 3 + 3KNO 3 + 2Na 2 CO 3 = 2Na 2 CrO 4 + 3KNO 2 + 2CO 2
Cr +3 -3e Cr +6 2
N +5 +2e N +3 3
Cr 2 O 3 – восстановитель, KNO 3 – окислитель
29. Cr 2 O 3 + KCIO 3 + 2K 2 CO 3 = 2K 2 CrO 4 + KCI + 2CO 2
Cr +3 -3e Cr +6 2
СI +5 +6e CI -1 1
Cr 2 O 3 – восстановитель, KCIO 3 – окислитель
30. 2CrO 3 + 3H 2 S = 2Cr(OH) 3 + 3S
Cr +6 +3e Cr +3 2
S -2 -2e S 0 3
Cr 2 O 3 – окислитель, H 2 S - восстановитель

Библиография
1.
2.
3.
http://ege.yandex.ru/chemistry/question/B1/3/
4.
http://chem.reshuege.ru/test?theme=44
http://ege-study.ru/ege-materials/chemistry/zadaniec1.html