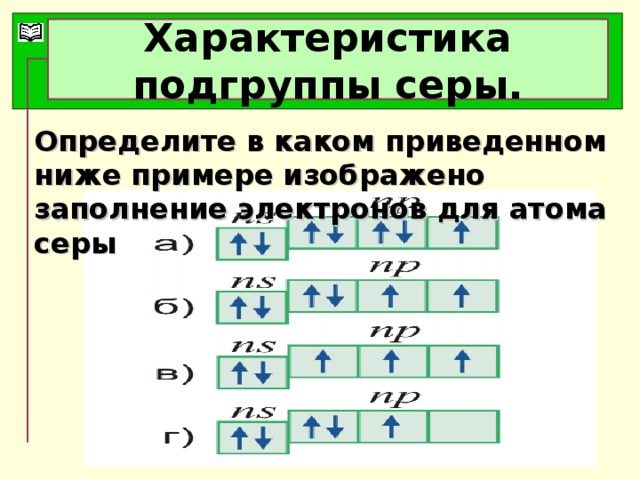
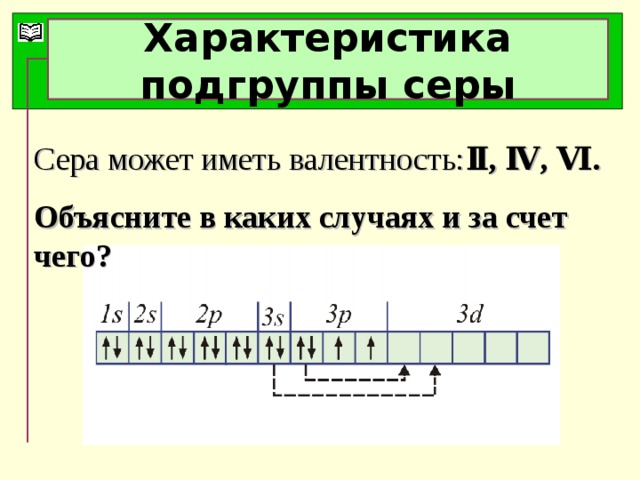
Серная кислота и её соли
Цель урока : углубить понятие о кислотах на
примере серной кислоты, продолжать учить
составлять уравнения химических реакций,
определять их тип, называть полученные
соединения.
Учить умению работать самостоятельно и в коллективе, выделять главное, сравнивать , делать выводы.
Знать : состав и свойства серной кислоты :
а) физические б) химические в) состава высших оксидов и соответствующих кислородсодержащих кислот,
УМЕТ Ь: Составлять уравнения реакций:
1. характеризующих химические свойства кислородсодержащих кислот, называть полученные вещества, определять классы соединений, тип связи.

План урока
Физические свойства серной кислоты
Структурная формула серной кислоты
Химические свойства серной кислоты
Получение серной кислоты
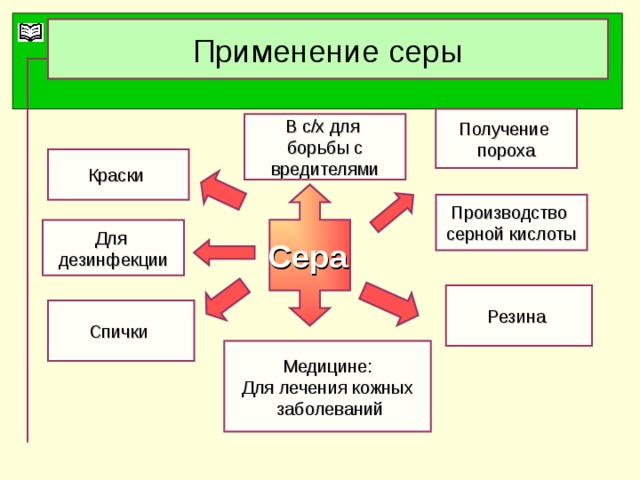
Применение серной кислоты

Физические свойства серной кислоты Структурная формула серной кислоты
- Серная кислота – бесцветная , маслянистая,
тяжелая жидкость. Обладает сильным
водоотнимающим свойством (гигроскопичностью)
Давайте вспомним технику безопасности при
работе с кислотами
при попадании кислоты на кожу
промыть под большим потоком
воды, нейтрализовать раствором
соды

NaOH
Cu(OH) 2
CuO
BaCl 2
Na 2 CO 3
Na 2 SiO 3
cu
Химические свойства серной кислоты
- Перечислите с какими классами соединений реагируют все кислоты:
- Составьте уравнения реакций по предложенной схеме:
Zn
H 2 SO 4

Качественная реакция на сульфат ионы

Взаимодействие серной кислоты с медью

Получение серной кислоты
- Стадия 4 FeS 2 +11O 2 → 2Fe 2 O 3 + 8SO 2
- Стадия 2SO 2 + O 2 →2S O 3
- Стадия S O 3 + H 2 O → H 2 SO 4
( показ анимации производства серной кислоты)
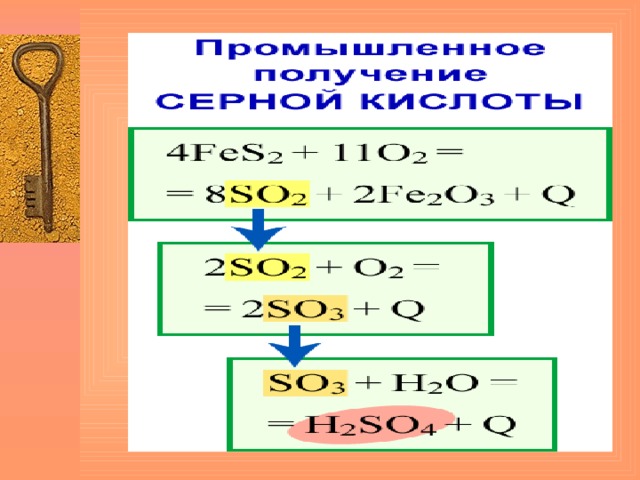

Производство серной кислоты

- Получение серной кислоты. Часть 1.swf
- Получение серной кислоты. Часть 2.swf
- Получение серной кислоты. Часть 3.swf
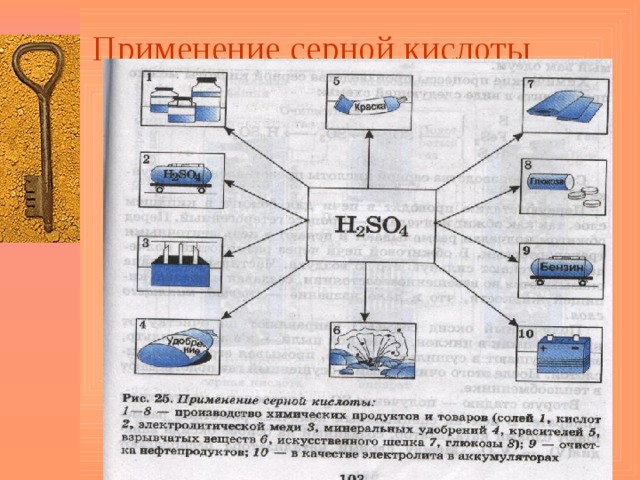
Применение серной кислоты