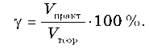Тема урока. Получение аммиака в лаборатории. Общая схема получения аммиака в промышленности
Цели урока: ознакомить учащихся с общими закономерностями производства аммиака; выяснить условия синтеза аммиака, при которых можно управлять химическим равновесием; развивать умение и навыки решать задачи с использованием понятия «выход продукта реакции»; показать значение расчетных задач в промышленной и лабораторной практике.
Тип урока: комбинированный урок усвоения знаний, умений и навыков и творческому применению их на практике.
Формы работы: учебная лекция, решение расчетных задач, работа с опорной схемой, демонстрационный эксперимент.
Оборудование: периодическая таблица химических элементов, схема производства аммиака
. Получение аммиака и растворение его в воде.
ХОД УРОКА
I. Организация класса
II. Проверка домашнего задания, актуализация опорных знаний
Фронтальное опрос
1. Как реагируют индикаторы на водный раствор аммиака? Обоснуйте свой ответ.
2. Докажите, какие свойства — кислотные или основные — характерные для водного раствора аммиака. Как это объяснить?
3. Предложите химические реакции для получения аммоний хлорида, имея водород, хлор и азот. Напишите уравнения реакций.
4. В пронумерованных пробирках выданы растворы сульфатной кислоты, натрий сульфата и аммоний сульфата. Предложите, как опытным путем можно распознать их. Составьте план ответа, напишите соответствующие уравнения реакций.
5. Расскажите, на какой свойства аммиака основана качественная реакция на ион аммония.
6. Вспомните, при каких условиях протекает химическая реакция получения аммиака, запишите уравнение реакции.
III. Изучение нового материала
Получение аммиака
Демонстрация 4. Получение аммиака и растворение его в воде
1. В лаборатории аммиак получают по схеме:
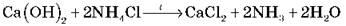
Как собрать аммиак? (Газ легче воздуха, следовательно, его можно собрать, вытесняя воздух из перевернутой пробирки)
Пробирку с амоніаком погружаем в воду вверх дном.
Почему поднимается столб воды? (Аммиак растворяется в воде)
Какую окраску приобретает в водном растворе аммиака фенолфталеин? лакмус? Почему?
Запишите уравнения диссоциации аммоний гидроксида:
NH4OH  NH4+ + OH-
NH4+ + OH-
2. В промышленности аммиак получают по схеме:
N2 + 3H2 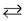 2NH3 + 92,4 кДж (t° = 450 °C, Р = 800 атм, kat)
2NH3 + 92,4 кДж (t° = 450 °C, Р = 800 атм, kat)
Демонстрация. Получения NH3 и растворение его в воде с фенолфталеином
Промышленный синтез аммиака (рассказ учителя)
Процесс синтеза аммиака осложняется тем, что при высоких температурах и давлении водород диффундирует сквозь обычные стали, а азот и аммиак реагируют с ними. Катализатор отравляется соединениями Серы, содержащихся в уходящих газах, кислородом, водяным паром и др.
Оптимальные условия проведения синтеза аммиака: t° 400 °С, kat — Fe, Г .
.
Из соображений экономии как катализатор выбирают железо, в которое для усиления активности и продления срока службы добавляют Al2O3 и K2O.
С увеличением давления усложняется конструкция аппаратов, но все равно 100%-го выхода аммиака получить не удается из-за обратимость реакции. Проблему решили другим путем: из газовой смеси в колонне синтеза с содержанием аммиака 10-20 % его отделяют, охлаждая смесь до комнатной температуры, при которой аммиак под давлением превращается в жидкость. Азот и водород направляют обратно в колонну синтеза, то есть используют рециркуляцию азотно-водородной смеси. Благодаря этому удается ограничиться сравнительно небольшим давлением — 30 МПа = 300 атм (на новейших установках — до 150 атм).
Реагенты: N2 — с воздуха, H2 — из природных горючих газов (СН4).
Колонна синтеза (рассматриваем схему производства аммиака) Двойной цилиндр, между стенками которого движется смесь N2 и H2. Смесь разогревается в трубковому теплообменнике за счет горячей смеси, что оставляет катализаторное коробку (то есть теплоты химической реакции). Столько теплоты, что туда часто помещают и трубы парового отопления для утилизации выделяемого тепла.
IV. Решение задач на вычисление массовой доли выхода продукта реакции от теоретически возможного
Масса вещества, рассчитанная на основании данных уравнению реакции, называется теоретическим выходом продукта mтеор.
Масса вещества, реально полученная в результате реакции, называется практическим выходом продукта mпракт.
Часть вещества в процессе реакции теряется, исходные вещества содержат примеси, вследствие химического равновесия взаимодействуют не полностью, поэтому всегда mпракт mтеор.
Следовательно, массовая доля выхода продукта реакции от теоретически возможного:
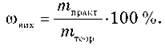
Для вычислений используется также понятие «мольная доля выхода продукта реакции:
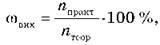
или для газообразных продуктов реакции объемная доля выхода продукта реакции:
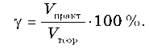
Рассмотрим применение этих формул на примерах.
Задача 1. В результате взаимодействия 55,5 г кальций гидроксида с аммоний хлоридом получили 15 г NH3. Вычислите мольну долю выхода аммиака от теоретически возможного.
• Составляем уравнение реакции:
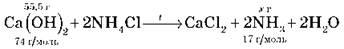
• Вычисляем количество вещества кальций гидроксида по данным задачи:
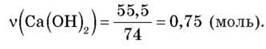
• Вычисляем теоретическую количество вещества аммиака по уравнению реакции:
νтеор = 0,75 · 2 = 1,5 (моль).
• Вычисляем практическую количество вещества по данным задачи:
vпра (NH3) = 15/17 = 0,88 (моль).
• По формуле вычисляем мольну долю выхода аммиака от теоретически возможного:
ωвих (NH3) = 0,88/1,5 · 100% = 59%.
Ответ: 59 %.
Задача 2. В процессе нагревания смеси 33 г аммоний сульфата с избытком кальций гидроксида получили аммиак объемом 9,5 л (н. в.). Вычислите объемную долю выхода аммиака от теоретически возможного.
Задача 3. Вычислите объем аммиака (н. в.), который можно получить, нагревая 75 г аммоний сульфата с избытком кальций гидроксида, если объемная доля выхода аммиака составляет 96 %.
V. Подведение итогов урока
VI. Домашнее задание
Проработать материал параграфа, ответить на вопросы к нему, выполнить упражнения.