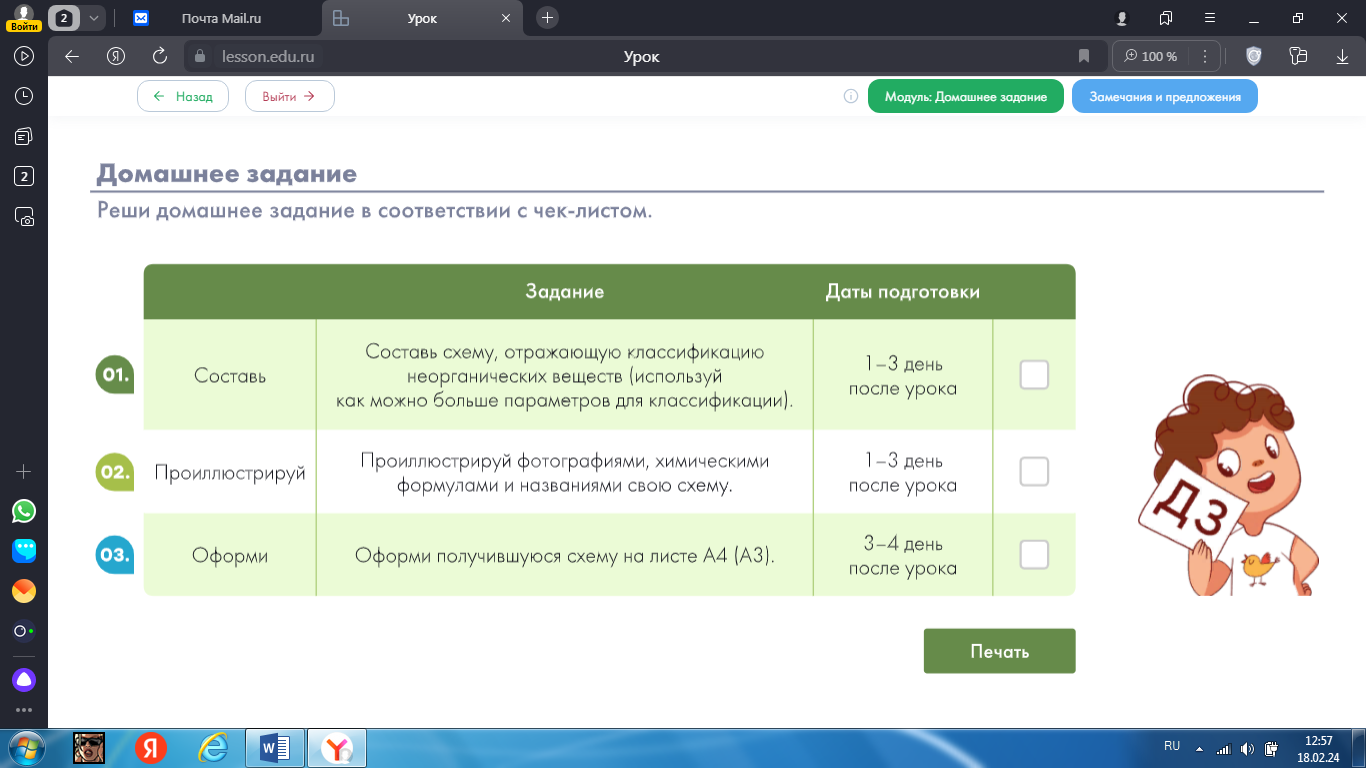
| Выполнение заданий диагностической работы позволит организовать подготовку к написанию сжатого изложения и повторить признаки текста (основная мысль текста, смысловая законченность, порядок следования предложений в тексте), закрепить умение составлять текст из разрозненных предложений, озаглавливать текст, выделять части текста.
Контрольная работа №3 1. 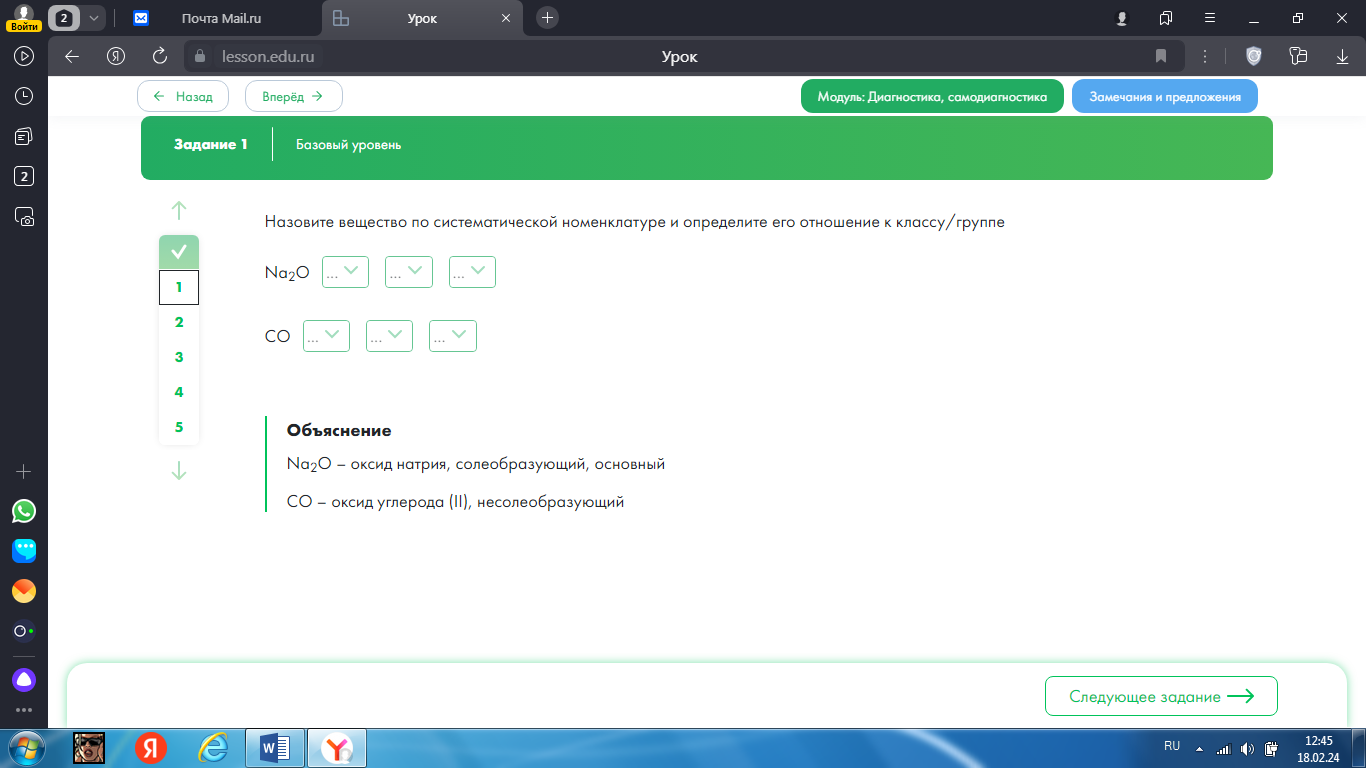
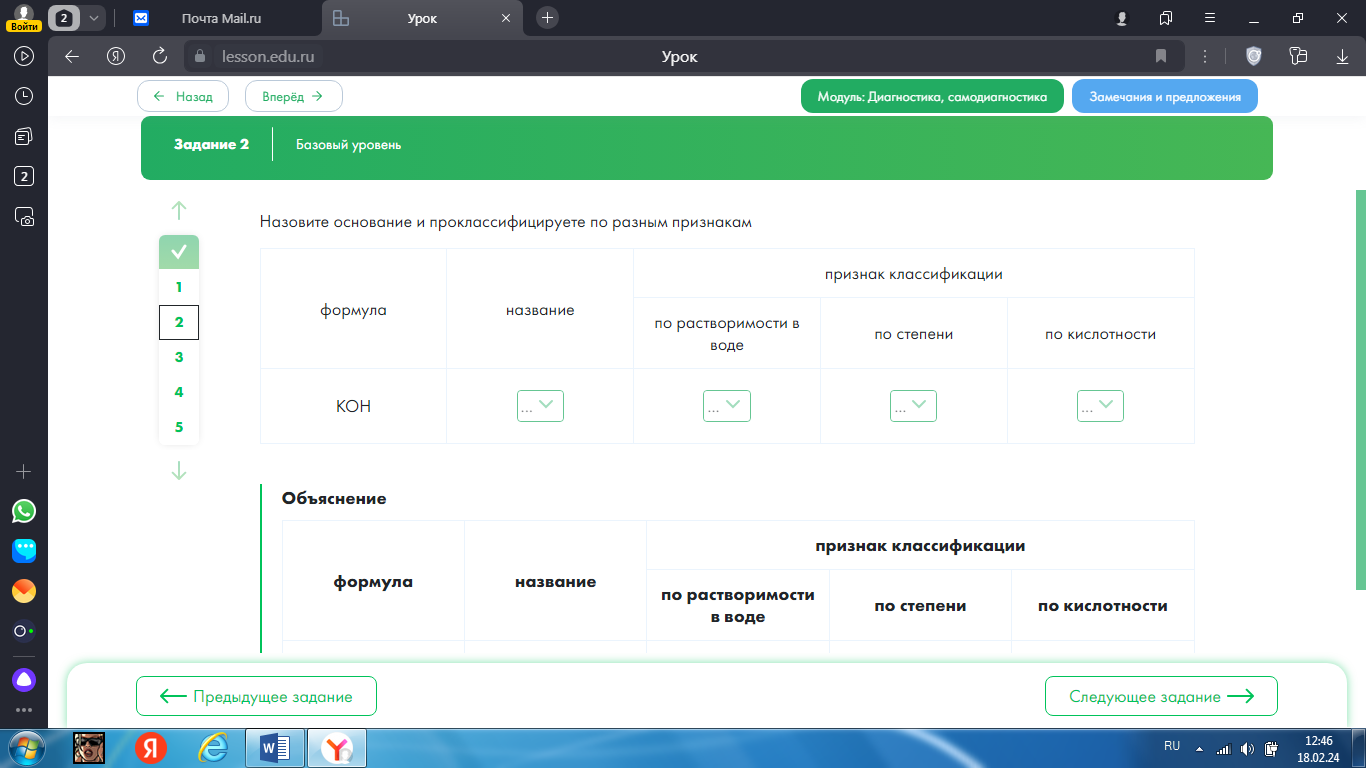
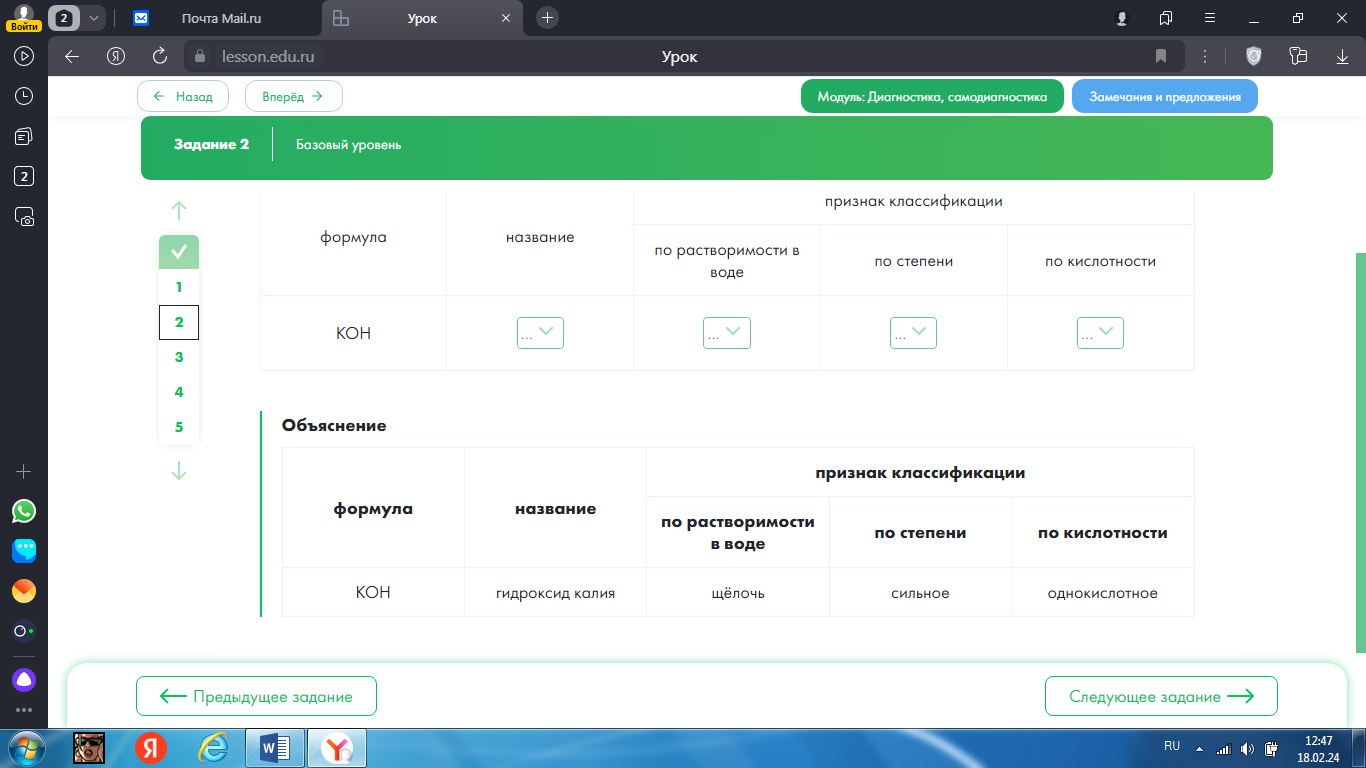
2. 
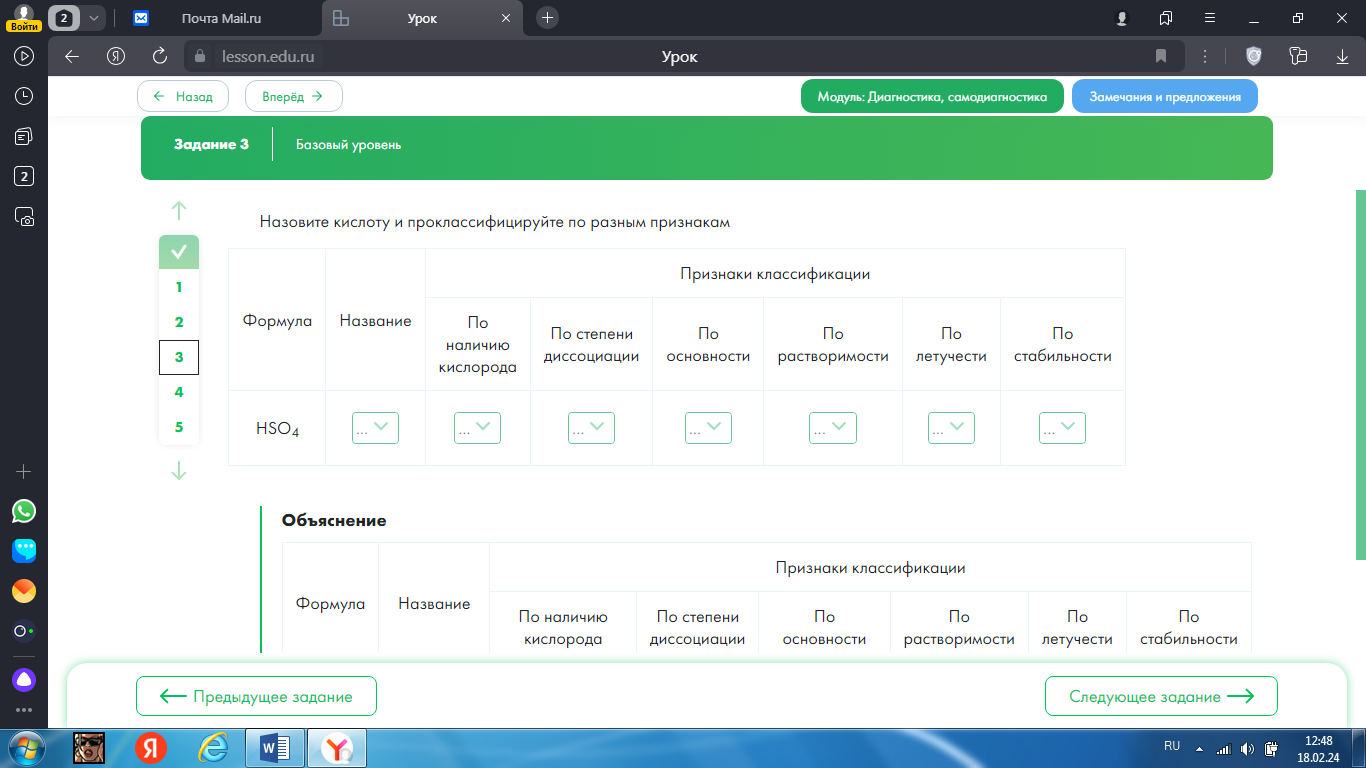
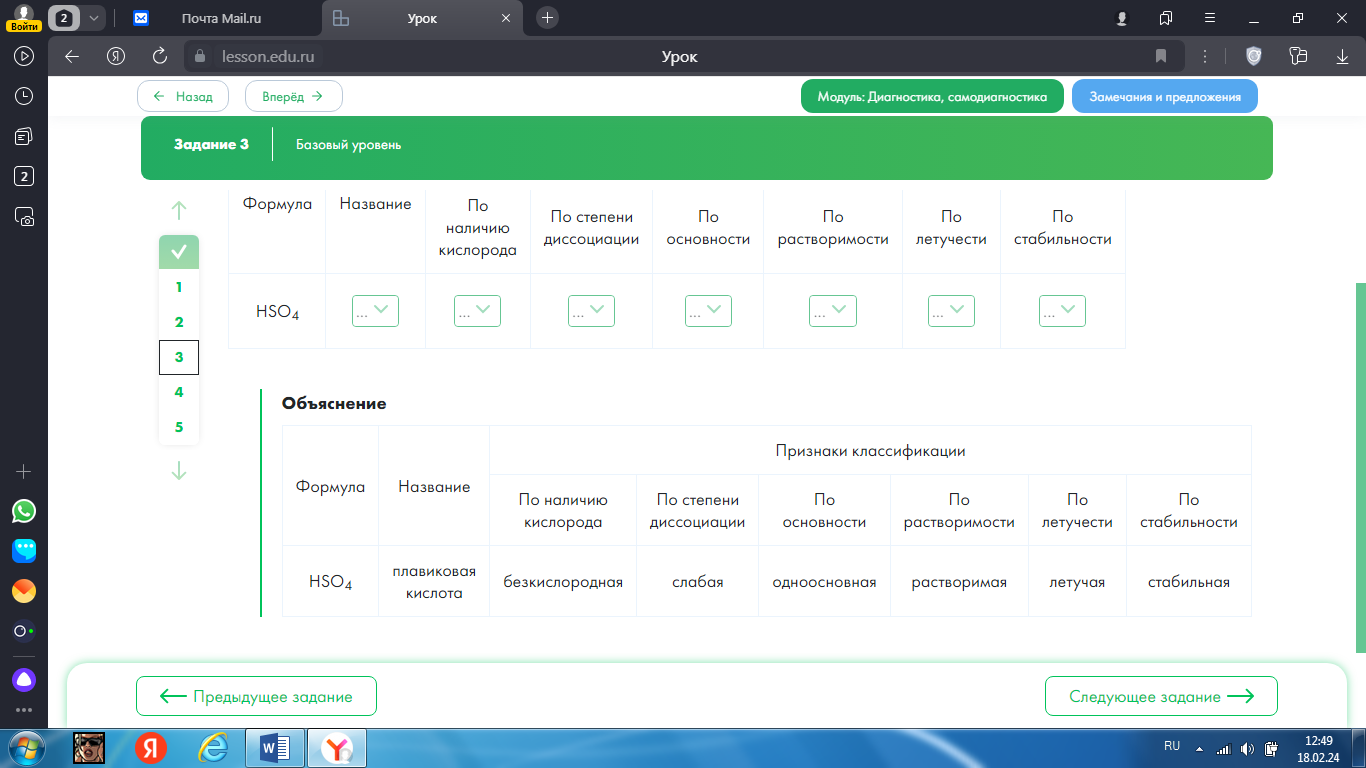
3. 
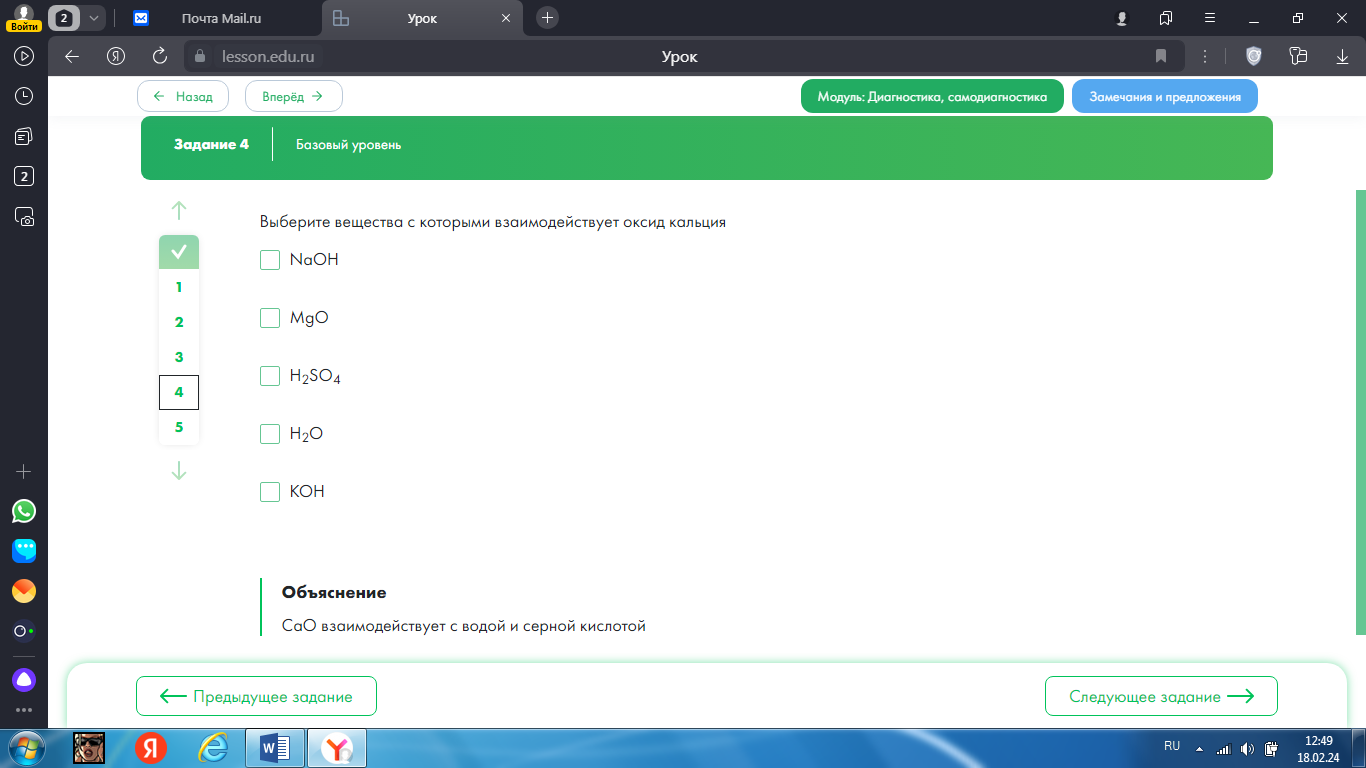
4. 
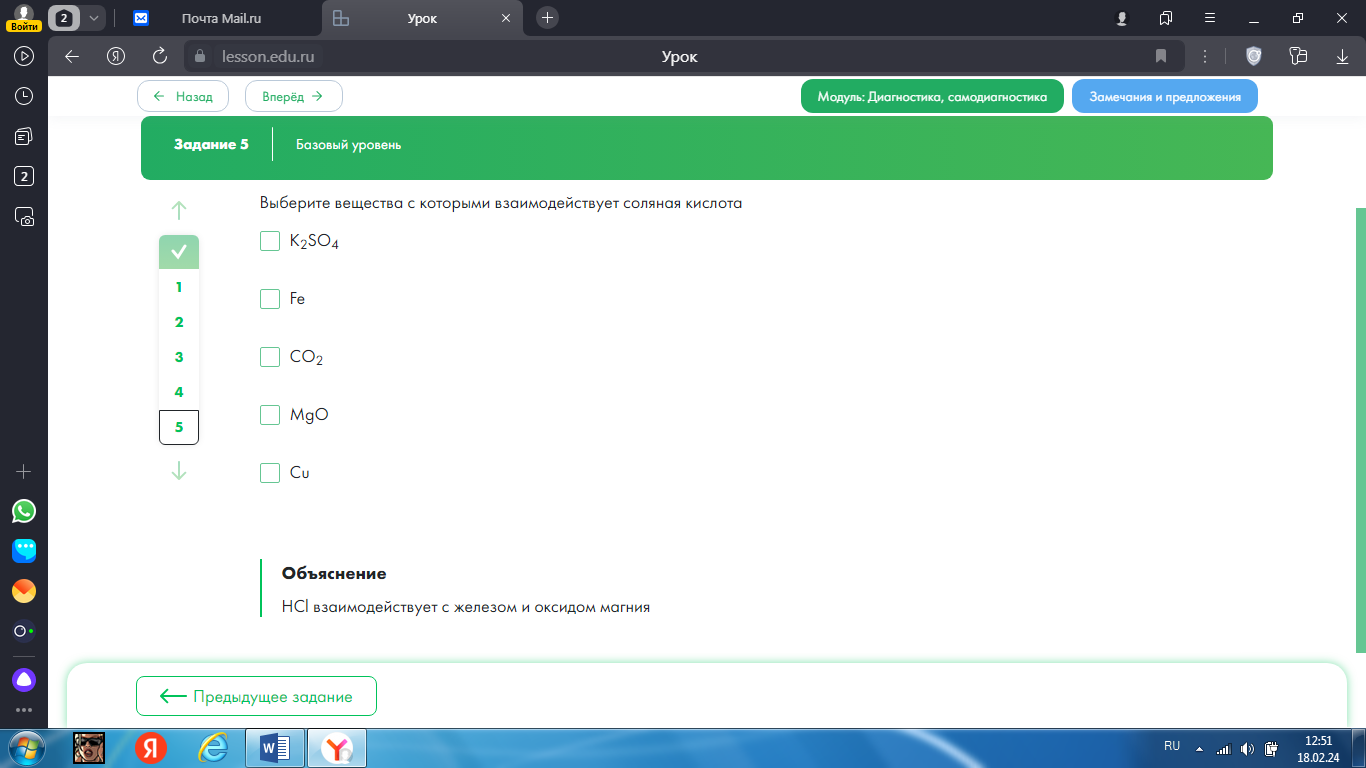
5. 
Вариант 1 1. Выберите формулу бескислородной кислоты: а) НCl; б) КH; в) H3PO4; г) NaOH. 2. Классифицируйте вещества по классам: СаO, NaOH, H2O, SO2, HCl, P2O5, Ca(OH)2, NaHSO4, хлорид натрия, оксид марганца, серная кислота. 3. Раствор Н3PO4 будет взаимодействовать с: а) NaCl; б) Ag; в) Ni; г) Cu. Напишите уравнения реакции. 4. Продукты взаимодействия соляной кислоты и оксида кальция: а) CаCl2+ H2↑; б) CаCl + H2↑; в) CаCl2+ H2O; г) они не заимодействуют. Напишите уравнения реакции. 5. Формула силиката железа(III): а) Na2SiO3 ; б) FeSO4; в) Fe2(SiO3) 3 ; г) FeSiO3 . 6. Какая из приведенных солей растворима: а) Zn3(PO4)2; б) Ag 2CO3; в) MgSiO3 ; г) Na2SiO3 7. Является реакцией нейтрализации: а) Zn + 2HCl = ZnCl2 + H2; в) CaO + H2O = Ca(OH2; б) 2KOH + H2SiO3 = K2SiO3+ 2H2O; г) 2Na + 2H2O = 2NaOH + H2. 8. Допишите возможные уравнения реакций, укажите их тип реакции: H2SO4 + Au = ... , Li + H2O = ... , Na2O + H2O = ... , Cu(OH) 2 + HNO3 = ... . 9. Решите цепочку превращений, назовите все вещества: Li--- Li2O--- LiOH --- Li3PO4. 10. Рассчитайте массу оксида фосфора (V), который образуется при взаимодействии фосфора массой 3,72г с кислородом. Вариант 2 1. Выберите формулу соли: а) НClО4; б) КОH; в) Na3PO4; г) HOH. 2. Классифицируйте вещества по классам: Al2O3, HCl, Fe(OH) 2, HNO3 , SO3, CaCl2, BaF2, силикат лития, сульфат меди, фосфорная кислота, гидрофосфат натрия. 3. Раствор КОН будет взаимодействовать с: а) NaOH; б) Ag; в) Н2О; г) CО2 Напишите уравнения реакции. 4. Продукты взаимодействия серной кислоты и гидроксида магния: а) MgSO4 + H2↑; б) Mg3 (PO4) 2+ H2; в) MgSO4 + H2O; г) они не взаимодействуют. Напишите уравнения реакции. 5. Формула фосфата меди(II): а) Сu2 (PO4) 3; б) Cu3 (PO4) 2; в) CuSiO3; г) Cu3P2. 6. Какая из приведенных солей растворима: а) Zn3 (PO4) 2; б) AgNO3;в) K2SiO33; г) NaCl. 7. Является реакцией нейтрализации: а) Fe + 2HCl = FeCl2 + H2; г) 2Na + 2H2O = 2NaOH + H2. б) K22O + H2SiO3 = K2SiO3 + H2O; в) Ca(OH) 2 + H2SO4 = CaSO4 + 2Н2О; 8. Допишите возможные уравнения реакций, укажите их тип: SO3 + H2O = ..., Na + H2O = ... , Li2O + H2O = ... , Ca(OH) 2 + HNO3 = ... . 9. Решите цепочку превращений назовите все вещества: K -- K2O -- KOH --- KNO3. 10. Определите массу углекислого газа, который образуется при взаимодействии 3 г углерода с кислородом?
Ответы Вариант 1 1. Выберите формулу бескислородной кислоты: 2. Классифицируйте вещества по классам: | Оксиды: | СаO, H2O, SO2, P2O5, Mn2O7 | | Кислоты: | HCl, H2SO4 | | Гидроксиды: | NaOH, Ca(OH)2, | | Соли: | NaHSO4, NaCl, | 3. Раствор Н3PO4 будет взаимодействовать с: 4. Продукты взаимодействия соляной кислоты и оксида кальция: | в) CаCl2+ H2O; | | 2HCl + СаO = CаCl2+ H2O | 5. Формула силиката железа(III): 6. Какая из приведенных солей растворима: 7. Является реакцией нейтрализации: б) 2KOH + H2SiO3 = K2SiO3 + 2H2O;
8. Допишите возможные уравнения реакций, укажите их тип реакции: H2SO4 + Au = не идет ,
Li + H2SO4 = Li2SO4 + H2↑, (замещение)
Na2O + H2O = 2NaOH , (соединения)
Cu(OH)2 + 2HNO3 = Cu(NO3)2 + 2H2O, (обмена) 9. Решите цепочку превращений, назовите все вещества: Li  Li2O Li2O  LiOH LiOH  Li3PO4. Li3PO4. 4Li + O2 = 2Li2O литий кислород оксид лития
Li2O + H2O = 2LiOH
оксид лития вода гидроксид лития 3LiOH + H3PO4 = Li3PO4 + 3H2O гидроксид лития фосфорная фосфат вода кислота лития 10. Рассчитайте массу оксида фосфора (V), который образуется при взаимодействии фосфора массой 3,72г с кислородом. | Дано: | Решение: | | m(P)= 3,72г.
| Уравнение реакции: 3,72 г Х г. 4P + 5О2 = 2P2O5 n 4 моль 2 моль M 31 г/моль 142 г/моль m 124 г 284 г Х=8,52 г. Ответ: m(P2O5)= 8,52 г. | | m(P2O5)= х г. | Ответы: Вариант 2 1. Выберите формулу соли: 2. Классифицируйте вещества по классам: | Оксиды: | Al2O3, SO3, | | Кислоты: | HCl, HNO3 , H3PO4 | | Гидроксиды: | Fe(OH)2, CuSO4 | | Соли: | CaCl2, BaF2, Li2SiO3, Na2HPO4 | 3. Раствор КОН будет взаимодействовать с: | г) CО2 | | CО2 + 2KOH = K2CO3 + H2O | 4. Продукты взаимодействия серной кислоты и гидроксида магния: | в) MgSO4 + H2O; | | H2SO4 + Mg(OH)2 = MgSO4 + 2H2O | 5. Формула фосфата меди(II): 6. Какая из приведенных солей растворима: 7. Является реакцией нейтрализации: в) Ca(OH)2 + H2SO4 = CaSO4 + 2Н2О;
8. Допишите возможные уравнения реакций, укажите их тип: SO3 + H2O = H2SO4 , (соединения)
Ca(OH)2 + H2O = не идет ,
Li2O + H2O = 2LiOH , (соединения)
Ca(OH)2 + HNO3 = Cа(NO3)2 + 2H2O, (обмена) 9. Решите цепочку превращений назовите все вещества: K 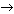 K2O K2O 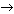 KOH KOH 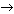 KNO3. KNO3. 4K + O2 = 2K2O калий кислород оксид калия
K2O + H2O = 2KOH
оксид лития вода гидроксид калия KOH + HNO3 = KNO3 + H2O гидроксид калия азотная нитрат вода кислота калия 10. Определите массу углекислого газа, который образуется при взаимодействии 3 г углерода с кислородом? | Дано: | Решение: | | m(С)= 3 г.
| Уравнение реакции: 3 г Х г. С + О2 = СO2 n 1 моль 1 моль M 12 г/моль 44 г/моль m 12 г 44 г Х=11 г. Ответ: m(СО2)= 11 г. | | m(СО2)= ?.
|
|