Дата:
Класс: 9
Учитель:
Предмет: Химия
Тема: «Общая характеристика галогенов. Химические свойства на примере хлора»
-
Контролируемые элементы содержания
-
Контролируемые умения
-
Овладение основами химической грамотности: способностью анализировать и объективно оценивать жизненные ситуации, связанные с химией, навыками безопасного обращения с веществами, используемыми в повседневной жизни;
-
умением анализировать и планировать экологически безопасное поведение в целях сохранения здоровья и окружающей среды.
-
Проверяемые элементы содержания
-
Общая характеристика галогенов.
-
Особенности строения атомов, характерные степени окисления. Строение и физические свойства галогенов
-
Химические свойства на примере хлора (взаимодействие с металлами, неметаллами, щелочами)
-
Предметные умения
-
Выстраивать развёрнутые письменные и устные ответы с опорой на информацию из учебника и справочных материалов, грамотно использовать изученный понятийный аппарат курса химии
-
Использовать знаки и символы для фиксации результатов наблюдений, составления формул веществ и уравнений химических реакций, записи данных условий задач.
-
Личностные результаты
-
Овладение языковой и читательской культурой как средством познания мира
-
Ориентация в деятельности на современную систему научных представлений об основных закономерностях развития человека, природы и общества, взаимосвязях человека с природной и социальной средой
-
Функциональная грамотность
-
Анализировать, интерпретировать данные и делать соответствующие выводы
-
Овладение языковой и читательской культурой как средством познания мира
Тип урока: Комбинированный урок
Библиотека ЦОК: https://m.edsoo.ru/00addfe2
Ход урока
-
Вхождение в тему урока и создание условий для осознанного восприятия нового материала
-
Мотивация на учебную деятельность

После получения правильного ответа обсудите с учащимися, что они знают про это вещество и химический элемент, что они хотели бы узнать о свойствах этого вещества; какие свойства они могут описать уже сейчас. Сообщите им о том, что бром является одним из представителей семейства галогенов — неметаллов VIIA (17) группы. Попросите их записать тему урока.
-
Целеполагание
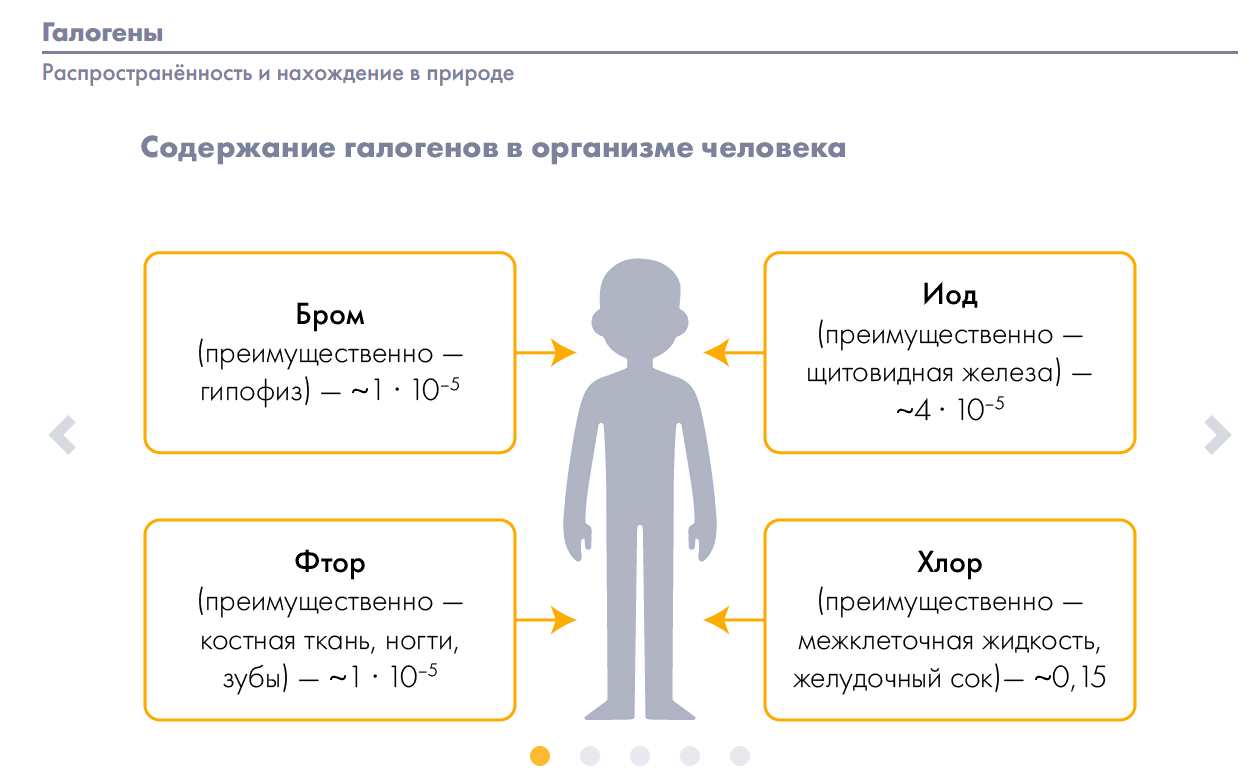
Опционально. Расскажите школьникам о биологической роли галогенов.
(Для учителя: Галогены убивают в организме бактерии, вирусы, грибки, попадающие в кровь. Участвуют в обмене веществ. Способствуют выводу из организма солей тяжелых металлов и радионуклидов и у каждого из галогенов есть индивидуальные свойства в организме, отображенные в буклете. Получают галогены двумя способами – промышленным (кроме йода) и лабораторным. В промышленности галогены получают путем электролиза водных растворов или расплавов.)
-
Освоение нового материала
-
Осуществление учебных действий по освоению нового материала
Галогены (от греч. «халос» - соль и «генес» - рождающий, рождённый) находятся в VIIA-группе периодической таблицы. Это элементы фтор, хлор, бром, иод и не имеющий стабильных изотопов радиоактивный астат.
На наружном энергетическом уровне атомов галогенов находится семь электронов. До восьми электронов (октета) на наружном энергетическом уровне, т. е. до устойчивого состояния атомов, характерного для благородных газов, атомам галогенов недостаёт одного электрона. К тому же атомы галогенов по сравнению с атомами металлов того же периода обладают большим зарядом ядра, меньшим атомным радиусом и имеют один неспаренный электрон. Поэтому атомы всех галогенов (особенно фтора и хлора) энергично присоединяют недостающий электрон.
Хлор — химический элемент с атомным номером 17. Принадлежит к 7-й группе периодической таблицы химических элементов, находится в третьем периоде таблицы. Обозначается символом Cl. Активный неметалл. Галоген. Молекула хлора состоит из двух атомов.
1772 году Дж Пристли впервые получил первое соединение с хлором — газообразный хлороводород.

Организуйте работу учащихся по составлению характеристики простого вещества хлора по плану: План характеристики вещества:
1. Химическая формула и строение молекулы хлора.
2. Физические свойства хлора.
3. Химические свойства хлора.
К физическим свойствам хлора относят:
-
Цвет — желто-зеленый.
-
Тяжелее воздуха.
-
Резкий сладковатый запах.
-
Температура кипения: -34 °С.
-
Температура плавления: -100 °С.
-
Плотность 3,214 г/л.
-
Устойчивые степени окисления -1, 0, +1, +3, (+4), +5, (+6), +7.
-
Хлор в состоянии газа легко сжимается.
К химическим свойствам относят:
1. Взаимодействие хлора с простыми веществами
1.1 Хлор реагирует почти со всеми металлами с образованием солей. Эти реакции являются окислительно-восстановительными. Так, например. хлор реагирует с натрием:
2Na + Cl2 = 2NaCl
При повышенной температуре хлор реагирует также с медью, железом и некоторыми другими металлами:
Cu + Cl2 = CuCl2
С некоторыми металлами хлор реагирует при обычной температуре. например с сурьмой:
2Sb + 3Cl2 = 2SbCl3
-
Хлор реагирует с водородом. Реакция c водородом начинается только при нагревании или освещении
При взаимодействии хлорf водородом образуется хлороводород НСl - газ с резким запахом, хорошо растворимый в воде. Водный раствор хлороводорода обладает кислотными свойствами. Его называют соляной кислотой.
-
Взаимодействие хлора со сложными веществами
-
Хлор реагирует с водой.
-
Хлор вытесняет из солей бром и йод
-
Проверка первичного усвоения

В качестве проверки первичного усвоения материала предложите учащимся выполнить задания тренажёра.

3. Задание
-
Применение изученного материала.
-
Применение знаний, в том числе в новых ситуациях
-
Проверка приобретенных знаний, умений и навыков
4.1 Диагностика/самодиагностика

-
Подведение итогов, домашнее задание
-
Рефлексия
-
Что узнали сегодня на уроке?
-
Чему научились ?
-
На каком этапе возникли затруднения?
-
Задаём непонятные вопросы по теме урока
-
Д
омашнее задание.


































