Дата:
Класс: 9
Учитель:
Предмет: Химия
Тема: «Железо»
Контролируемые элементы содержания
Получение и химические свойства оснований. Химические свойства амфотерных гидроксидов алюминия и железа(III).
Контролируемые умения
Объяснять причины многообразия веществ, зависимость их свойств от состава и строения, а также зависимость применения веществ от их свойств.
Проверяемые элементы содержания
Качественные реакции на катионы и анионы: хлорид-, бромид-, иодид-, сульфат-, карбонат-, силикат-, фосфат-анионы; гидроксид-ионы; катионы аммония, магния, кальция, алюминия, железа(2+) и (3+), меди(2+), цинка, присутствующие в водных растворахОксиды и гидроксиды(II) и (III): состав, свойства и получение.
Предметные умения
Характеризовать (описывать) общие химические свойства веществ различных классов, подтверждая это описание примерами молекулярных и ионных уравнений соответствующих химических реакций.Использовать естественно-научные методы познания, в том числе наблюдение, измерение, моделирование, эксперимент (реальный и мысленный).
Личностные результаты
Ориентация в деятельности на современную систему научных представлений об основных закономерностях развития человека, природы и общества, взаимосвязях человека с природной и социальной средой
Функциональная грамотность
Ориентация в деятельности на современную систему научных представлений об основных закономерностях развития человека, природы и общества, взаимосвязях человека с природной и социальной средой
Тип урока: Комбинированный урок
Библиотека ЦОК: https://m.edsoo.ru/00ae1d86
БЛОЧНО-МОДУЛЬНОЕ ОПИСАНИЕ УРОКА:
-
Вхождение в тему урока и создание условий для осознанного восприятия нового материала
-
Мотивация на учебную деятельность
-
Актуализация опорных знаний
Осуществите превращения:
-
Al - Al(OH)3 - AlCl3 - Al(OH)3 Na[Al(OH)4]
Ответ:
а) 2Al + 6H2O → 2Al(OH)3↓ + 3H2↑;
б) Al(OH)3↓ + 3HCl → AlCl3 + 3H2O;
в) AlCl3 + 3NaOH → Al(OH)3↓ + 3NaCl;
г) Al(OH)3↓ + NaOH → Na[Al(OH)4] .
-
Целеполагание
Характеристика по плану:
1.Положение железа в ПСХЭ (период, ряд, группа, подгруппа, порядковый номер)
2.Атомное строение (число электронов, протонов , нейтронов, относительная атомная масса)
3.Электронные слои, распределение электронов по слоям, электронная конфигурация,возможные валентности и степени окисления
4.Распространенность железа в природе, его роль
5.Физические свойства
-
Освоение нового материала
-
Осуществление учебных действий по освоению нового материала
-
Положение железа в периодической таблице химических элементов и строение его атома
Железо - это d- элемент VIII группы; порядковый номер – 26; атомная масса Ar(Fe) = 56; состав атома: 26-протонов; 30 – нейтронов; 26 – электронов.Схема строения атома: Электронная формула: 1s22s22p63s23p63d64s2, Металл средней активности, восстановитель:Fe0-2e-→Fe+2, окисляется восстановитель, Fe0-3e-→Fe+3, окисляется восстановитель. Основные степени окисления: +2, +3
-
Распространённость железа
Железо – один из самых распространенных элементов в природе. В земной коре его массовая доля составляет 5,1%, по этому показателю оно уступает только кислороду, кремнию и алюминию. Много железа находится и в небесных телах, что установлено по данным спектрального анализа. В образцах лунного грунта, которые доставила автоматическая станция “Луна”, обнаружено железо в неокисленном состоянии.Железные руды довольно широко распространены на Земле. Названия гор на Урале говорят сами за себя: Высокая, Магнитная, Железная. Агрохимики в почвах находят соединения железа.Железо входит в состав большинства горных пород. Для получения железа используют железные руды с содержанием железа 30-70% и более.
Основными железными рудами являются: магнетит (магнитный железняк) – Fe3O4 содержит 72% железа, месторождения встречаются на Южном Урале, Курской магнитной аномалии. Гематит (железный блеск, кровавик)– Fe2O3 содержит до 65% железа, такие месторождения встречаются в Криворожском районе. Лимонит (бурый железняк) – Fe2O3*nH2O содержит до 60% железа, месторождения встречаются в Крыму:Пирит (серный колчедан, железный колчедан, кошачье золото) – FeS2 содержит примерно 47% железа, месторождения встречаются на Урале.
-
Роль железа в жизни человека и растений
Биохимики открыли важную роль железа в жизни растений, животных и человека. Входя в состав чрезвычайно сложно построенного органического соединения, называемого гемоглобином, железо обусловливает красную окраску этого вещества, от которого в свою очередь, зависит цвет крови человека и животных. В организме взрослого человека содержится 3 г чистого железа, 75% которого входит в состав гемоглобина. Основная роль гемоглобина – перенос кислорода из легких к тканям, а в обратном направлении – CO2. Железо необходимо и растениям. Оно входит в состав цитоплазмы, участвует в процессе фотосинтеза. Растения, выращенные на субстрате, не содержащем железа, имеют белые листья. Маленькая добавка железа к субстрату – и они приобретают зеленый цвет. Больше того, стоит белый лист смазать раствором соли, содержащей железо, и вскоре смазанное место зеленеет. Так от одной и той же причины – наличия железа в соках и тканях – весело зеленеют листья растений и ярко румянятся щеки человека.
-
Физические свойства железа.
Железо – это серебристо-белый металл с температурой плавления 1539оС. Очень пластичный, поэтому легко обрабатывается, куется, прокатывается, штампуется. Железо обладает способностью намагничиваться и размагничиваться, поэтому применяется в качестве сердечников электромагнитов в различных электрических машинах и аппаратах. Ему можно придать большую прочность и твердость методами термического и механического воздействия, например, с помощью закалки и прокатки.Различают химически чистое и технически чистое железо. Технически чистое железо, по сути, представляет собой низкоуглеродистую сталь, оно содержит 0,02 -0,04% углерода, а кислорода, серы, азота и фосфора – еще меньше. Химически чистое железо содержит менее 0,01% примесей. Химически чистое железо – серебристо-серый, блестящий, по внешнему виду очень похожий на платину металл. Химически чистое железо устойчиво к коррозии и хорошо сопротивляется действию кислот. Однако ничтожные доли примесей лишают его этих драгоценный свойств.
2
.2. Проверка первичного усвоения

-
Применение изученного материала.
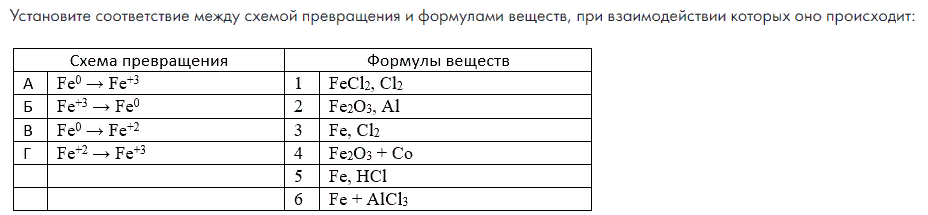

-
Выполнение заданий в форме ГИА (ОГЭ, ЕГЭ)
Осадок, полученный при взаимодействии хлорида железа (III) и нитрата серебра отфильтровали. Фильтрат обработали раствором едкого кали. Выпавший осадок бурого цвета отделили и прокалили. Полученное вещество при нагревании реагирует с алюминием с выделением тепла и света. Напишите уравнения описанных реакций.
FeCl3 + 3AgNO3 = 3AgCl↓ + Fe(NO3)3
Fe(NO3)3 + 3KOH = Fe(OH)3↓ + 3KNO3
2Fe(OH)3 → Fe2O3 + 3H2O
Fe2O3 + 2Al → 2Fe + Al2O3
-
Систематизация знаний и умений
Задание:
Изобразите электронную формулу нейтрального атома железа, а также покажите распределение электронов по орбиталям.
Решение:
Электронная формула атома железа в порядке возрастания энергий орбиталей:
1s2 2s2 2p6 3s2 3p6 4s2 3d6
-
Проверка приобретенных знаний, умений и навыков
4.1 Диагностика/самодиагностика
-
Охарактеризовать положение железа в периодической системе химических элементов
-
Какую роль играет железо в жизни человека и растений?
-
Какими физическими свойствами обладает железо?
-
Подведение итогов, домашнее задание
-
Рефлексия
Итак, ребята, что сегодня мы с вами узнали на уроке. Ну и как мы ответим на наш вопрос: Продолжается ли век железа?
Железо - основа всей металлургии, машиностроения, железнодорожного транспорта, судостроения, грандиозных инженерных сооружений - от башни Эйфеля до ажура железнодорожных мостов. Все, все - начиная от швейной иглы, гвоздя, топора и кончая паутиной железных дорог, плавающими крепостями - авианосцами и линкорами - и огнедышащими домнами, где рождается само железо, - состоит из железа. Железо - это металл созидания!
Обращаясь к эпиграфу нашего урока, хотелось бы вам пожелать следующее: пусть ваш мозг истирается от работы мысли, а не пожирается ржавчиной от лени.
-
Домашнее задание.
Осуществите ряд превращений:
а) железо → хлорид железа(II) → гидроксид железа (II) → оксид железа (II);






























