Урок № _____ (№____) Дата __________ Класс _10__
в календарном плане в изучаемой теме
Тема урока : Классификация химических реакций
Цель урока : обобщить знания учащихся о различных способах классификации химических реакций – по составу реагирующих и образующихся веществ, по изменению степени окисления атомов элементов, по использованию катализатора, по направлению, по тепловому эффекту и фазовому состоянию.
Задачи:
образовательная : опираясь на ранее полученные знания учащихся, подвести их к пониманию различных типов химических реакций; привести в систему накопленные знания; акцентировать внимание учащихся на связь курса химии и биологии;
развивающая совершенствовать умения наблюдать, анализировать, делать выводы, умения слушать и слышать другого человека
воспитательная Продолжить формирование воспитания личностных качеств, обеспечивающих успешность творческой деятельности: увлеченности, познавательного интереса, активности, целеустремленности, силы воли, настойчивости, активности, наблюдательности, интуиции, способности к самооценке, оценке хода и результата деятельности.
Тип урока Урок изучение нового
Методы словесные (беседа), практические (упражнения)
Технологии ТО
Формы индивидуальная, фронтальная
Мониторинг
Оборудование мел, доска
Методическое обеспечение
Ход урока
Организационный момент
Мы окунемся в мир реакций
Которых много, много,
Здесь и там. Ты посмотри в окно,
Ведь скоро в бурном темпе
Природа их подарит нам
Реакции идут в животном и в растении-
Ты не забудь - они идут и в нас,
Ведь человек природы рук творенье
Он много их еще создаст
Девиз урока: В природе постоянно идут превращения веществ, которые выражают с помощью химических реакций.
Тема урока: "Классификация химических реакций (ученики записывают тему в тетрадь)"
II.Изучение нового материала
Напомним, что все вещества проявляют определённые свойства: физические и химические. Химические свойства данного вещества проявляются в разнообразии химических реакций, в которые оно вступает. Цель нашего урока сегодня рассмотреть различный способы классификации химических реакций
? Что такое химическая реакция?
Химическая реакция- превращение вещества, сопровождающееся изменением его состава и (или) строения.
Реагенты- вещества, вступающие в химическую реакцию.
Продукты- вещества, образующиеся в результате химической реакции.
Реагенты → Продукты
Химические реакции принято записывать в виде уравнений или схем.
Уравнение ХР- условная запись химической реакции посредством химических формул (или формульных единиц) реагентов и продуктов, с учётом закона сохранения массы.
В отличие от уравнения ХР, в схеме реакции не учитываются стехиометрические коэффициенты.
ХР весьма разнообразны, вследствие этого возникает необходимость в их классификации.
Классификационные признаки:
число и состав исходных веществ и продуктов реакции;
агрегатное состояние реагентов и продуктов реакции;
число фаз, в которых находятся участники реакции;
обратимость реакции;
тепловой эффект;
по изменению степеней окисления атомов.
По числу и составу исходных и образующихся веществ:
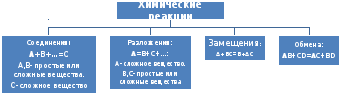
Реакции соединения- реакции, в которых из двух или нескольких простых или сложных веществ образуется одно сложное. S + O2 = SO2
CaO + H2O = Ca(OH)2
Реакции разложения- реакции, в которых из одного сложного вещества образуются два или более простых или сложных веществ. CaCO3 = CaO + CO2↑
2KMnO4 = K2MnO4 + MnO2 + O2↑
Реакции замещения- реакции, между простым и сложным веществом, при которых атомы простого вещества замещают атомы одного из элементов в сложном.
CuO + H2 = Cu + H2O
Fe + CuSO4 = Cu + FeSO4
Реакции обмена- реакции, протекающие между двумя сложными веществами, при которых эти два вещества обмениваются составными частями.
CuCl2 +2NaOH = Cu(OH)2↓ + 2NaCl
По агрегатному состоянию реагентов и продуктов:

По числу участвующих фаз:

? Какие реакции называют гетерогенными? (Реакции, в которых реагирующие вещества и продукты реакции находятся в разных агрегатных состояниях).
? Какие реакции называют гомогенными? (Реакции, в которых реагирующие вещества и продукты реакции находятся в одном агрегатном состоянии).
Примеры:
H2 +Cl2 = 2HCl (гомогенная, протекающая в газовой фазе)
NaOH(aq) + HCl(aq)=NaCl(aq) + H2O(ж) (гомогенная, протекающая в жидкой фазе)
CO2 + Ca(OH)2 = CaCO3↓ + H2O (гетерогенная, протекающая на границе раздела трёх фаз: газообразной, жидкой и твёрдой)
По признаку обратимости:

Необратимые реакции- реакции, продукты которых не способны реагировать друг с другом с образованием исходных веществ.
NaCl + AgNO3 → NaNO3 + AgCl↓
Обратимые реакции- реакции, продукты (продукт) которых способны (способен) превращаться в исходные вещества (вещество).
N2 + 3H2  2NH3
2NH3
Какая из трёх химических реакций необратима: 1) Ti+6HCl=2TiCl3+3H2; 2) 2Ti+3H2SO4=Ti2(SO4)2+3H2; 3) Ti+2TiCl3=3TiCl2?
По тепловому эффекту:
? Как называются уравнения, в которых приводятся тепловые эффекты реакций? (Термохимические).

Переходы льда к жидкой воде и водяному пару сопровождаются тепловыми эффектами Q1 и Q2. Каковы знаки этих эффектов? (Q1 0; Q2
По изменению степени окисления атомов:
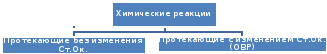
? Что называется окислением? (Процесс отдачи электронов атомом, молекулой, ионом).
? Что называется восстановлением? (Процесс присоединения электронов атомом, молекулой, ионом).
S0+H20=H2+S-2
S0 +2e=S-2 (окислитель)
Н20+2е = 2Н+(востановитель)
Классификация по использованию катализатора.
Реакции протекающие в присутствии катализатора называются --- каталитическими, без катализатора не каталитическими.
? Как называются катализаторы химических реакций, протекающих в организме человека? (Ферменты).
? Назовите виды катализа. (Гомогенный и гетерогенный).
?Как называются вещества замедляющие скорость химич реакции? (Ингибиторы).
III. Закрепление.
Дать характеристику каждой из трёх химических реакций с точки зрения различных классификаций по плану: число и состав веществ и продуктов реакции; изменение степени окисления элементов; обратимость процесса; участие катализатора; тепловой эффект; наличие поверхности раздела фаз.
Fe(т)+CuSO4(р)=FeSO4(р)+Cu(т)
IV. Д/з конспект §1.4 стр.20 № 12
Н2S(р) +Zn(т)=ZnS(р) +H2 (г)
SO2(г)+ 2C(т) = 2CO(г)+S(т)










 2NH3
2NH3



















