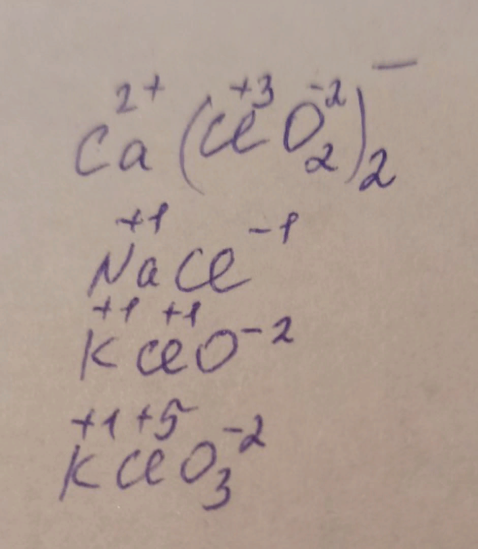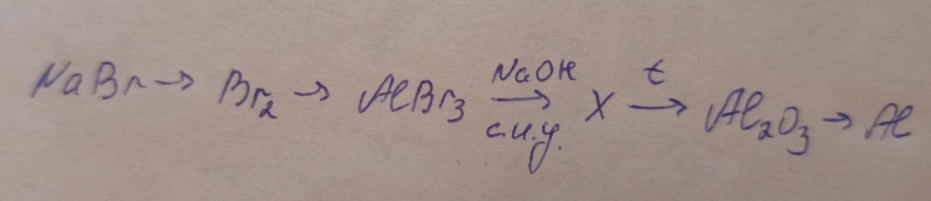Тема: «Повторение по теме Галогены»
Цели:
1.образовательные: способствовать формированию знаний о качественных реакциях на галогенид-ионы; способствовать закреплению ранее полученных знаний о строении атома галогенов, изменении их свойств с ростом заряда ядра, степенях окисления галогенов в соединениях, химических свойств и способов получения, умения составлять уравнения окислительно-восстановительных реакций.
2. развивающие: создавать условия для формирования навыков строить рассуждения, обобщать и делать выводы.
3.воспитательные: создавать условия для формирования навыков устной и письменной речи, способствовать развитию навыков коммуникативного общения учащихся.
Методы обучения: словесные (беседа); иллюстративные.
Тип урока: закрепления знаний.
I.Организационный момент
Здравствуйте, ребята, присаживайтесь. Давайте отметим отсутствующих.
II. Постановка цели и задач урока
- Сегодня мы будем заниматься закреплением материала по теме «Галогены» и готовиться к контрольной работе, которая будет на следующем уроке.
Открываем тетрадь, записываем число и тему урока «Повторение по теме Галогены»
III. Этап усвоения новых знаний
Качественные реакции на галогенид-ионы
-Итак, в первую очередь давайте рассмотрим качественные реакции на галогенид ионы.
-Какие продукты реакции получатся? (AgCl, NaNO3)
-Они растворимы в воде или нет? (NaNO3- да, AgCl – нет), значит какой признак реакции мы увидим? (выпадение осадка)
Записывают:
NaCl+AgNO3 → AgCl↓(осадок белого цвета) + NaNO3
Na++Cl- +Ag+ +NO3- → AgCl ↓+Na++NO3-
Cl- +Ag+→ AgCl↓
-Какие продукты реакции получатся? (AgBr, NaNO3)
-Они растворимы в воде или нет? (NaNO3- да, AgBr – нет), значит какой признак реакции мы увидим? (выпадение осадка)
Записывают:
NaBr+AgNO3 → AgBr↓ (осадок светло-желтого цвета) + NaNO3
Na++Br- +Ag+ +NO3- → AgBr↓+Na++NO3-
Br- +Ag+→ AgBr↓
-Какие продукты реакции получатся? (AgI, NaNO3)
-Они растворимы в воде или нет? (NaNO3- да, AgI – нет), значит какой признак реакции мы увидим? (выпадение осадка)
Записывают:
NaI+AgNO3 → AgI↓ (осадок желтого цвета) + NaNO3
Na++I- +Ag+ +NO3- → AgI↓+Na++NO3-
I- +Ag+→ AgI↓
-Какие продукты реакции получатся? (CaF2, NaCl)
-Они растворимы в воде или нет? (NaCl- да, CaF2 – нет), значит какой признак реакции мы увидим? (выпадение осадка)
Записывают:
2NaF+ CaCl2→ CaF2↓ (осадок белого цвета) + 2NaCl
2Na+ + 2F-+ Ca2+ +2Cl-→ CaF2↓ (осадок белого цвета) + 2Na+ +2Cl-
2F- +Ca2+→ CaF2↓
IV. Обобщение и систематизация знаний
- Сейчас мы с вами порешаем пробный вариант контрольной работы.
Заряд ядра атома йода равен:
А) 53
Б) 127
В) 74
Г) 50
Окислительная способность атомов возрастает в ряду
А) F-Cl-Br
Б) Cl-Br-I
В) I-Cl-F
Г) Cl-Br-F
Атом тем легче отдает электроны, чем больше электронных слоев (слабые силы притяжение электронов внешнего уровня к ядру), это говорит о увеличении восстановительных свойств по подгруппе с увеличением порядкового номера ( и уменьшением окислительных свойств)
3) Степень окисления +3 хлор имеет в соединении
А) Ca(ClO2)2
Б) NaCl
В) KClO
Г) KClO3
(у доски 1 ученик расставляет степени окисления)
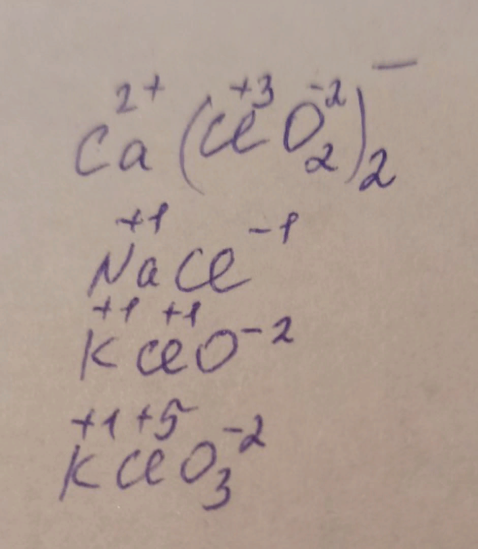
Какие 2 утверждения верны как для хлора, так и для брома.
А) В ядре атома химического элемента содержится 17 протонов
Б) Электроны в атоме расположены на трех электронных слоях
В) Химический элемент является неметаллом
Г) Соответствующее простое вещество существует в виде двухатомной молекулы
Д) Соответствующее простое вещество при нормальных условиях является жидкостью
5) Установите соответствие между исходными веществами и продуктами реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| Реагирующие вещества | Продукты |
| А) Cl2+H2O(гор.) Б) Cl2 +H2 В) Cl2 +H2O (хол.) | 1)HClO + HCl |
| 2)HCl+Cl2 |
| 3)HCl |
| 4)HCl+HClO3 |
Ответ:
Из предложенного перечня выберите две пары веществ, между которыми протекает реакция замещения:
А) Br2 и NaCl
Б) Cl2 и NaBr
В) Br2 и NaI
Г) I2 и HF
Д) F2 и H2
- Под буквой Д реакция замещения? (нет) Какая? (присоединения) Подходит этот вариант? (Нет)
-Под А, Б, В реальна реакция замещения? (да) Какого правила придерживаемся при осуществлении реакций замещения? (Более активный галоген вытесняет менее активный из раствора его соли)
-Бром может вытеснить хлор? (нет) почему? (потому что он менее активный, чем хлор)
-Хлор может вытеснить бром? (да) почему? (потому что он более активный чем бром)
-Бром может вытеснить йод? (да) почему? (потому что он более активный, чем йод)
- Йод может вытеснить фтор? (нет) почему? (потому что он менее активный, чем фтор)
7) Уравнению электролитической диссоциации хлорида алюминия (III) соответствует запись:
1) →3Al3+ + 2Cl-
2) →3Al + 2Cl
3) →Al3+ + 2Cl-
4) →Al3+ + 3Cl-
Ответ: 4. AlCl3 = Al3+ + 3Cl-
8) Установите соответствия между схемой процесса и названием процесса, происходящим в окислительно-восстановительной реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| Схема процесса | Название процесса |
| А) I20→ 2I-1 | 1) Окисление 2) Восстановление |
| Б) 2Br-1→ Br20 |
| В) Cl+7→ Cl-1 |
Ответ:
9) Используя метод электронного баланса, составьте уравнение реакции, соответствующее схеме превращений. Определите окислитель и восстановитель.
K2Cr2O7+HCl → KCl + CrCl3+ Cl2+ H2O
Ответ:
(1 ученик у доски, остальные в тетради)

10) Дана схема превращений. Напишите молекулярные ионные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращенное ионное уравнение реакции.
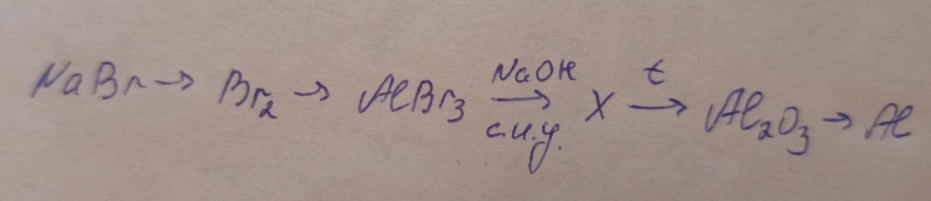
(1 ученик пишет у доски, попутно отвечая на вопросы, остальные так же отвечают на вопросы и записывают уравнения в тетрадь)
-Как получить бром из бромида натрия? (взаимодействием с активным галогеном)
-О какой реакции будем говорить? (о реакции замещения)
- Какого правила придерживаемся в этом случае? (Более сильный галоген вытесняет более слабый из раствора его соли)
- Какой галоген более активный, чем бром? (Хлор)
2NaBr+Cl2→Br2+2NCl
- Как получить бромид алюминия? (Взаимодействием галогена с металлом, конкретно брома с алюминием)
3Br2 + 2Al → 2AlBr3
- Какие продукты получится при взаимодействии бромида алюминия с гидроксидом натрия? (гидроксид алюминия и бромид натрия)
- Гидроксид алюминия растворим в воде? (нет, выпадает осадок)
- Напишите сокращенное ионное уравнение реакции.
AlBr3+3NaOH→Al(OH)3 ↓+3NaBr
Al3++OH- → Al(OH)3 ↓
-Что происходит с гидроксидом алюминия при нагревании? (разлагается)
-Какие продукты образуются при разложении нерастворимых оснований? (оксид алюминия и вода)
2Al (OH)3 → Al2O3 + 3H2O
-Как получим алюминий из оксида алюминия? (электролизом)
2Al2O3 → 4Al +3O2 (над стрелкой эл.ток)
11) Используя только реактивы из приведенного перечня, запишите молекулярные уравнения двух реакций, которые характеризуют химические свойства простого вещества хлора, и укажите признаки их протекания.
(1 ученик после обсуждения выносит реакции на доску)
Реактивы: азот, медь (II), кислород, бромид натрия, фторид натрия.
Ответ:
Cu+Cl2 → CuCl2 – реагирует с металлами (при нагревании)
2NaBr +Cl2 → 2NaCl + Br2 – вытесняет из солей бром.
С азотом, кислородом из галогенов взаимодействует только фтор.
С фторидом натрия не реагирует, так как хлор менее активный галоген, чем фтор и не может вытеснить его из раствора соли.
V. Домашнее задание
Повторить записи в тетради по теме «Галогены» и «Химические свойства галогенов». Подготовиться к контрольной работе за полугодие.