Тема занятия: Практическая работа «Обнаружение среды раствора с помощью индикаторов».
Цель занятия: изучить типы среды, индикаторы, их способность менять окраску в зависимости от реакции среды, научиться определять реакцию среды растворов разных объектов, усилить заинтересованность учащихся при изучении химии как школьного предмета, способствовать процессу самообразования.
Задачи занятия:
Обучающая: иметь представление о индикаторах, реакции среды, научиться определять кислотность раствора, продолжить формирование умений наблюдать и описывать проведенные химические реакции.
Развивающая: способствовать развитию логического мышления учащихся на основании анализа результатов, полученные в ходе практической работы, их обобщения, а также умения делать вывод. Подтвердить правило: практика доказывает теорию или опровергает ее.
Воспитательная: формировать научную и экологическую грамотность, установить необходимость внимательно отношения к окружающему миру и своему здоровью.
Планируемые результаты
Предметные:
- знать основные понятия;
- научиться различать характер среды.
Личностные:
- формировать ответственное отношение к учению, используя специально подобранные средства;
- уметь оценить степень успеха или неуспеха своей деятельности.
Метапредметные:
Коммуникативные:
- формулировать собственное мнение и позицию, задавать вопросы.
Регулятивные:
- планировать этапы практической работы по предмету;
- планировать свои действия в соответствии с поставленной задачей и условиями ее реализации.
Познавательные:
- формировать умение проводить сравнение и классификацию по заданным критериям
Тип занятия: практическая работа
Оборудование: штатив с пробирками.
Реактивы: лакмус, метиловый оранжевый, фенолфталеин; растворы соляной кислоты, уксусной кислоты, лимонной кислоты, раствор соды, раствор мыла и моющего средства для посуды, раствор сока свеклы, гидроксида натрия, хлорида натрия, чай, вода.
Ход занятия
I Организация начала занятия
II Актуализация ранее полученных знаний
Ребята! Мы с вами уже познакомились с такими понятиями как реакция среды водных растворов, а также индикаторы.
Какие типы реакции среды водных растворов вы знаете?
- нейтральная, щелочная и кислотная.
Что такое индикаторы?
- вещества, с помощью которых можно определить реакцию среды.
Какие индикаторы вам известны?
- в растворах: фенолфталеин, лакмус, метиловый оранжевый.
- сухие: универсальная индикаторная бумага, лакмусовая бумага, метилоранжевая бумага
Какими способами можно определить реакцию среды водных растворов?
- влажным и сухим.
Что такое pH среды?
- водородный показатель ионов водорода в растворе(pH = – lg [H+])
III Мотивация учебной деятельности
В повседневной жизни мы встречаемся с массой жидкостей, различного вкуса, запаха, цвета, но все они имеют определенную среду: кислую, основную, либо нейтральную. Как же можно определить эту среду без того, чтобы пробовать растворы на вкус, ведь не все они безобидны, некоторые из них опасны для жизни. Как вы считаете, какова цель нашего урока?
IV Текущий инструктаж
Осторожно обращайтесь с химическим оборудованием!
А) При работе со стеклом (пробирки, колбы, стаканы, трубки) всегда помните, что стекло - очень хрупкий материал и что его легко разбить.
Б) При работе с растворами кислот и щелочей проявите осторожность. Если кислота или щелочь попала на кожу – не паникуйте, а сообщите об этом учителю, и немедленно промойте большим количеством проточной воды.
В) Запрещается пробовать вещество на вкус (г).
Г) Работу проводить только над столом (д).
V Выполнение практической работы
Опыт № 1 Определите pH раствора при помощи универсального индикатора.
Для определения характера среды используется рН-шкала. Термин рН образовался от датского слова potenz – степень и «Н» - символа водорода.
Численное значение водородного показателя (рН) в шкале от 0 до 14 характеризует концентрацию кислоты или щелочи в растворе. Значение 0 указывает на то, что раствор представляет собой сильную кислоту, среднее значение 7 соответствует нейтральному раствору, рН = 14 имеют сильные основания, или щелочи. В нейтральном растворе при 25°С рН = 7. В кислых растворах рН 7, и тем больше, чем больше щёлочность раствора.
Индикаторы меняют свой цвет в зависимости от значения рН по-разному.
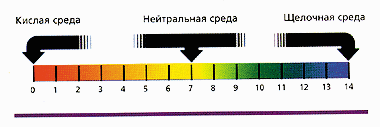
С помощью универсального индикатора определите pH воды, растворов соляной кислоты, хлорида натрия и гидроксида натрия. Результаты оформите в виде таблицы.
| Вещество | pH исследуемого раствора при использовании универсального индикатора | Реакция среды |
| NaOH | 10 | щелочная |
| HCl | 2 | кислотная |
| H2O | 7 | нейтральная |
| NaCl | 7 | нейтральная |
Вывод: если раствор имеет pH = 7 среда нейтральная, при pH 7 среда щелочная.
Методика изготовления индикаторов.
Для приготовления индикаторов из растительного сырья рекомендуется, использовать окрашенные растения или их части. Выбор растительного материала для приготовления индикаторов неограничен. Существуют различные способов приготовления индикаторов.
1. Индикатор из сока краснокочанной капусты можно получить следующим образом: 40-50 граммов мелко нарезанной капусты залить 25 мл этилового спирта, осторожно прокипятить, отфильтровать – индикатор готов.
2. Индикатор можно готовить не только из свежего сырья, но и из сушённого. Тонко измельчают корни конского щавеля и берут 25 – 30 грамм, заливают 25% водным раствором аммиака (120 – 150 мл). 6 часов настаивают.
3. 50г свежих плодов размельчить в ступке, залить 200мл воды и кипятить в течение 2-3минут. Затем охлаждённый и отфильтрованный раствор разбавить спиртом в соотношении 2:1 с целью предохранения раствора от порчи. Аналогично готовят вытяжки из лепестков цветов.
4. Можно использовать сушеные ягоды, получая из них настои: для этого измельченный материал нужно залить водой и дать постоять некоторое время при комнатной температуре. Окрашенный раствор отфильтровать и использовать как индикатор. Многие ягоды сохраняют свои свойства, если их поместить в сахарный сироп.
5. Для приготовления индикаторной бумаги необходимо в приготовленную вытяжку опустить сухую фильтровальную бумагу на 10 – 12 минут, пока красящее вещество не адсорбируется целлюлозой. При необходимости эту процедуру повторяют 2 – 3 раза. Затем бумагу промывают и сушат, не допуская попадания яркого свет. Сухую бумагу разрезают и хранят в пакете.
Опыт № 2 Изменение цвета сока столовой свеклы при действии растворов кислот и щелочей.
1.Приготовьте раствор сока столовой свеклы в воде (1:10).
2.Налейте в пробирки по 5 мл раствора сока.
3.Добавьте в пробирки равные объемы: в первую – раствора кислоты, во вторую – слабого раствора нашатырного спирта, в третью – раствора соды или гидроксида натрия, в четвертую – воды.
4.Наблюдайте за изменением окраски сока.
Наблюдение: в кислой среде сок становится пурпурным, в слабощелочной – голубоватым, в сильнощелочном – голубым, в нейтральной среде – остается бордово-коричневым.
Вывод: сок столовой свеклы является хорошим индикатором.
Опыт № 3 Определение рН среды средств бытовой химии и косметических средств.
В образцы моющих и косметических средств добавляем индикаторы.
Наблюдение: раствор мыла и моющего средства для посуды имеют щелочную среду.
Вывод: При работе с моющими средствами и порошком необходимо применение каких-либо защитных средств (перчаток), так как их сильно - щелочная и сильно-кислая среды разрушают кислотную мантию эпидермиса, оказывая негативное влияние на кожу рук.
Опыт № 4 Определение рН среды лимонной кислоты и раствора соды с помощью растительного индикатора.
В образцы лимонной кислоты и раствора соды добавляем чай.
Наблюдение: в лимонной кислоте чай посветлел, а в растворе соды – потемнел.
Вывод: растительный индикатор чай можно использовать для определения среды раствора.
VI Оформление отчета о практической работе
Результаты наблюдений занесите в таблицу
| Исследуемый раствор | Естественный цвет | Окраска индикатора |
| Сок свеклы |
|
|
| Раствор мыла |
|
|
| Раствор моющего средства |
|
|
| Раствор лимонной кислоты |
|
|
| Раствор соды |
|
|
VII Рефлексия
Что нового вы узнали?
Какие цели были вами достигнуты в результате выполнения практической работы?
Какое практическое применение для вас имеют полученные знания?
Тема занятия: Практическая работа «Обнаружение среды раствора с помощью индикаторов».
Цель занятия: изучить типы среды, индикаторы, их способность менять окраску в зависимости от реакции среды, научиться определять реакцию среды растворов разных объектов
Оборудование: штатив с пробирками.
Реактивы: лакмус, метиловый оранжевый, фенолфталеин; растворы соляной кислоты, гидроксида кальция, хлорида калия, вода.
Ход работы
Опыт № 1 Определите pH раствора при помощи универсального индикатора.
Для определения характера среды используется рН-шкала. Термин рН образовался от датского слова potenz – степень и «Н» - символа водорода.
Численное значение водородного показателя (рН) в шкале от 0 до 14 характеризует концентрацию кислоты или щелочи в растворе. Значение 0 указывает на то, что раствор представляет собой сильную кислоту, среднее значение 7 соответствует нейтральному раствору, рН = 14 имеют сильные основания, или щелочи. В нейтральном растворе при 25°С рН = 7. В кислых растворах рН 7, и тем больше, чем больше щёлочность раствора.
Индикаторы меняют свой цвет в зависимости от значения рН по-разному.
С помощью универсального индикатора определите pH воды, растворов соляной кислоты, хлорида натрия и гидроксида натрия. Результаты оформите в виде таблицы.
| Вещество | Цвет раствора | pH исследуемого раствора при использовании универсального индикатора | Реакция среды |
| Ca(OH)2 |
|
|
|
| HCl |
|
|
|
| H2O |
|
|
|
| KCl |
|
|
|
Вывод:
Опыт № 2 Определите класс веществ при помощи метилового оранжевого.
Результаты оформите в виде таблицы.
| Вещество | Цвет раствора | Реакция среды |
| Ca(OH)2 |
|
|
| HCl |
|
|
| H2O |
|
|
| KCl |
|
|
Опыт № 3 Определите класс веществ при помощи фенолфталеина.
Результаты оформите в виде таблицы.
| Вещество | Цвет раствора | Реакция среды |
| Ca(OH)2 |
|
|
| HCl |
|
|
| H2O |
|
|
| KCl |
|
|
Опыт № 4 Определите класс веществ при помощи лакмуса.
Результаты оформите в виде таблицы.
| Вещество | Цвет раствора | Реакция среды |
| Ca(OH)2 |
|
|
| HCl |
|
|
| H2O |
|
|
| KCl |
|
|
Опыт № 5 Определите класс веществ при помощи __________________________
Результаты оформите в виде таблицы.
| Вещество | Цвет раствора | Реакция среды |
| Ca(OH)2 |
|
|
| HCl |
|
|
| H2O |
|
|
| KCl |
|
|
Вывод:
















