| 1. Для увеличения скорости химической реакции Fe0 +Cu2+=Fe2++Cu0 необходимо 1) увеличить концентрацию ионов железа 2) размельчить железо 3) уменьшить температуру 4) увеличить концентрацию ионов меди 5) увеличить концентрацию атомов меди
| 1)Поместите в одну пробирку железную проволоку длиной 10 мм или гвоздь, а в другую – железные опилки. Добавьте по 1 мл раствора хлорида меди(II). В какой пробирке быстрее произошло изменение цвета? 2)Возьмите в 2 пробирки по 1 грануле Zn и добавьте немного р-ра HCl разной конц | Что наблюдали в первом и втором эксперименте? | BI В растворе протекает реакция 2А + 3В→ С. Во сколько раз возрастет скорость реакции, если концентрацию А увеличить в 2 раза, а концентрацию В – в 3 раза?
| Kакие факторы влияют на скорость данных химических реакций? ______________ Какой закон описывает зависимость с.х.р. от температуры? ______________ |
| 2. Увеличение температуры видимо повлияет на скорость реакций: 1) CuO+H2SO4=CuSO4+H2O 2) NaOH + HCl=NaCl+H2O 3) FeCl3+3KOH=3KCl+Fe(OH)3 4) СH2-(CHOH)4-COH +2Cu(OH)2=Cu2O + СH2-(CHOH)4COOH + 2H2O 5) BaCl2+K2SO4=BaSO4+2KCl
| Докажите, выбранные вами ответы экспериментально, используя имеющиеся у вас реактивы
| Какая из проделанных вами реакций является качественной? | BI Вычислите, во сколько раз увеличится скорость реакции при повышении температуры от 30ºдо 70º С, если температурный коэффициент скорости равен 2?
| Kакой фактор влияет на скорость данной химической реакции? ______________ Какому правилу подчиняется эта зависимость? ______________ |
| 3. Какие металлы реагируют с раствором серной кислотой быстрее? 1) Zn 2) Fe 3) Mg 4) Ag
4. На скорость каких реакций повлияет присутствие катализатора? 1) H2SO4+2KOH=K2SO4+2H2O 2) H2O2=H2O+O2 3) 2KMnO4=K2MnO4+MnO2+O2 4) 2SO2+O2=2SO3
В присутствии катализатора образуются непрочные промежуточные соединения с участием катализатора. В этом можно убедиться, применив в качестве катализатора разложения H2O2 насыщенный раствор хромата калия K2CrO4.
| Докажите ваш ответ экспериментально, используя имеющиеся у вас реактивы
1) Налить в пробирку приблизительно 1-2 мл H2O2 и прибавить небольшое количество оксида марганца (IV) MnO2. Повторить опыт, заменив катализатор MnO2 на такое же количества катализатора Fe2О3
2) в химический стаканчик насыпьте немного сухих дрожжей и добавьте раствор перекиси водорода Какое вещество в этом опыте выполняет роль катализатора?
|
| Запишите возможные уравнения реакций, дайте им краткую характеристику
ПРОБЛЕМНЫЙ ВОПРОС «Возможно ли влияние меди и формалина на скорость реакции Al с HCl, если эти вещества сами по себе с соляной кислотой не реагируют?» Al+HCl=? Al(Cu)+HCl=? Al(формалин)+HCl=?
Ответ подтвердите экспериментально | Kакой фактор влияет на скорость данной химической реакции?
________________
Kакой фактор влияет на скорость данных химических реакций? |
| 5. В системе 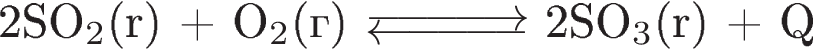
смещению химического равновесия в сторону исходных веществ будет способствовать 1) уменьшение давления 2) уменьшение температуры 3) увеличение давления 4) уменьшение концентрации  5) уменьшение концентрации 
| В две пробирки налить по 2-3 мл раствора крахмала и добавить 3-4 капли 0,1 н. раствора I2. Отметить цвет растворов. Одну пробирку оставить для сравнения, другую нагреть до исчезновения окраски. Охладить пробирку после нагревания. Отметить окраску раствора |
| а) объяснить исчезновение окраски раствора при нагревании и появлении вновь синей окраски после охлаждения раствора; б) объяснить, в каком направлении смещается при нагревании и при охлаждении равновесие в системе: йод + крахмал ⇄ йодокрахмал; в) экзо- или эндотермическим процессом является реакция образова-ния йодокрахмал
| Перечислите факторы, влияющие на химическое равновесие: |

















