Практическая работа №2
Тема: Составление электронного паспорта химического элемента. Характеристика химического элемента по его положению в ПСХЭ
Цель: научиться составлять электронный паспорт химического элемента и характеризовать ХЭ по положению в ПСХЭ.
Оборудование: ПСХЭ Д.И. Менделеева, учебник, калькулятор.
Ход работы:
1 Краткая теоретическая часть. Прочитайте и сделайте краткий конспект в тетрадь.
Для химии большой интерес представляет строение электронной оболочки атомов. Под электронной оболочкой атомов понимают совокупность всех электронов в атоме. Важнейшей характеристикой электрона является энергия его связи с атомом. Электроны, которые обладают близкими значениями энергии, образуют единый энергетический уровень. Число энергетических уровней в атоме = номеру периода в ПСХЭ, которому принадлежит химический элемент.
-s-орбиталь, максимум на ней находится 2 электрона,
- p-орбиталь, максимум на ней находится 6 электронов,
- d-орбиталь, максимум на ней находится 10 электронов,
- f-орбиталь, максимум на ней находится 14 электронов.
1. Составление электронной формулы химического элемента
Вот как выглядит порядок заполнения уровней и подуровней в многоэлектронных атомах (это атомы большинства элементов):
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7р
1. Сначала выясняем, сколько всего электронов содержит атом интересующего нас элемента. Для этого достаточно знать заряд его ядра, который всегда равен порядковому номеру элемента в Периодической таблице Д.И.Менделеева. Порядковый номер (число протонов в ядре) в точности равен и числу электронов во всем атоме.
2. Последовательно заполняем орбитали, начиная с нижней 1s-орбитали, имеющимися электронами (рис. 1). При этом нельзя располагать на каждой орбитали более двух электронов.
3. Записываем электронную формулу химического элемента.
Электронная формула описывает распределение электронов по энергетическим уровням, существующим в электронном облаке. Такое распределение называется также электронной конфигурацией атома.
Запись электронной формулы проще показать на конкретном примере.
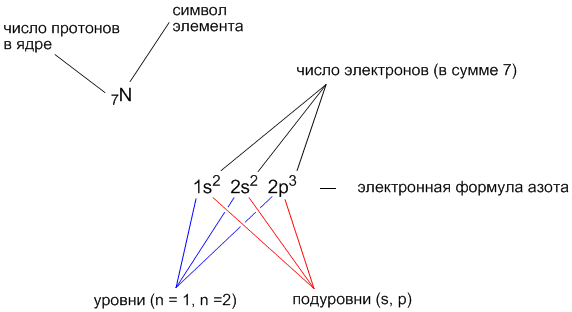
Допустим, нам надо выяснить электронную формулу элемента с порядковым номером 7. В атоме такого элемента должно быть 7 электронов. Заполним орбитали семью электронами, начиная с нижней 1s-орбитали.
Итак, 2 электрона расположатся на 1s-орбитали, еще 2 электрона - на 2s-орбитали, а оставшиеся 3 электрона смогут разместиться на трех 2p-орбиталях.
Электронная формула элемента с порядковым номером 7 (это элемент азот, имеющий символ “N”) выглядит так:
↑↓
↑↓
↑
↑
↑
↑
↑
7N
1s 2s 2p
Рис. 1. Электронная и структурная формулы атома азота N
Максимальное количество электронов ē на энергетическом уровне можно определить по формуле: N=2*n2, где N – максимальное количество электронов на энергетическом уровне; n – номер энергетического уровня.
Алгоритм характеристики химического элемента (ХЭ) по положению в ПСХЭ:
Знак ХЭ
Порядковый номер ХЭ
Номер периода, в котором находится ХЭ
Характеристика периода (малый или большой)
Номер группы, в которой находится ХЭ
Тип подгруппы (главная (а) или побочная (б))
Относительная атомная масса ХЭ
Число протонов в атоме ХЭ (равняется порядковому номеру ХЭ)
Число нейтронов в атоме ХЭ (из относительной атомной массы вычесть порядковый номер ХЭ)
Число электронов в атоме ХЭ (равняется количеству протонов)
Число энергетических уровней в атоме ХЭ (равняется номеру периода, в котором находится ХЭ)
Расположение электронов на энергетических уровнях
Сравнение металлических свойств ХЭ с соседями по периоду
Сравнение металлических свойств ХЭ с соседями по подгруппе
Формула высшего оксида
Если описываете Металл, то формула высшего гидроксида Меn+(ОН)-n
Если описываете НеМеталл, то формула соответствующей кислоты
Выполните следующие задания самостоятельно:
2.1.Составьте электронный паспорт для элементов: Ga, Kr, Fe, Ag, Rb, I, Si, Ba, Mo.
Охарактеризуйте по положению в ПСХЭ элементы: Ва, Fe.
3. Напишите вывод о проделанной работе.



















