Практическое занятие № 1.
Решение задач и упражнений на скорость химических реакций
Учебная цель: углубить и обобщить теоретические знания обучающихся о скорости химической реакции, закрепить знание формул выражения скорости реакций, научиться выполнять расчеты, используя данные формулы.
Образовательные результаты, заявленные во ФГОС третьего поколения:
Обучающийся должен знать:
- понятие скорости реакции;
- факторы, влияющие на скорость химической реакции;
- понятие температурного коэффициента и правило Я. Вант-Гоффа.
Обучающийся должен уметь:
- выполнять расчеты по оценке скорости химической реакции;
- выполнять расчеты по оценке влияния температуры на скорость химической реакции.
Задачи практического занятия:
1. Закрепить теоретические знания о химических реакциях и скорости химических реакциях.
2. Ответить на вопросы для закрепления теоретического материала.
3. Выполнить практические задачи.
4. Ответить на вопросы для контроля.
Обеспеченность занятия:
Учебно-методическая литература:
Тетрадь для практических и контрольных работ.
Калькулятор.
Ручка.
Краткие теоретические и учебно-методические материалы по теме практического занятия
Известно, что одни химические реакции протекают за доли секунды, другие – за минуты, часы, сутки. Например, при сливании растворов хлорида бария и серной кислоты мгновенно образуется белый осадок сульфата бария:
ВаС12 + H2SО4 BaSО4 + 2HC1
Наоборот, реакция ржавления железа (коррозия) идет так медленно, что проследить за ее результатами можно лишь по истечении длительного времени. Чтобы характеризовать быстроту течения химической реакции, пользуются понятием скорость химической реакции, которую обозначают буквой .
Скорость химической реакции () определяется изменением концентрации одного из реагирующих веществ или одного из продуктов реакции в единицу времени:
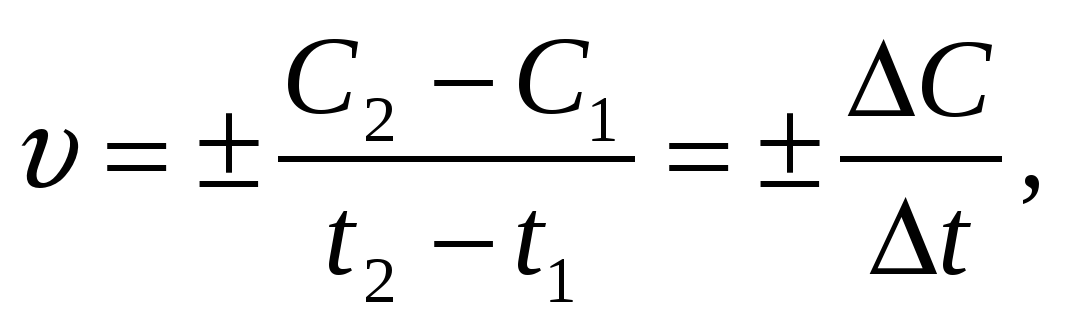 (1)
(1)
где С1 и С2 молярные концентрации реагирующих (или образующихся) веществ в момент времени t1 и t2 соответственно.
Количество вещества в единице объема называют молярной концентрацией; она измеряется в молях на литр (моль/л). Так как время измеряется в секундах (минутах, часах), то можно вывести и единицы измерения скорости химической реакции: 1 моль/ (л-с); 1 кмоль/(м3мин) и т.д.
Факторы, определяющие скорость химической реакции:
1. Природа реагирующих веществ.
2. Концентрация реагирующих веществ. Увеличение концентрации веществ обусловливает рост скорости реакции.
3. Температура. Известно, что при нагревании скорость химической реакции увеличивается. В конце XIX в. голландский химик Я. Вант-Гофф сформулировал правило:
При увеличении температуры на каждые 10 градусов скорость химической реакции увеличивается в 2 4 раза:
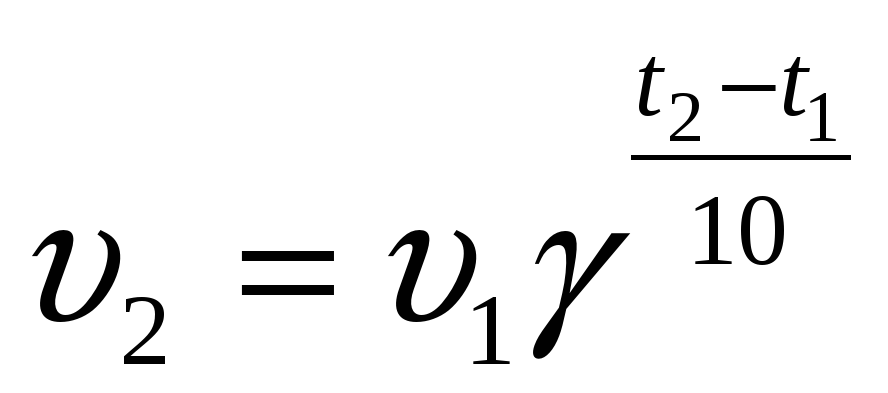 , (2)
, (2)
где 2 скорость реакции при конечной температуре t2;
1 скорость реакции при начальной температуре t1.
Величину называют температурным коэффициентом реакции. Его физический смысл заключается в том, что он показывает, во сколько раз возрастает скорость реакции при увеличении температуры на каждые 10 градусов. Именно значение температурного коэффициента для большинства реакций составляет от 2 до 4.
4. Поверхность соприкосновения реагирующих веществ. Скорость гетерогенных реакций, т. е. реакций, протекающих на границе раздела фаз, зависит при прочих равных условиях от свойств поверхности веществ. Например, растертый в порошок мел быстрее растворяется в соляной кислоте, чем равный по массе кусочек мела.
5. Использование катализаторов.
Вопросы для закрепления теоретического материала к практическому занятию
Что называется скоростью химической реакции?
Какие факторы влияют на скорость реакции?
В чем состоит физических смысл температурного коэффициента реакции?
Как зависит скорость химической реакции от концентрации?
Задания для практического занятия:
Решить предложенные задачи.
Правильно оформить их в тетрадь для практических и контрольных работ.
Ответить на вопросы для контроля.
Отчитаться о выполненной работе преподавателю.
Задание 1
| Вариант 1 | Вариант 2 |
| Температурный коэффициент реакции равен 3. Во сколько раз увеличится скорость реакции при увеличении температуры на 30 градусов. | При 30 градусах реакция протекает за 3 мин 45 с. За какое время будет протекать эта реакция при повышении температуры до 50 градусов, если температурный коэффициент равен 3? |
Образец решения задания № 1 (вариант 1)
Температурный коэффициент реакции равен 4. Во сколько раз увеличится скорость реакции при увеличении температуры на 40 градусов.
Алгоритм решения
Дано: = 4, Т = 40
Найти: Т2/Т1 ?
Решение
Согласно математическому выражению правила Вант-Гоффа (8) в нашем примере Т = 40°С, подставив данные задачи в уравнение (8), получим:
Т2/Т1 = 4 40/10 = 44= 256,
т. е. скорость реакции возрастет в 256 раз.
Ответ: скорость реакции возрастет в 256 раз.
Образец решения задания № 1 (вариант 2)
При 20 градусах реакция протекает за 5 мин 40 с. За какое время будет протекать эта реакция при повышении температуры до 40 градусов, если температурный коэффициент равен 4?
Алгоритм решения
Дано:
= 4; Т1 = 20; Т2 = 40; t1 = 5 мин 40 с
Найти: t2 ?
Решение
Согласно математическому выражению правила Вант-Гоффа (8) рассчитаем во сколько раз возрастет скорость реакции в случае повышения температуры от 20 д 40:
Т2/Т1 = 4 20/10 = 42 = 16
Итак, скорость реакции возрастет в 16 раз.
Скорость химической реакции () определяется изменением концентрации одного из реагирующих веществ или одного из продуктов реакции в единицу времени (формула 7). Скорость реакции находится в обратной зависимости от времени реакции.
Таким образом, при повышении температуры до 40 скорость реакции возрастет в 16 раз, следовательно, время реакции сократиться в 16 раз.
t1 = 5 мин 40 с или 5 60 + 40 = 340 с.
Тогда t2 = 340 с / 16 = 21,25 с.
Ответ: t2 = 21,25 с.
Задание 2
| Вариант 1 | Вариант 2 |
| Температурный коэффициент реакции равен 2. На сколько градусов нужно увеличить температуру реакции, чтобы ее скорость увеличилась в 8 раз? | На сколько градусов надо повысить температуру, чтобы скорость реакции возросла в 27 раз. Температурный коэффициент равен 3. |
Образец решения задания № 2
Температурный коэффициент реакции равен 4. На сколько градусов нужно увеличить температуру реакции, чтобы ее скорость увеличилась в 16 раз?
Алгоритм решения
Дано:
= 4; Т2/Т1 = 16
Найти: Т ?
Решение
Согласно математическому выражению правила Вант-Гоффа (8) в нашем примере Т2/Т1 = 16, подставив данные задачи в уравнение (8), получим:
16 = 4 Т/10
Тогда: Т / 10 = 2
Т = 20
Итак, нужно увеличить температуру реакции на 20.
Ответ: нужно увеличить температуру реакции на 20.
Вопросы для контроля
Как влияет поверхность соприкосновения реагирующих веществ на скорость реакции?
Какова роль катализатора в химической реакции?
Как называется реакция, протекающая в присутствии катализатора?
Форма контроля выполнения практического задания:
Выполненная работа представляется преподавателю в тетради для выполнения практических и контрольных работ по дисциплине «Естествознание».
4

















