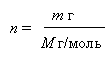Практической работы №1
Тема: «Решение расчетных задач с использованием основных законов химии»
Цель: Ознакомиться с основными законами химии и научиться с их помощью решать элементарные расчетные задачи.
Оборудование:
тетради;
калькуляторы;
периодическая система химических элементов Д.И. Менделеева.
таблица «Основные химические формулы»;
Краткая теоретическая часть: А́томная ма́сса (Ar) - значение массы атома, выраженное в атомных единицах массы. В настоящее время атомная единица массы принята равной 1/12 массы нейтрального атома наиболее распространённого изотопа углерода 12C, поэтому атомная масса этого изотопа по определению равна точно 12. Измеряется в атомных единицах массы (а.е.м.)
Количество вещества (n) - физическая величина, характеризующая количество однотипных структурных единиц, содержащихся в веществе. Под структурными единицами понимаются любые частицы, из которых состоит вещество (атомы, молекулы, ионы, электроны или любые другие частицы). Единица измерения количества вещества - моль. Так как использовать в расчётах непосредственно количество молекул неудобно, потому что это число в реальных опытах слишком велико, вместо измерения количества молекул «в штуках», их измеряют в молях. Фактическое количество единиц вещества в 1 моле называется числом Авогадро (NA = 6,022 141 79(30)·1023 моль−1).
Моля́рная ма́сса вещества (М) - масса одного моль вещества, выражается в г/моль.
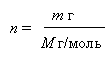
Закон сохранения массы. Новые вещества не получаются из ничего и не могут обратиться в ничто. Масса (вес) реагентов всегда в точности равна массе (весу) продуктов химической реакции. Этот фундаментальный закон впервые открыл русский ученый М.В.Ломоносов
Масса веществ, вступающих в химическую реакцию, равна массе веществ, образующихся в результате реакции. Теперь, с учетом закона сохранения массы, мы можем сформулировать правила составления химических уравнений:
1) Нужно знать формулы веществ, вступивших в реакцию (формулы реагентов) и формулы веществ, полученных в результате реакции (формулы продуктов).
2) Следует записать левую часть уравнения, где располагаются формулы реагентов (в любом порядке). Между формулами ставятся знаки "плюс".
3) Далее следует поставить знак равенства или стрелку и записать правую часть уравнения: формулы продуктов (в любом порядке) и знаки "плюс" между ними.
4) Число атомов каждого элемента в левой части уравнения должно быть равно числу атомов каждого элемента в правой части уравнения. Для достижения этого нужно подобрать и поставить перед формулами соответствующие коэффициенты.
5) Нельзя менять местами левую и правую части уравнения. Нельзя переносить формулы веществ из одной части уравнения в другую.
Пример правильно записанного уравнения химической реакции:
2Ag + S = Ag2S
Газовые законы: Равные объемы любых газов (при одинаковых температуре и давлении) содержат равное число молекул. 1 МОЛЬ любого газа при нормальных условиях (н.у.) занимает объем 22,4 л- эта величина называется молярный объем газа(Vm).
n = V / Vm = m / M
Ход работы:
Внимательно прочитайте краткую теоретическую часть. Сделайте в тетрадь запись основных понятий и формул.
Самостоятельно решите ниже перечисленные задачи.
Сделайте вывод, опираясь на цель занятия.
Задачи:
Пользуясь значениями атомных весов элементов из Периодической таблицы, рассчитайте молярную массу (г/моль) для следующих веществ: NaF, N2, NaOH, SO2, Ca3(PO4)2 .Сколько молекул содержится в 1 моле каждого из этих веществ?
2. Сколько молей кислорода содержится в 128 г кислорода?
3. При грозовых разрядах в атмосфере происходит следующая реакция: N2 + O2 = NO2. Уравняйте реакцию. Сколько молей кислорода потребуется для полного превращения 1 моля азота в NO2? Cколько это будет граммов кислорода? Сколько граммов NO2 образуется?
4. В стакан налили 180 г воды. Сколько молекул воды в стакане? Сколько это молей H2O?
5. Вычислите массу вещества, соответствующую 6 моль атомов серы.
6. В пассажирский самолет перед началом рейса погрузили 200 кг продуктов (масса без упаковки). Как изменилась масса авиалайнера после того, как в полете пассажирам предложили обед и все продукты были съедены?
7. Красный порошок меди (6,4 г) смешали с желтым порошком серы (3,2 г) и нагрели. Получили черный порошок, не содержащий красных крупинок меди и желтого порошка серы. Какова масса полученного черного порошка? Напишите уравнение реакции
8. Уравняйте следующие реакции
Al + O2 = Al2O3,
LiOH+H2CO3 = Li2CO3 + H2O
H2O+SO2 = H2SO3
9. Какой объем при нормальных условиях (н.у.) занимают 56 г газообразного азота?
10. Какой объем при н.у. занимают 80 г газообразного аргона?