Просмотр содержимого презентации
«урок»

Практическая работа 4 Изучение признаков химических реакций и условий их протекания
Prezentacii.com

Цель работы : изучить признаки химических реакций и условия их протекания на практике; научиться распознавать химические явления среди множества других

Основные термины и понятия:
- химические реакции,
- признаки химических реакций,
- условия протекания реакций,
- типы химических реакций,
- уравнение химических реакций,
- закон сохранения массы,
- коэффициент

Выберите верные утверждения:
- 1.При физических явлениях новые вещества не образуются.
- 2.плавление металлов- пример химической реакции
- 3.при химических явлениях изменяется только агрегатное состояние вещества или форма тела.
- 4.химические реакции могут происходить только в химической лаборатории.
- 5.излучение тепла и света –один из признаков химической реакции.
- 6.закон сохранения массы веществ был открыт Р.Бойлем.
- 7.согласно закону сохранения веществ число атомов до реакции должно быть равно числу атомов после реакции.
- 8.числа перед формулами веществ в уравнении реакции называются индексами.
- 9.коэффициенты показывают число молекул (формульных единиц) и химическое количество вещества в реакции.
- 10.уравнение 2Си + О 2 = 2СиО записано верно.

Вставьте пропущенные слова в предложения:
1.Явления,при которых происходит превращение одних веществ в другие называются…
2.Главное условие для протекания химических реакций между веществами –это их…..
3.Необходимым условием для протекания реакции фотосинтеза является
4.Закон сохранения массы веществ был открыт….
5.Условная запись реакции при помощи формул и знаков-……
6.Значок hv в химической реакции обозначает….
7.Реакции,при которых из нескольких простых веществ образуется одно более сложное вещество, называются реакциями…
8.При нагревании газа йодоводорода получают газы водород и йод. Эта реакция относится к реакциям….

.
Вставьте пропущенные слова в предложения:
1.Явления,при которых происходит превращение одних веществ в другие называются… химическими
2.Главное условие для протекания химических реакций между веществами –это их….. соприкосновение
3.Необходимым условием для протекания реакции фотосинтеза является … освещение.
4.Закон сохранения массы веществ был открыт … М.В.Ломоносовым
5.Условная запись реакции при помощи формул и знаков-…… химическое уравнение
6.Значок hv в химической реакции обозначает… освещение. .
7.Реакции,при которых из нескольких простых веществ образуется одно более сложное вещество, называются реакциями… соединения.
8.При нагревании газа йодоводорода получают газы водород и йод. Эта реакция относится к реакциям… разложения. .

Инструктаж по правилам безопасного поведения
- Приступайте к работе только после разрешения учителя
- Выполняйте только ту работу, которая предусмотрена заданием
- Не отвлекайтесь сами и не отвлекайте других от работы посторонними разговорами
- Химические вещества берите строго в количествах, предусмотренных опытом, внимательно прочтите этикетку на таре, чтобы избежать ошибок
- Поддерживайте на рабочем столе чистоту и аккуратность, не захламляйте стол посторонними вещами
- Не сливайте реактивы обратно в тару к основному количеству реактива, сразу же закрывайте тару пробками
- После работы наведите порядок на столе, вымойте руки
- При возникновении любых непредвиденных ситуаций сразу же обращайтесь к учителю

Алгоритм проведения лабораторного опыта
- Внимательно изучите задание
- В пробирку налейте 1-2 мл одного реактива и прилейте столько же другого
- Отметьте наблюдения
- Сделайте вывод о признаках и условиях протекания данной реакции
- Запишите уравнение химической реакции, расставьте коэффициенты, определите тип химической реакции

№
Что делал
1
Что наблюдал
2
3
Вывод
4
Уравнение реакции

Опыт 1 . Выделение газа при химической реакции
- В пробирку налейте 2-3 мл серной кислоты H 2 SO 4 и прибавьте кусочек мела CaCO 3
Наблюдения запишите в таблицу, составьте уравнение реакции
CaCO 3 +H 2 SO 4 = CaSO 4 +H 2 CO 3
H 2 O CO 2
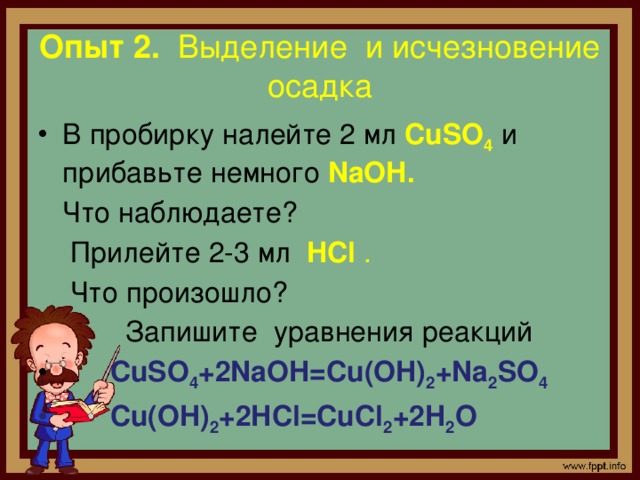
Опыт 2. Выделение и исчезновение осадка
- В пробирку налейте 2 мл CuSO 4 и прибавьте немного NaOH.
Что наблюдаете?
Прилейте 2-3 мл HCl .
Что произошло?
Запишите уравнения реакций
- CuSO 4 +2NaOH=Cu(OH) 2 +Na 2 SO 4
- Cu(OH) 2 +2HCl=CuCl 2 +2H 2 O

Опыт 3 . Выделение тепла и света
- Зажгите свечу. Какие явления наблюдаете при горении? Запишите уравнение реакции, заполните таблицу.
С+О 2 =СО 2 + Q

Опыт 4. Появление запаха
- В пробирку налейте 2 мл NH 4 Cl прибавьте NaOH и нагрейте пробирку. Что наблюдаете после нагревания? Запишите уравнения реакций
NH 4 Cl+NaOH=NH 4 OH+NaCl

Запишите вывод работы
- Домашнее задание: повторить параграфы 14-18, термины





























