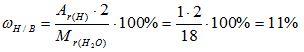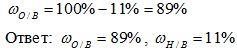Практическая работа
Составление формул бинарных соединений, их номенклатура. Вычисление относительной молекулярной массы вещества, массовой доли элемента в веществе.
Цель работы: совершенствование умений составлять формулы бинарных соединений, называть их; производить простейшие расчеты по молекулярным формулам (ОК2, ОК4,ОК6).
Задачи работы:
- закрепить понятия «степень окисления», «бинарные соединения»;
- закрепить умения определять степени окисления, называть бинарные соединения, составлять формулы бинарных соединений по степени окисления;
- закрепить умения производить простейшие вычисления по молекулярной формуле сложного вещества.
Пояснения к работе.
В результате выполнения практической работы студенты должны:
знать/понимать:
- важнейшие химические понятия: вещество, химический элемент, молекула, относительные атомная и молекулярная массы, степень окисления,
- основные законы химии: постоянства состава, периодический закон;
уметь:
- называть изученные вещества по "тривиальной" или международной номенклатуре;
- определять: валентность и степень окисления химических элементов,
- проводить самостоятельный поиск химической информации с использованием различных источников (научно-популярных изданий, компьютерных баз данных, ресурсов Интернета); использовать компьютерные технологии для обработки и передачи химической информации и ее представления в различных формах;
-использовать приобретенные знания и умения в практической деятельности и повседневной жизни для:
- критической оценки достоверности химической информации, поступающей из разных источников;
- понимания взаимосвязи учебного предмета с особенностями профессий и профессиональной деятельности, в основе которых лежат знания по данному учебному предмету.
Оснащение занятия: Периодическая система химических элементов Д.И.Менделеева, калькулятор.
Задание 1. Составление формул и номенклатура бинарных соединений:
| Вариант 1 | Вариант 2 |
| 1. Определите степени окисления атомов элементов в соединениях, формулы которых SiO2, Nа2О, К2S, LiВг. Приведите названия каждого из веществ. | 1. Определите степени окисления атомов химических элементов в соединениях, формулы которых Н2O, АlСl3, N2О5, Nа3Р. |
| 2. Какая из следующих формул соответствует оксиду азота (II): NО, N2О5, NО2, N2О? | 2. Выберите формулу оксида марганца (IV): МnО, Мn2O7, МnF4, МnО2.
|
| 3. Напишите формулы веществ: а) оксида серы (IV) б) оксида серы (VI).
| 3. Напишите формулы веществ: а) оксида меди (II); б) оксида натрия. |
Задание 2. Вычисление массовой доли элемента
| Вариант 1 | Вариант 2 |
| 1. Вычислите массовые доли элементов в cульфате натрия Na2SO4 | 1. Вычислите массовые доли элементов в карбонате калия K2CO3 |
| 2. Какой из оксидов FeO или Fe2O3 богаче железом? | 2. Какой из оксидов CuO или Cu2O богаче кислородом? |
Решения задач оформите в соответствии с образцом, приведенным ниже.
Предварительная подготовка. Теоретическая часть по теме
«Составление формул бинарных соединений, их номенклатура. Вычисление относительной молекулярной массы вещества, массовой доли элемента в веществе»
Бинарные соединения – это сложные вещества, состоящие из атомов двух химических элементов (как правило, на первом месте записывается элемент с положительной степенью окисления, на втором месте – с отрицательной степенью окисления).
Степень окисления – это условный заряд атомов химического элемента в соединении, вычисленный на основе предположения, что все соединения (ионные и ковалентно-полярные) состоят только из ионов.
Степень окисления показывает, сколько электронов смещается к более электроотрицательному элементу. Электроотрицательность (ЭО) – свойство атомов данного химического элемента оттягивать к себе общие электронные пары.
Степень окисления может иметь положительное, отрицательное и нулевое значения.
Степени окисления расставляются: вверху над символом элемента, причем вначале пишется заряд (+ или -), а затем число (1,2,3).
Примеры веществ, в которых у элементов проставлены степени окисления:
Na2+1S-2, H2+1O-2, Cl20.
Для того, чтобы по формулам химических соединений рассчитать степени окисления с.о.), необходимо знать определенные правила.
В соединениях отрицательное значение с.о. имеют элементы с большим значением электроотрицательности, а положительное значение с.о. – элементы с меньшим значением электроотрицательности.
Есть элементы с постоянной с.о. и элементы с переменной с.о.
Элементы с постоянным значением с.о.:
а) металлы всегда имеют положительное значение с.о.
У металлов главных подгрупп: I группы во всех соединениях с.о. равна +1, II группы - +2, III группы - +3.
б) элемент фтор в соединениях всегда проявляет степень окисления -1
Элементы с переменным значением с.о.:
а) все остальные металлы (кроме перечисленных выше металлов);
б) почти все неметаллы;
в) кислород почти всегда имеет с.о. -2;
г) в большинстве соединений водород имеет с.о. +1.
3. У элементов. которые в бинарном соединении записываются на втором месте, с.о. отрицательна и рассчитывается по формуле: №группы элемента -8.
4. У простых веществ и свободных атомов с.о. всегда равна нулю (H2, N2, Fe, Al, Cl, N, Na).
5. В соединениях сумма всех степеней окисления элементов всегда равна нулю. То есть, сумма положительных и отрицательных зарядов в молекуле всегда равна нулю.
6. Для того, чтобы рассчитать с.о. одного элемента в соединении, надо знать с.о. другого элемента.
Нахождение с.о. по формуле вещества.
Составим алгебраическое уравнение с одним неизвестным для определения значения с.о. в каком-либо соединении.
Найдем с.о. хлора в соединении Cl2O. Выпишем с.о. кислорода и обозначим неизвестную степень окисления хлора через х: Cl2xO-2
Составим уравнение:
2х+(-2)▪1=0; 2х=2; х=+1
Записываем степень окисления хлора: Cl2+1O-2
Составление формулы соединения по известным с.о.элементов.
Например, составить формулу бинарного соединения алюминия с углеродом.
Запишем знаки алюминия и углерода: Al C, причем вначале записываем элемент с положительным значением с.о. (какой это элемент в нашем примере?), а затем – элемент с отрицательным значением с.о.
Теперь по порядку:
Алюминий находится в 3 группе, это металл, его с. о. всегда положительна и равна +3.
Углерод находится в 4 группе, его с.о. его будет равна -4 (4 – 8 = -4)
Запишем эти значения в формулу: Al+3C-4, найдем наименьшее общее кратное для них (оно равно 12). Затем рассчитаем индексы:
12
Al +3 C -4 → Al4C3
Названия бинарных соединений образуются из двух слов – названий входящих в их состав химических элементов. Вначале произносят корень латинского названия элемента с отрицательной с.о.(у нас углерод, его латинское название - карбонеум), добавляя суффикс – «ид» (в именительном падеже), после этого добавляют название элемента с положительной с.о. в родительном падеже.
Например: NaCl – хлорид натрия, MgS – сульфид магния, KH – гидрид калия.
Если же электроположительный элемент проявляет разные степени окисления, то это отражают в названии, обозначив с. о. римской цифрой, которую ставят в конце названия в скобках.
Например: Fe+2O-2 оксид железа(II); Fe2+3O3-2 оксид железа(III).
Если же соединение состоит из двух элементов-неметаллов, то к корню латинского названия более ЭО (находится в формуле на втором месте) из них прибавляют суффикс «ид», второй компонент называют в родительном падеже.
Например: O+2F2-1 – фторид кислорода, S+4O2-2- оксид серы (IV), S+6O3-2- оксид серы (VI).
В некоторых случаях число атомов элементов обозначают при помощи названий греческих числительных – моно, ди, три, тетра.
CO- монооксид углерода, CO2- диоксид углерода, PbCl4- тетрахлорид фтора.
Относительная молекулярная масса (Mr)- безразмерная величина, показывающая, во сколько раз масса молекулы данного вещества больше 1/12 массы изотопа углерода C12.
Относительная молекулярная масса вещества равна сумме относительных атомных масс всех элементов с учетом индексов.
Примеры:
Mr(B2O3) = 2 · Ar(B) + 3 · Ar(O) = 2 · 11 + 3 · 16 = 70
Mr(KAl(SO4)2) = 1 · Ar(K) + 1 · Ar(Al) + 1· 2 · Ar(S) + 2· 4 · Ar(O) =
= 1 · 39 + 1 · 27 + 1 · 2 · 32 + 2 · 4 ·16 = 258
Массовая доля химического элемента. Зная химическую формулу, можно вычислить массовую долю химических элементов в веществе. Массовая доля элемента в вещества обозначается греческой буквой «омега» - ω и рассчитывается по формуле:
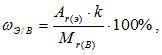 где k – число атомов этого элемента в молекуле.
где k – число атомов этого элемента в молекуле.
Пример: рассчитать массовые доли водорода и кислорода в молекуле воды Н2О.
Решение:
1) Вычисляем относительную молекулярную массу воды:
Mr(Н2О) = 2*Аr(Н) + 1*Аr(О) = 2*1 + 1* 16 = 18
2) Вычисляем массовую долю водорода в воде:
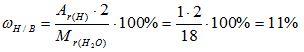
3) Вычисляем массовую долю кислорода в воде. Так как в состав воды входят атомы только двух химических элементов, массовая доля кислорода будет равна:
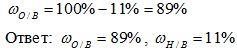
Образец оформления задачи:

Требования к содержанию и оформлению отчёта по лабораторной работе
Запишите в журнал лабораторно-практических занятий:
Наименование работы, цель работы.
Ход работы: записать формулировку задания 1 и решить его; решения задач в задании 2 оформить в соответствии с образцом.
Сделать вывод к работе.
Привести ответы на задания контрольных вопросов для самопроверки.
Контрольные вопросы для самопроверки.
Вариант 1.
1. Бинарным веществом является: 1) HNO3 2) CO 3)NaOH 4)H2SO3 2. Степень окисления фосфора в соединении P2O5 равна: 1) -3 2) 0 3) +5 4) +3 3. Степень окисления +2 характерна для: 1) для металлов 1 группы 2) для металлов 3 группы 3) для металлов 2 группы 4) для неметаллов 6 группы 4. Атомы в молекулах простых веществ и атомы в свободном состоянии имеют степень окисления 1) 0 2) -1 3) +1 4) +2 5. Какую формулу имеет соединение, в котором элементы имеют степени окисления +1 и
-3 соответственно? 1) P2О5 2)P2O3 3)PF3 4) K3P
Вариант 2.
1. Бинарным веществом является: 1) KNO3 2) H2CO3 3) Ca(OH)2 4) AlCl3 2. Степень окисления марганца в соединении Mn2O7 равна: 1) -7 2) +2 3) +7 4) +4 3. Степень окисления +1 характерна для: 1) для металлов 1 группы 2) для металлов 3 группы 3) для металлов 2 группы 4) для неметаллов 7 группы 4. Сумма степеней окисления в сложном веществе равна
1) 0 2) -1 3) +1 4) +2 5. Какую формулу имеет соединение, в котором элементы имеют степени окисления +1 и
-3 соответственно? 1) NaCl 2)N2O3 3)Na3N 4) N2O
Список литературы и интернет – источников
Степень окисления. Бинарные соединения [Электронный ресурс] https://videouroki.net.-Режим доступа: https://videouroki.net/blog/stepen-okisleniya-binarnye-soedineniya.html, свободный.-Загл. с экрана
Вычисление массовой доли элемента или вещества [Электронный ресурс] http://examchemistry.com -Режим доступа: http://examchemistry.com/content/ lesson/primenenie/taskcourse/massovdola.html, свободный.-Загл. с экрана







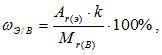 где k – число атомов этого элемента в молекуле.
где k – число атомов этого элемента в молекуле.