5
Тема 2 «Углеводороды»
Практическое занятие № 6.
Номенклатура и изомерия углеводородов
Учебная цель: закрепить и обобщить теоретические знания о номенклатуре углеводородов.
Образовательные результаты, заявленные во ФГОС третьего поколения:
Обучающийся должен знать:
- способы образования и разрыва ковалентной связи, типы и сущность гибридизации электронных орбиталей, характеристики ковалентной связи, классификацию ковалентной связи; номенклатуру органических реакций.
Обучающийся должен уметь:
- составлять схемы образования и разрыва связи; объяснять четырехвалентность углерода в органических соединениях; составлять структурные формулы углеводородов.
Задачи практического занятия:
1. Закрепить теоретические знания о номенклатуре и изомерии углеводородов.
2. Ответить на вопросы для закрепления теоретического материала.
3. Выполнить практические задачи.
4. Ответить на вопросы для контроля.
Обеспеченность занятия:
Учебно-методическая литература:
Справочная литература:
Таблица «Гомологический ряд предельных углеводородов (алканов) нормального (неразветвленного) строения и их одновалентные радикалы» (приложение 1).
Таблица «Основные классы органических соединений» (приложение 3).
Тетрадь для практических и контрольных работ.
Ручка, карандаш.
Краткие теоретические и учебно-методические материалы по теме практического занятия
Многообразие органических веществ обусловлено наличием изомеров – веществ, имеющих одинаковый количественный и качественный состав, но разное строение.
Изомеризация – превращение одного изомера в другой. Изомеризация приводит к получению соединения с иным расположением атомов или групп, но при этом не происходит изменение состава и молекулярной массы соединения. В литературе изомеризацию часто называют перегруппировкой.
Составление названий изомеров осуществляется в соответствии с международной номенклатурой IUPAC.
Алгоритм составления названия:
1. Выбирается самая длинная, возможно изогнутая неразветвленная цепочка. Нумерация цепочки производится с того края, к которому ближе заместитель, кратная связь, функциональная группа.
2. В начале указывается номер атома углерода, возле которого находится заместитель если заместителей несколько возле разных атомов – указываются все цифры по возрастанию например: 2, 4,…; если два заместителя находятся возле одного атома углерода – цифра повторяется например: 2,2… ).
3. После цифры указывается название заместителя.
- заместителями могут быть радикалы (метил, этил, пропил и т.д.) или атомы других химических элементов.
- количество одинаковых заместителей обозначается приставками: 2-ди; 3-три; 4-тетра.
4. Основу названия составляет название углеводорода, соответствующее пронумерованному числу атомов углерода с использованием суффиксов: -ан для углеводородов с простыми связями между атомами углерода в цепочке, -ен для углеводородов с двойными связями между атомами углерода в цепочке, -ин для углеводородов с тройными связями между атомами углерода в цепочке.
Преобладающим типом связи в молекулах органических соединений является ковалентная связь. Пара электронов связи поделена между атомами в примерно равной степени, если характеризовать связи С-С или С-Н. Это вызвано примерно равным сродством к электрону (электроотрицательностью) атомов С и Н.
В случае, когда углерод связан с более электроотрицательным атомом (галогены, кислород, азот), связь может быть в значительной степени поляризована, а на атомах могут образовываться частичные положительные (на углероде) и отрицательные (на атомах галогенов, кислорода, азота) заряды. Однако степень ионности такой связи минимальна.
Вследствие неполярности связи С-С и С-Н преимущественным способом ее разрыва является гомолитический, когда пара электронов делится поровну между атомами. При таком разрыве связи образуются незаряженные, но очень реакционно-способные частицы с неспаренными электронами, называемые радикалами. Для алканов характерны реакции с промежуточным образованием радикалов. Инициируются такие превращения введением извне энергии, достаточной для разрыва связи (нагрев) или соединений, инициирующих образование радикалов при слабом нагревании или облучении ультрафиолетом (перекиси, галогены, азосоединения, химические инициаторы, генерирующие радикалы в результате химической реакции). В общем и целом, алканы и циклоалканы с ненапряженными циклами химически относительно инертны.
В отличие от них, алкены значительно более реакционноспособны. Причиной этого является ненасыщенность (кратная связь) и доступность рыхлой электронной плотности перекрывающихся р-орбиталей -связи для действия электрофильных реагентов (соединений с пустыми внешними орбиталями или электронодефицитных соединений).
При образовании ковалентной связи в молекулах органических соединений общая электронная пара заселяет связывающие молекулярные орбитали, имеющие более низкую энергию. В зависимости от формы молекулярных орбиталей (МО) -МО или -МО образующиеся связи относят к - или -типу.
-Связь ковалентная связь, образованная при перекрывании s-, р- и гибридных атомных орбиталей (АО) вдоль оси, соединяющей ядра связываемых атомов (т.е. при осевом перекрывании АО).
-Связь ковалентная связь, возникающая при боковом перекрывании негибридных р-АО. Такое перекрывание происходит вне прямой, соединяющей ядра атомов.


-Связи возникают между атомами, уже соединенными -связью (при этом образуются двойные и тройные ковалентные связи).
-Связь слабее -связи из-за менее полного перекрывания р-АО.
Вопросы для закрепления теоретического материала к практическому занятию
Что такое изомеры?
Что такое изомерия?
Что называют радикалом?
Задания для практического занятия:
Решить предложенные задачи.
Правильно оформить их в тетрадь для практических и контрольных работ.
Ответить на все вопросы для контроля.
Отчитаться о выполненной работе преподавателю.
Задание
Написать структурные формулы следующих углеводородов
| Вариант 1 | Вариант 2 |
| 2,3-диметилпентан 2,3,4-триметилпентан 2,3-диметилгексен-3 2,5,5-триметилгексен-2 2-метилбутадиен-1,3 бутин-2 4,4-диметилпентин-2 | 3-метил-3-этилпентан 2,4-диметил-3,3 -диэтилпентан 2,2,6-триметил-4этилгептен-3 2-метилбутен-2 2-метилгексадиен-1,5 пентин-2 2,2,5-триметилгексин-3 |
Образец решения задания
Написать структурные формулы следующих углеводородов:
3-метил-4-этилгексан
3,4-диметилпентен-2
2-метил-5этилгексин-3.
Решение
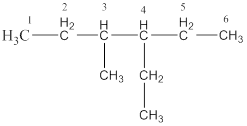
1. Имеем 3-метил-4-этилгексан, молекула содержит в структуре гексан (С6).
1.1. Записывают линейную углеродную цепь С6: С–С–С–С–С–С.
1.2. Определяют, к какому классу углеводородов принадлежит данное соединение. Определение производят с помощью общих формул для углеводородов разных классов (CnH2n+2, CnH2n и т. п.). Вещество 3-метил-4-этилгексан – алкан, (n = 6). Значит, все связи в молекуле одинарные и нет циклов.
1.3. Нумеруют атомы С углеродной цепи (углеродного скелета) и при С-3 помещают метильную группу, при С-4 помещают этильную группу:

1.4. Записывают необходимое число атомов водорода при каждом углероде цепи, учитывая, что валентность углерода равна четырем. В результате получают изомер:
2. Имеем 3,4-диметилпентен-2, молекула содержит в структуре пентен (С5) и одну двойную связь (суффикс -ен указывает на наличие одной двойной связи после 2 атома углерода)
2.1. Записывают линейную углеродную цепь С5: С–С=С–С–С.
2.2. Определяют, к какому классу углеводородов принадлежит данное соединение. Определение производят с помощью общих формул для углеводородов разных классов (CnH2n+2, CnH2n и т. п.). Вещество 3,4-диметилпентен-2 – алкен, (n = 5). Значит, в молекуле есть одна двойная связь и нет циклов.
23. Нумеруют атомы С углеродной цепи (углеродного скелета) и при С-3 и С-4 помещают по одной метильной группе (приставка ди- в исходной молекуле указывает на наличие двух функциональных групп одного вида, в данном примере метильных групп):

2.4. Записывают необходимое число атомов водорода при каждом углероде цепи, учитывая, что валентность углерода равна четырем. В результате получают изомер:

3. Имеем 2-метил-5-этилгексин-3 молекула содержит в структуре гексин (С6).
3.1. Записывают линейную углеродную цепь С6: С–С–С–С–С–С.
3.2. Определяют, к какому классу углеводородов принадлежит данное соединение. Определение производят с помощью общих формул для углеводородов разных классов (CnH2n+2, CnH2n и т. п.). Вещество 2-метил-5этилгексин-3 – алкин, (n = 6). В молекуле есть одна тройная связь после 3 атома углерода (С-3) и нет циклов.
3.3. Нумеруют атомы С углеродной цепи (углеродного скелета) и при С-2 помещают одну метильньную группу, при С-5 помещают этильную группу:

3.4. Записывают необходимое число атомов водорода при каждом углероде цепи, учитывая, что валентность углерода равна четырем. В результате получают изомер:

Вопросы для контроля
Какова валентность углерода в органических соединениях?
Какие связи между атомами углерода вы знаете?
Что собой представляет - (сигма) и - (пи) связи?
Форма контроля выполнения практического задания:
Выполненная работа представляется преподавателю в тетради для выполнения практических и контрольных работ по дисциплине «Химия».























