
Агрегатные состояния веществ

агрегатные состояния вещества
Газ
Жидкость
Твёрдое вещество
Плазма

- Газ – агрегатное состояние вещества, в котором молекулы движутся хаотически, расположены на большом расстоянии друг от друга.
- В твердых телах расстояния между частицами малы, сила притяжения соответствует силе отталкивания.
- Жидкость – агрегатное состояние, промежуточное между твердым и газообразным. В жидкости частицы расположены близко одна к другой и могут перемещаться друг относительно друга; жидкость, как и газ, не имеет определенной формы.
- Пла́зма - сильно разряжённый газ, в котором хаотически движущиеся электрически заряженные частицы - электроны и положительно заряженные ядра атомов или ионов.).

Агрегатные состояния одного и того же вещества не отличаются химическими св-ми и составом, а физические св-ва их неодинаковы. Пример - H2O(вода).
Различия в физических св-вах обусловлены тем, что частицы в газообразных, жидких и твёрдых вещ-вах расположены на неодинаковом расстоянии друг от друга , благодаря чему силы притяжения, действующие между ними, проявляются в неодинаковой степени

Основные положения мкт
- Все вещества – жидкие, твердые и газообразные – образованы из мельчайших частиц – молекул, которые сами состоят из атомов («элементарных молекул»). Молекулы химического вещества могут быть простыми и сложными и состоять из одного или нескольких атомов. Молекулы и атомы представляют собой электрически нейтральные частицы. При определенных условиях молекулы и атомы могут приобретать дополнительный электрический заряд и превращаться в положительные или отрицательные ионы.
- Атомы и молекулы находятся в непрерывном хаотическом движении.
- Частицы взаимодействуют друг с другом силами, имеющими электрическую природу. Гравитационное взаимодействие между частицами пренебрежимо мало.

1. Учение об агрегатных состояниях 1.1 Введение
Фазовый переход – переход вещества из одного агрегатного состояния в другое
- Ж-Г парообразование (испарение)
- Т-Г возгонка (сублимация)
- Г-Ж сжижение (конденсация) твердое и жидкое
- Г-Т десублимация (конденсация) состояние - конденсированное
- Т-Ж плавление
- Ж-Т отвердевание (замерзание)
Фазовые переходы сопровождаются
поглощением или выделением теплоты

1. Учение об агрегатных состояниях 1.2. Газообразное состояние вещества
Газ – агрегатное состояние вещества, в котором составляющие его частицы (атомы, молекулы, ионы) не связаны или связаны очень слабо силами взаимодействия, движутся свободно, заполняя весь предоставленный им объем.
Основные характеристики газов:
- имеют низкую плотность, т.к. частицы далеко отстоят друг от друга не имеют ни собственной формы, ни собственного объема; они полностью заполняют сосуд, в котором находятся, и принимают его форму легко сжимаются.
- имеют низкую плотность, т.к. частицы далеко отстоят друг от друга
- не имеют ни собственной формы, ни собственного объема; они полностью заполняют сосуд, в котором находятся, и принимают его форму
- легко сжимаются.

Уравнение состояния идеального газа
Идеальный газ – теоретичекая модель газа, в которой пренебрегают размерами и взаимодействием частиц газа и учитывают лишь их упругие столкновения
или
Идеальный газ - газ в котором отсутствуют силы притяжения между молекулами.

1. Учение об агрегатных состояниях 1.2. Газообразное состояние вещества
Идеальный газ
Реальный газ
- частицы газа (атомы, молекулы, ионы) принимаются за материальные точки (т.е. не имеют объема)
- между частицами отсутствуют силы взаимного притяжения (межмолекулярные силы)
- взаимодействие между молекулами сводится к абсолютно упругим ударам (т.е. ударам, при которых кинетическая энергия полностью переносится с одного объекта на другой)
- частицы газа (атомы, молекулы, ионы) имеют объем
- частицы газа связаны между собой силами взаимодействия, которые уменьшаются с увеличением расстояния между частицами
- соударения между молекулами не являются абсолютно упругими
Реальный газ похож на идеальный при сильном разрежении и при обычных температурах

Газовые законы
Уравнение состояния идеального газа (уравнение Менделеева-Клапейрона) – соотношение, связывающее между собой значения давления, объема и температуры:
где n - число молей газа, R = 8,31431 Дж/моль.К) - газовая постоянная
Газ, подчиняющийся этому закону, называется идеальным.
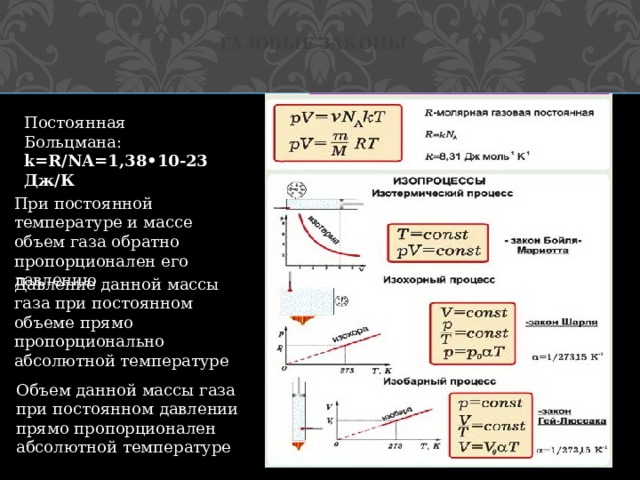
Газовые законы
Постоянная Больцмана: k=R/NA=1,38•10-23 Дж/К
При постоянной температуре и массе объем газа обратно пропорционален его давлению
Давление данной массы газа при постоянном объеме прямо пропорционально абсолютной температуре
Объем данной массы газа при постоянном давлении прямо пропорционален абсолютной температуре

Газовые законы
Идеальные газы обладают одинаковым мольным объемом.
при н. у. = 22,4140 дм 3 (л)
При других температурах и давлениях эта величина будет другой!

Реальные газы
Не подчиняются законам идеальных газов. Основными причинами отклонений являются взаимное притяжение молекул газа и наличие у них собственного объема
Характеристикой отклонений может служить мольный объем

Реальные газы
Реальные газы не подчиняются уравнению Менделеева –Клапейрона.
Уравнение состояния реального газа (уравнение Ван-дер-Ваальса)
для одного моля
для n молей
а – учитывает межмолекулярные взаимодействия;
b – учитывает собственный объем молекул.
Коэффициенты а и b для разных газов различны, поэтому уравнение Ван-дер-Ваальса не является универсальным.
При низких давлениях и высоких температурах уравнение Ван-дер-Ваальса переходит в уравнение состояния идеального газа.
2

Жидкое состояние вещ-ва
Основным свойством жидкости, отличающим её от других агрегатных состояний, является способность неограниченно менять форму под действием касательных механических напряжений, даже сколь угодно малых, практически сохраняя при этом объём.
Жидкое состояние обычно считают промежуточным между твёрдым телом и газом: газ не сохраняет ни объём, ни форму, а твёрдое тело сохраняет и то, и другое.

Свойства жидкостей:
- колебательно-поступательное движение молекул,
- несжимаемость вследствие внутреннего давления,
- ассоциация (в случае полярных молекул),
- наличие ближнего порядка при отсутствии дальнего,
- поверхностное натяжение,
- вязкость.

Свойства жидкостей
Вязкость –
сопротивление перемещению одного
слоя жидкости относительно другого
Поверхностное натяжени е
На образов. капли действуют силы в поверхностном слое жидкости, стремящиеся образовать самую наименьшую поверхность при данном объёме. Это силы поверхностного натяжения.

Свойства жидкостей
Испарение - процесс перехода молекулы жидкости в парообразное состояние. Испарение протекает при любых температурах
Когда давление паров над жидкостью достигает величины внешнего атмосферного давления и пар по мере испарения удаляется (давление не растёт), наблюдается бурное испарение со всех слоёв жидкости - кипение

Свойства твёрдых тел:
- колебательный характер движения,
- сохранение формы и объёма.
Известно 230 различных геометрических типов кристаллических решёток и их комбинаций, которые разбиваются на 32 класса и 7 систем. В основе каждой системы лежит элементарная кристаллическая ячейка, последовательное и многократное повторение которой в объёме образует пространственную кристаллическую решётку. Форма кристаллов зависит от того по какому закону построена элементарная ячейка.

свойства твёрдых тел
Кристаллические тела
Аморфные тела
Имеют кристаллическую решётку, ближний и дальний порядок, анизотропны (свойства неодинаковы в разных направлениях)
Не имеют кристаллической решётки, имеют только ближний порядок, изотропны

Кристаллические решетки
одинаковое строение кристаллической решётки у веществ разного состава.
Примеры: KH2PO4 и NaH2PO4, KAl(SO4)2 и NH4Cr(SO4)2
наличие разных кристаллических форм у одного вещества




































