

ОРГАНИЧЕСКИЕ ВЕЩЕСТВА
Низкомолекулярные
Высокомолекулярные
(полимеры)
Периодические
(регулярные)
Непериодические
(нерегулярные)

Белки (протеины) – это высо-
комолекулярные непериоди-
ческие полимерные соединения мономерами которых служат аминокислоты .
аминокислот
- В составе белков – 20 видов
аминокислот

Состав белков
Аминокислоты (аминокарбоновые кислоты) — полярные соединения, содержащие аминогруппу ( - NH 2 ) и карбоксильную группу ( - COOH) , обеспечивающую свойства кислоты .
АМФОТЕРНОЕ ВЕЩЕСТВО

Формы молекул белка.
- R1 - Глицин (гли)
- R2 – Аланин (ала)
- R3 – Валин (вал) *
- R4 – Лейцин (лей) *
- R5 – Изолейцин (илей) *
- R6 – Серин (сер)
- R7 – Треонин (тре) *

- R 8 – Тирозин ( тир )
- R 9 – Фенилаланин (фен) *
- R 10 – Триптофан (три) *
- R 11 – Аспарагиновая кислота (анс)
- R 12 – Глутаминовая кислота (глн)
- R 13 – Лизин (лиз) *
- R 14 – Аргинин (арг) *

- R15 – Гистидин (гис) *
- R16 – Аспорагин (асп)
- R17 – Глутамин (глу)
- R18 – Цистеин (цис)
- R19 – Метионин (мет) *
- R20 – Пролин (про)

Виды радикалов:
- гидрофобные (глицин, аланин, валин, изолейцин, лейцин, фенилаланин, тирозин, метионин)
- гидрофильные (остальные 12)
- кислотные (аспарагиновая кислота, глутаминовая кислота)
- основные (лизин, аргинин, гистидин)

Аминокислоты
Заменимые
синтезируются в организме
(10)
Незаменимые
в организме не синтезируются
(10)
В зависимости от аминокислотного состава , белки бывают:
1. Полноценными – белки, содержащие весь набор
аминокислот (20 разных аминокислот);
2. Неполноценными – белки, в составе которых какие-то
аминокислоты отсутствуют.
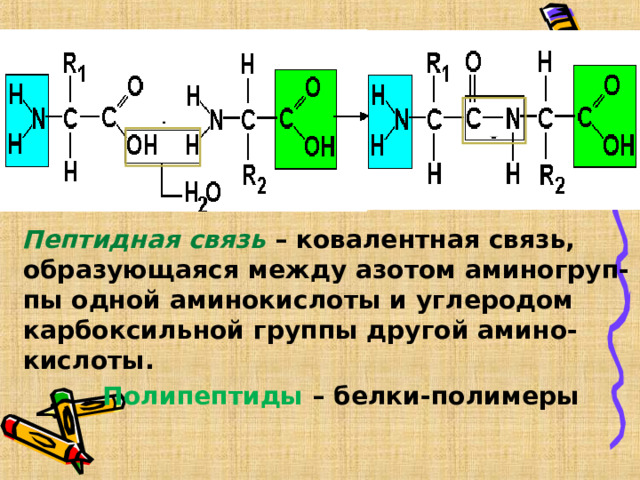
Пептидная связь – ковалентная связь, образующаяся между азотом аминогруп- пы одной аминокислоты и углеродом карбоксильной группы другой амино- кислоты.
Полипептиды – белки-полимеры

Структуры белка
Первичная структура белка - специфическая аминокислотная последовательность, т.е. порядок чередования аминокислотных остатков в полипептидной цепи.
Ф.Сэнгер -
расшифровал инсулин

Вторичная структура белка - конформация полипептидной цепи, т.е. способ скручивания цепи в пространстве за счет водородных связей между группами NH и CO .

Третичная структура белка - форма закрученной спирали в пространстве, образованная главным образом за счет дисульфидных мостиков -S-S-, водородных связей, гидрофобных и ионных взаимодействий.

Четвертичная структура белка – агрегаты нескольких белковых макромолекул (белковые комплексы), образованные за счет взаимодействия разных полипептидных цепей
Глобулы удерживаются вместе благодаря ионным, гидрофильно-гидрофобным и электростатическим взаимодействиям.


Свойства белков
- Растворимость
- Денатурация
- Ренатурация
обратимая
необратимая

Виды белков.
ПРОСТЫЕ
(ПРОТЕИНЫ)
СЛОЖНЫЕ
- хромопротеины
- гликопротеины
- липопротеины
- металлопротеины
- фосфопротеины
- альбумины
- глобулины
- гистоны
- фибриллярные
глобулярные
белки
фибриллярные


Строительная
Белки участвуют в образовании всех
мембран и органоидов клетки.
белок
кератин

Строительная функция
Аминокислоты
в клетках
Белки пищи
Аминокислоты в
тонком кишечнике
Синтез собственных
(специфических)
белков
Использование белков для построения
внутриклеточных структур и наружной
плазматической мембраны клетки

Каталитическая
В каждой клетке имеются сотни ферментов.
Они помогают осуществлять биохимические
реакции, действуя как катализаторы.

Транспортная
Белки связывают и переносят
различные вещества и внутри
клетки, и по всему организму.
Например, г е м о г л о б и н
крови переносит кислород .

Транспортная
- Транспортная функция белка проявляется в перенос e кислорода и углекислого газа с помощью белка глобина.
Гем (небелковая
часть, содержащая + Глобин(белок)
железо)
Гемоглобин (находится в эритроците)
Состояние гемоглобина
Гемоглобин + углекислый газ
(образуется в капиллярах большого
круга кровообращения)
Гемоглобин + кислород (обра-
зуется в капиллярах легких )

Регуляторная
Белки гормоны регулируют
различные физиологические
процессы.
инсулин регулирует уровень
углеводов в крови.

Регуляторная
Поджелудочная железа
Гормон инсулин
Регулирует процесс превращения
углеводов в организме
Глюкоза (в крови) гликоген (в клетках печени)

Защитная
Предохраняют организм от вторжения чужеродных организмов и от повреждений
Антитела блокируют чужеродные
белки
Например, фибриноген и протромбин
обеспечивают свертываемость крови

Защитная
- Защитная функция белка заключается в выработке
белков – антител, уничтожающих возбудителей болезней, попавших в организм
Лейкоциты (клетки
крови)
Выработка антител
белковой природы
Негативное воздействие
на возбудителя болезни
(чужеродный белок)
Иммунитет

Сократительная
Белки - участвуют в сокращении
мышечных волокон.
Актин и миозин – белки мышц

Сигнальная
(рецепторная)
Белки способны реагировать на изменение условий среды.
Обеспечивают
организму свойство
РАЗДРАЖИМОСТИ

Энергетическая
При недостатке углеводов или жиров
окисляются молекулы аминокислот.
При полном расщеплении белка до конечных продуктов
выделяется энергия:
1г белка - 17.6 кДж
Но в качестве источника энергии белки
!!!
используются крайне редко.

Определите функции белков:
- Коллаген сухожилий
- Яичный альбумин
- Инсулин
- Кератин волос
- Тромбин крови
- Родопсин сетчатки
- Альбумин крови
- Интерферон


- Ферменты - от латинского fermentum – закваска
- Ферменты - белковые специфические
катализаторы
- Ферменты стимулируют обмен веществ
- Субстрат – вещество, связывающееся с
ферментом для осуществления
реакции

Строение фермента
1 – субстратный центр
2 – активный центр
3 – регуляторный центр
(аллостерический)

Механизм действия фермента
Е
S
E - S
E - P
Е
P
E – фермент Е- S – фермент-субстратный комплекс
S – субстрат E- Р – фермент-продуктный комплекс
Р – продукты реакции

Зависимость скорости ферментативных реакций

Действие ингибиторов и активаторов на фермент

Роль белков в жизни клетки огромна.
Современная биология показала, что
сходство и различие организмов
определяется в конечном счете
набором белков.























































