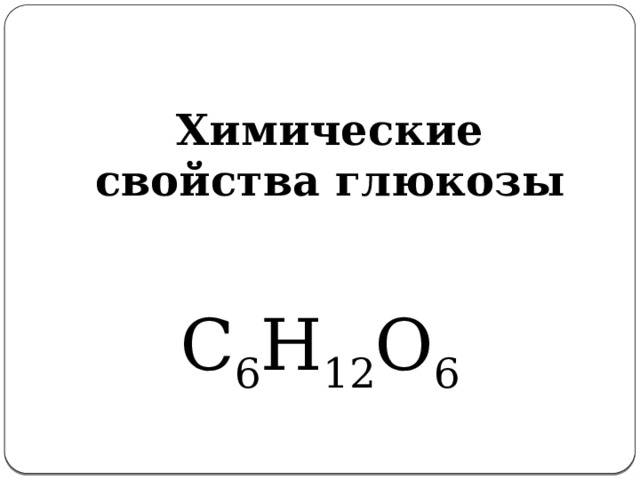
Химические свойства глюкозы
С 6 Н 12 О 6
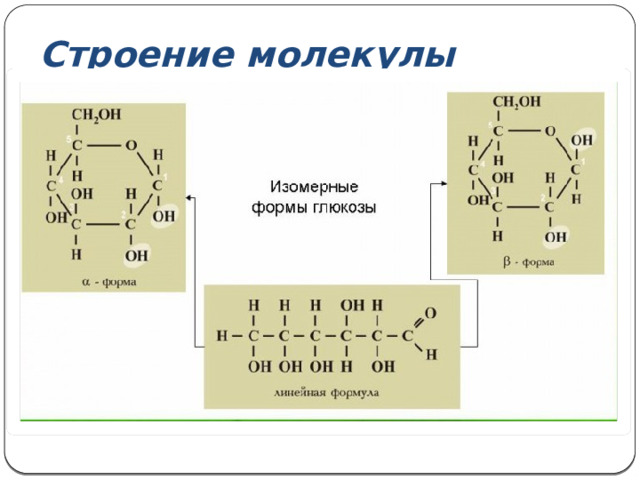
Строение молекулы

Цель:
изучить свойства глюкозы

Задачи:
- Спрогнозировать свойства глюкозы, исходя из ее строения.
2. исследовать химические свойства глюкозы как многоатомного спирта экспериментально.
3. исследовать химические свойства глюкозы как альдегида экспериментально.
4. Исследовать специфические свойства глюкозы



ХИМИЧЕСКИЕ СВОЙСТВА ГЛЮКОЗЫ
I. Как многоатомный спирт
1) Взаимодействие с гидроксидом меди (II) без нагревания:
II. Свойства многоатомных спиртов
1. Взаимодействие с гидроксидом меди (II) без нагревания: (слайд №17)
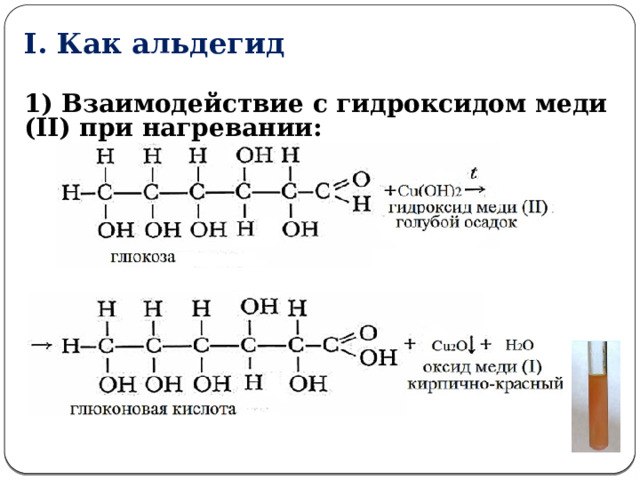
I. Как альдегид
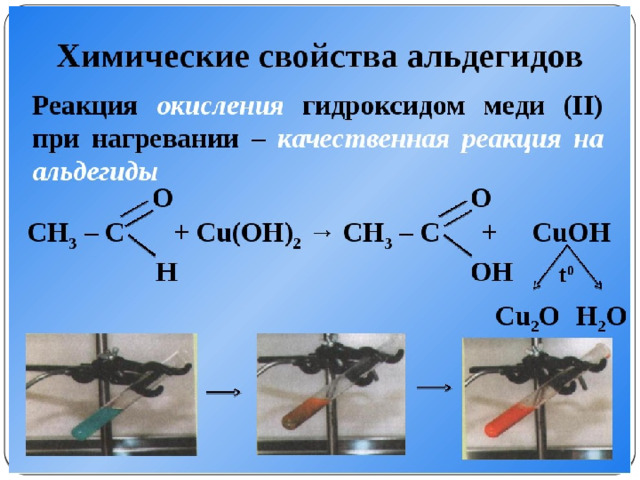
1) Взаимодействие с гидроксидом меди (II) при нагревании:
2. Окисление гидроксидом меди (II) при нагревании: (слайд №15)
- Допишите уравнение реакции
t
СH 2 OH(CHOH) 4 -COH + 2Cu(OH) 2 → СH 2 OH(CHOH) 4 -COOH + Cu 2 O↓ + 2H 2 O
глюконовая кислота
![2) Реакция “серебряного зеркала”: СH 2 OH(CHOH) 4 -COONH 4 + 2Ag↓+ 3NH 3 + H 2 O 2. Химические свойства глюкозы. I. Свойства альдегидов - Какие свойства альдегидов характерны для глюкозы? 1. Реакция серебряного зеркала: (слайд №14) - Допишите уравнение реакции СH 2 OH(CHOH) 4 -COH + 2[Ag(NH 3 ) 2 ]OH → СH 2 OH(CHOH) 4 -COONH 4 + 2Ag↓+ 3NH 3 + H 2 O глюконат аммония Просмотр видеоопыта «Качественная реакция глюкозы с аммиачным раствором оксида серебра (I) (реактивом Толленса)»](https://fsd.multiurok.ru/html/2022/04/12/s_62552110a3441/img9.jpg)
2) Реакция “серебряного зеркала”:
СH 2 OH(CHOH) 4 -COONH 4 + 2Ag↓+ 3NH 3 + H 2 O
2. Химические свойства глюкозы.
I. Свойства альдегидов
- Какие свойства альдегидов характерны для глюкозы?
1. Реакция серебряного зеркала: (слайд №14)
- Допишите уравнение реакции
СH 2 OH(CHOH) 4 -COH + 2[Ag(NH 3 ) 2 ]OH → СH 2 OH(CHOH) 4 -COONH 4 + 2Ag↓+ 3NH 3 + H 2 O
глюконат аммония
Просмотр видеоопыта «Качественная реакция глюкозы с аммиачным раствором оксида серебра (I) (реактивом Толленса)»
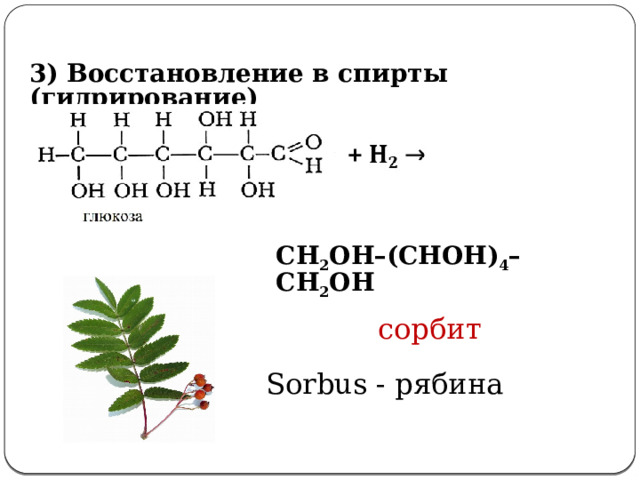
3) Восстановление в спирты (гидрирование)
СН 2 ОН–(СНОН) 4 –СН 2 ОН
сорбит
3. Восстановление в спирты: (слайд №16)
t, Ni
СH 2 OH(CHOH) 4 -COH + H 2 → СH 2 OH(CHOH) 4 -CH 2 OH
сорбит
Сорбит – кристаллическое вещество, вдвое слаще сахара, впервые был выделен из листьев рябины (sorbus-рябина). Нетоксичен, используется как заменитель сахара, особенно больным сахарным диабетом).
Sorbus - рябина
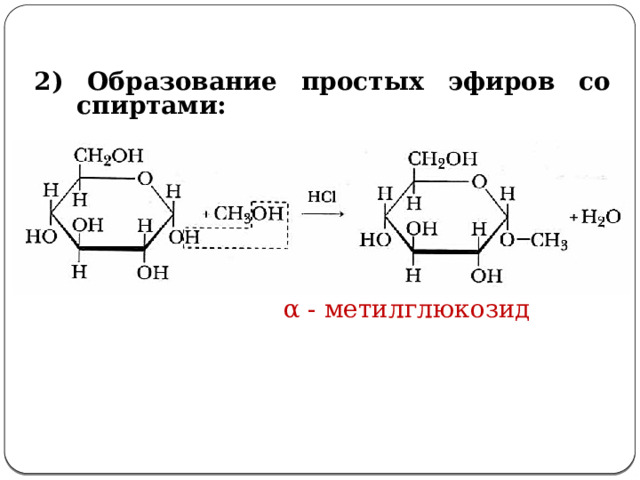
2) Образование простых эфиров со спиртами:
α - метилглюкозид
2. Образование простых эфиров со спиртами: (слайд №18)

III. Специфические:
а) Спиртовое брожение (под действием дрожжей):
С 6 Н 12 О 6 2С 2 Н 5 ОН + 2СО 2
глюкоза этанол
В пивоварении, виноделии.
III. Специфические свойства
Важнейшим свойством моносахаридов является их ферментативное брожение, т.е. распад молекул на осколки под действием различных ферментов. Брожение происходит в присутствии ферментов, выделяемых дрожжевыми грибками, бактериями или плесневыми грибками. В зависимости от природы действующего фермента различают реакции следующих видов:
а) Спиртовое брожение (под действием дрожжей): (слайд №19)
дрожжи
С 6 Н 12 О 6 → 2С 2 Н 5 ОН + 2СО 2
этанол

б) Молочнокислое брожение (под действием молочнокислых бактерий):
- изготовление кисло-молочных продуктов;
- при консервировании, квашении, силосовании кормов;
б) Молочнокислое брожение (под действием молочнокислых бактерий): (слайд №20)
изготовление кисло-молочных продуктов;
при консервировании, квашении, силосовании кормов;
в условиях недостатка кислорода глюкоза превращается в молочную кислоту, которая обуславливает боли в мышцах в момент физической нагрузки и после нее.

в ) Маслянокислое брожение:
С 6 Н 12 О 6 С 3 Н 7 СООН + 2Н 2 ↑ +2СО 2 ↑
глюкоза масляная кислота
г) Окисление:
C 6 H 12 O 6 + 6O 2 → 6H 2 O + 6CO 2 + Q
в) Маслянокислое брожение: (слайд №21)
С 6 Н 12 О 6 С 3 Н 7 СООН + 2Н 2 ↑ +2СО 2 ↑
глюкоза масляная кислота
г) Окисление: (слайд №21)
C 6 H 12 O 6 + 6O 2 → 6H 2 O + 6CO 2 + 2800 кДж
Источник энергии для организма, окисление кислородом воздуха, выделяющаяся энергия запасается в виде АТФ.
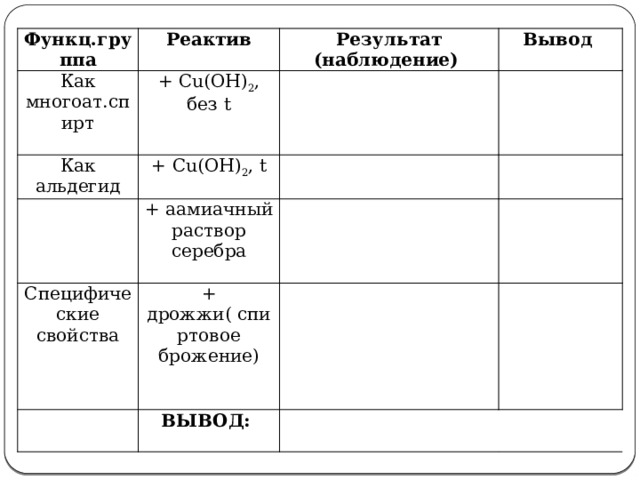
Функц.группа
Реактив
Как многоат.спирт
Результат (наблюдение)
+ Cu(OH) 2 , без t
Как альдегид
Вывод
+ Cu(OH) 2 , t
Специфические свойства
+ аамиачный раствор серебра
+ дрожжи( спиртовое брожение)
ВЫВОД:
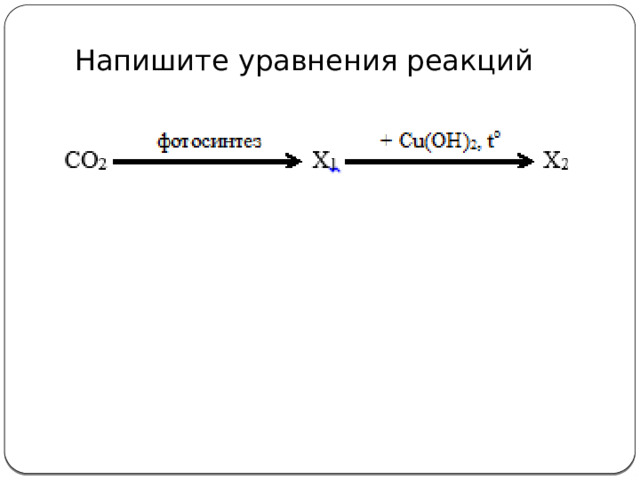
Напишите уравнения реакций

Рефлексия
- Испытывали ли трудности? Какие?

Домашнее задание:
§17, упр.7,8
















![2) Реакция “серебряного зеркала”: СH 2 OH(CHOH) 4 -COONH 4 + 2Ag↓+ 3NH 3 + H 2 O 2. Химические свойства глюкозы. I. Свойства альдегидов - Какие свойства альдегидов характерны для глюкозы? 1. Реакция серебряного зеркала: (слайд №14) - Допишите уравнение реакции СH 2 OH(CHOH) 4 -COH + 2[Ag(NH 3 ) 2 ]OH → СH 2 OH(CHOH) 4 -COONH 4 + 2Ag↓+ 3NH 3 + H 2 O глюконат аммония Просмотр видеоопыта «Качественная реакция глюкозы с аммиачным раствором оксида серебра (I) (реактивом Толленса)»](https://fsd.multiurok.ru/html/2022/04/12/s_62552110a3441/img9.jpg)



























